- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по теме Алюминий
Содержание
- 1. Презентация по теме Алюминий
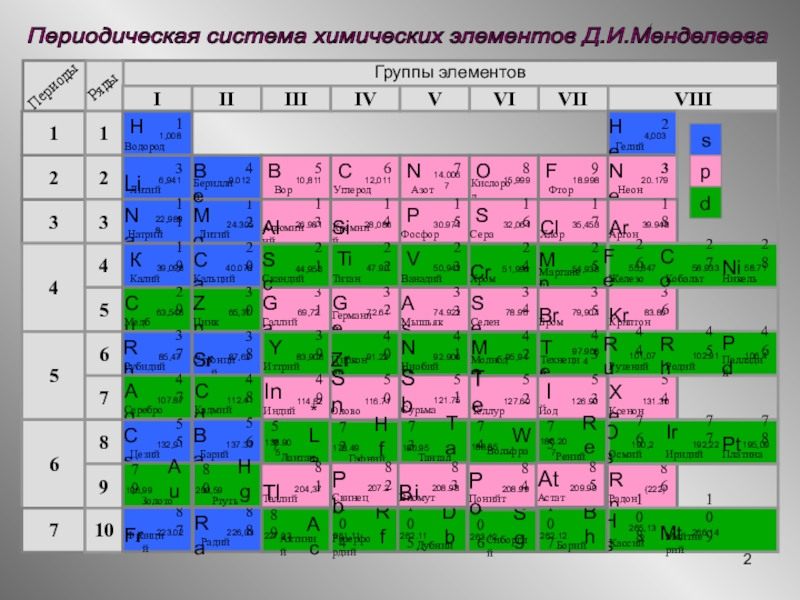
- 2. Периодическая система химических элементов Д.И.Менделеева Группы элементов IIIIIIIVVIIVIVVIII321456712345678910sdp
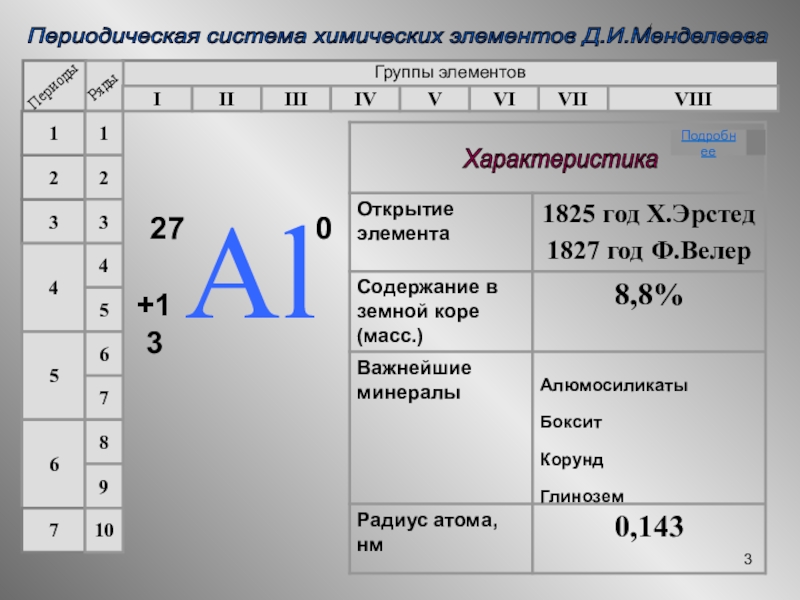
- 3. Периодическая система химических элементов Д.И.Менделеева Группы элементов IIIIIIIVVIIVIVVIII321456712345678910Характеристика Подробнее
- 4. Алюминий 2. Электронное строение
- 5. Алюминий 1. Из истории открытияглавная ДалееВпервые Al
- 6. Алюминий 1. Из истории открытияГлавная Далее
- 7. Алюминий главнаяВставьте пропущенные словаАлюминий - элемент
- 8. Алюминий 2. Электронное строение27Аl+1302e8e3e1s22s22p63s23p1Краткая электронная запись1s22s22p63s23p1Порядок заполненияглавнаяДалее
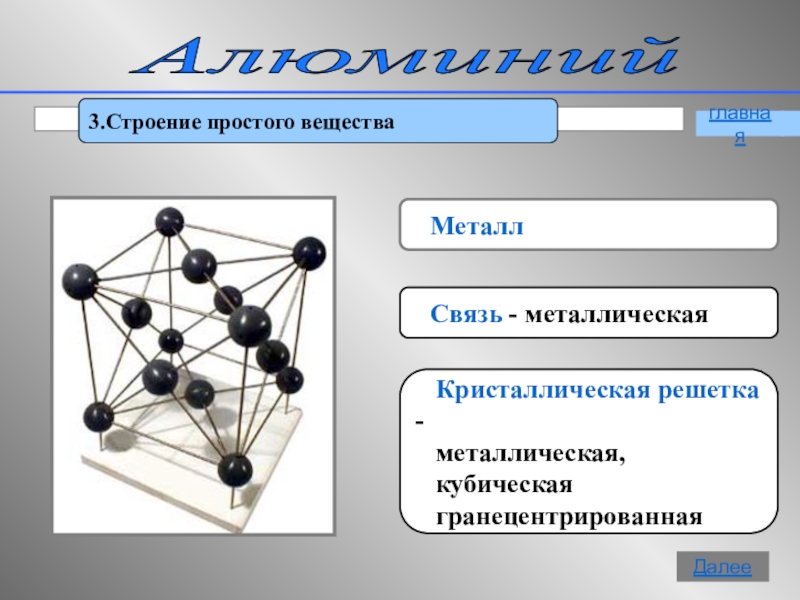
- 9. Алюминий 3.Строение простого вещества Металл
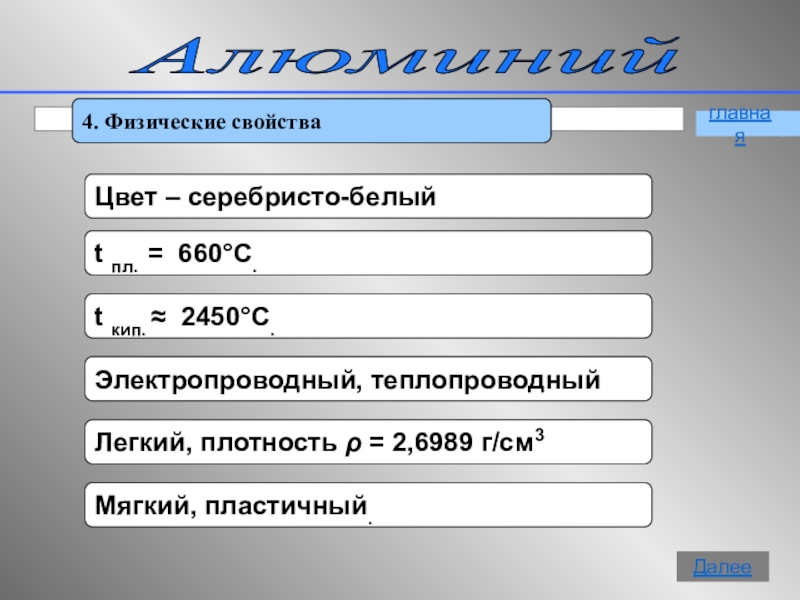
- 10. Алюминий 4. Физические свойстваглавнаяДалее
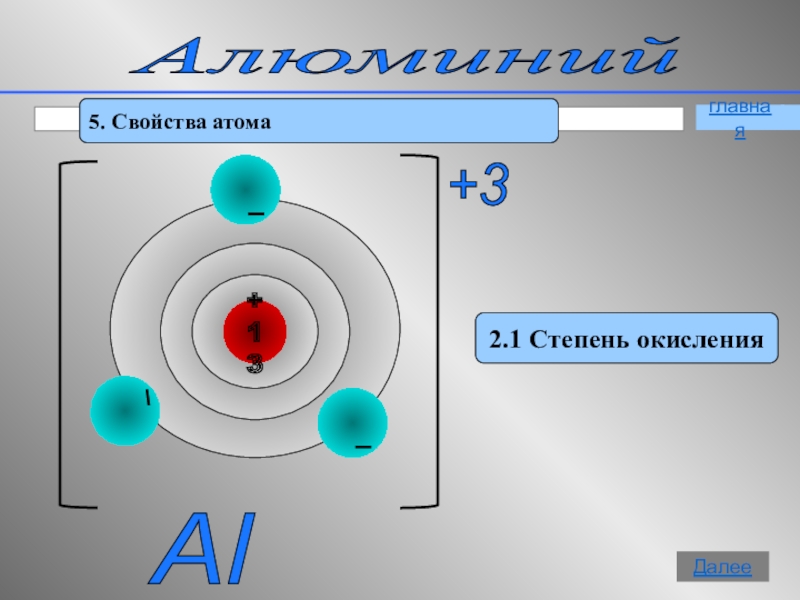
- 11. Алюминий 5. Свойства атома2.1 Степень окисленияAl +3 главнаяДалее
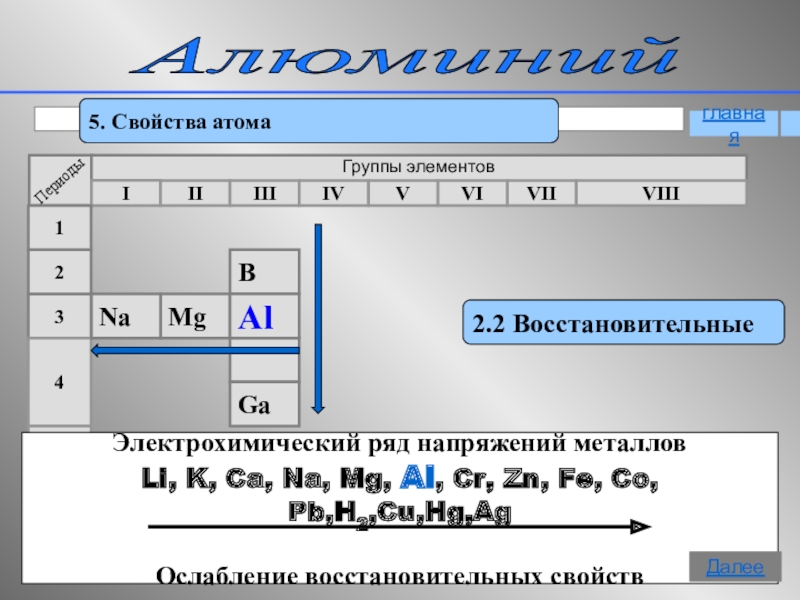
- 12. Алюминий 5. Свойства атома2.2 ВосстановительныеЭлектрохимический ряд напряжений
- 13. Алюминий 6. Химические свойства4Аl + 3O2 =
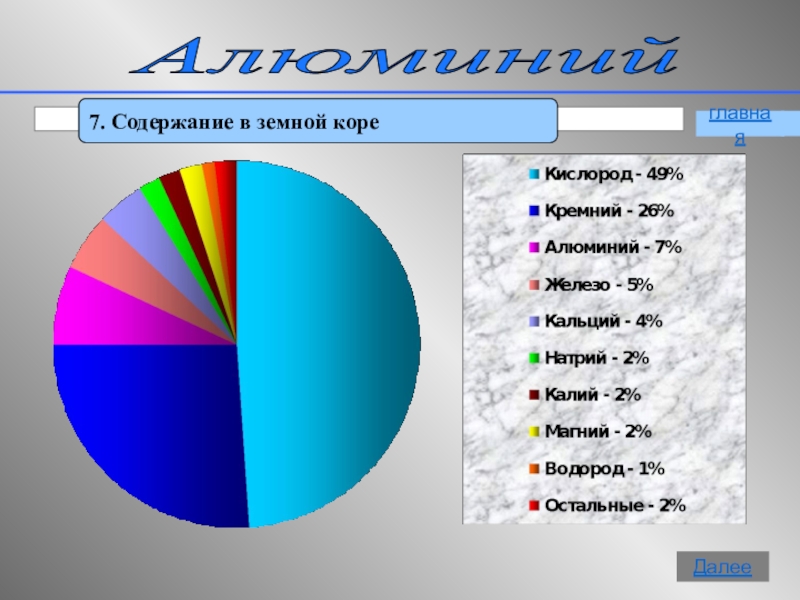
- 14. Алюминий 7. Содержание в земной кореглавнаяДалее
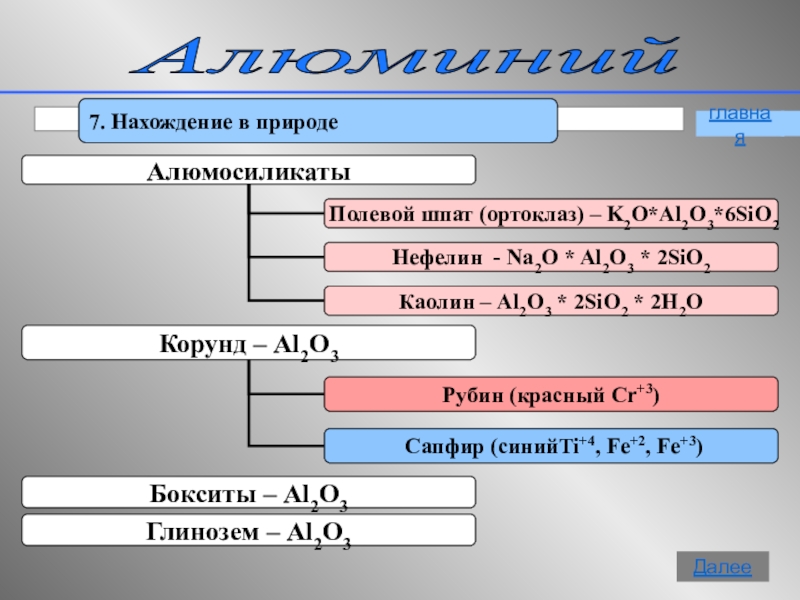
- 15. Алюминий 7. Нахождение в природеглавнаяДалее
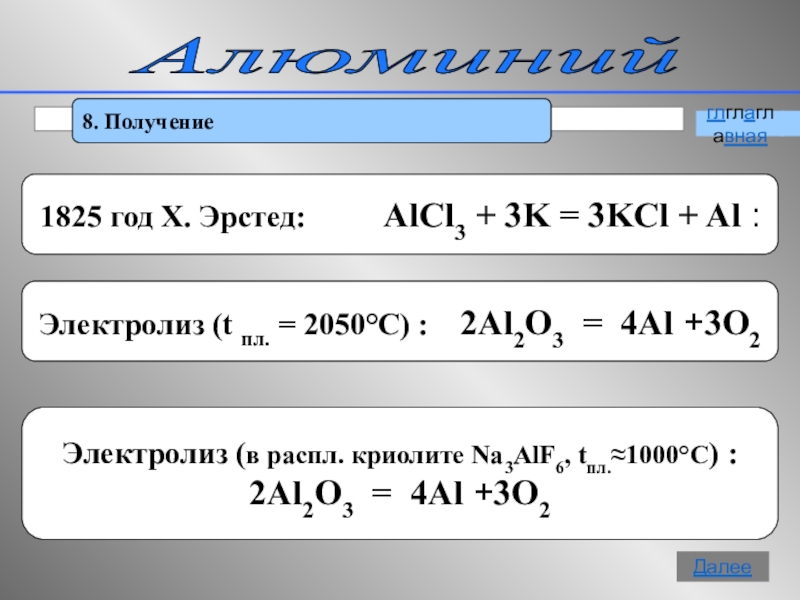
- 16. Алюминий 8. ПолучениеглглаглавнаяДалее
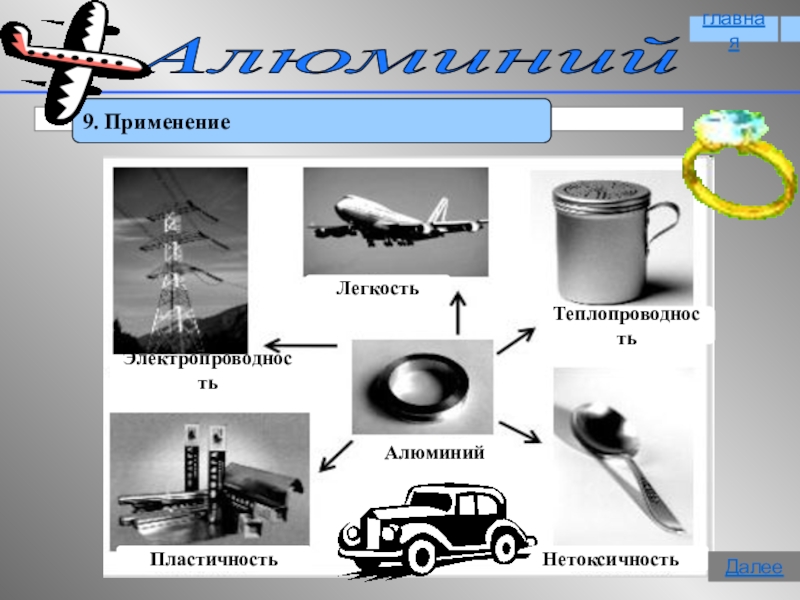
- 17. Алюминий 9. ПрименениеглавнаяДалее
- 18. Алюминий главная
Слайд 2
Периодическая система химических элементов Д.И.Менделеева
Группы элементов
I
II
III
IV
VII
VI
V
VIII
3
2
1
4
5
6
7
1
2
3
4
5
6
7
8
9
10
s
d
p
Слайд 3Периодическая система химических элементов Д.И.Менделеева
Группы элементов
I
II
III
IV
VII
VI
V
VIII
3
2
1
4
5
6
7
1
2
3
4
5
6
7
8
9
10
Характеристика
Подробнее
Слайд 4Алюминий
2. Электронное строение
5. Свойства атома
4. Физические свойства
6. Химические свойства
7. Нахождение в природе
8. Получение
9. Применение
1. Из истории открытия
Слайд 5Алюминий
1. Из истории открытия
главная
Далее
Впервые Al был получен датским физиком
в 1825 г. Название элемента происходит от лат.
алюмен, так в древности называли квасцы,
которые использовали для крашения
тканей (KAl(SO4)2 . 12H2O).
Позже в 1827 г. немецкий химик
Фридрих Велер получил алюминий
следующим способом:
Слайд 6Алюминий
1. Из истории открытия
Главная
Далее
В период открытия
Далее
Слайд 7Алюминий
главная
Вставьте пропущенные слова
Алюминий - элемент III группы, главной
Заряд ядра атома алюминия равен +13.
В ядре атома алюминия 13 протонов.
В ядре атома алюминия 14 нейтронов.
В атоме алюминия 13 электронов.
Атом алюминия имеет 3 энергетических уровня.
Электронная оболочка имеет строение 2е, 8е, 3е.
На внешнем уровне в атоме 3 электронов.
Степень окисления атома в соединениях равна +3 .
Простое вещество алюминий является металлом.
Оксид и гидроксид алюминия имеют амфотерный характер.
Далее
Слайд 8Алюминий
2. Электронное строение
27
Аl
+13
0
2e
8e
3e
1s2
2s2
2p6
3s2
3p1
Краткая электронная запись
1s2
2s2
2p6
3s2
3p1
Порядок заполнения
главная
Далее
Слайд 9Алюминий
3.Строение простого вещества
Металл
Связь - металлическая
металлическая,
кубическая
гранецентрированная
главная
Далее
Слайд 12Алюминий
5. Свойства атома
2.2 Восстановительные
Электрохимический ряд напряжений металлов
Li, K, Ca, Na,
Ослабление восстановительных свойств
главная
Далее
Слайд 13Алюминий
6. Химические свойства
4Аl + 3O2 = 2Al2O3
t
2Al
C н е м е т а л л а м и (c кислородом, с серой)
2Аl + 3Cl2 = 2AlCl3
4Al + 3C = Al4C3
C неметаллами (c галогенами, с углеродом)
(Снять оксидную пленку)
2Al + 6H2O = 2Al(OH)2 + H2↑
C в о д о й
2Al + 6HCl = 2AlCl3 + H2↑
2Al + 3H2SO4 = Al2(SO4)3 + H2↑
C к и с л о т а м и
2Al + 6NaOH + 6H2O = 2Na3[Al(OH)6] + 3H2↑
2Al + 2NaOH + 2H2O =2NaAlO2 +3H2↑
Cо щ е л о ч а м и
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
2Al + WO3 = Al2O3 + W
C о к с и д а м и м е т а л л о в
главная
Далее