- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Валентность. Валентные возможности атомов (11 кл., профильный уровень)
Содержание
- 1. Презентация по химии Валентность. Валентные возможности атомов (11 кл., профильный уровень)
- 2. Электронная конфигурация атома и валентностьосновная цель изображения
- 3. понятие «валентность» (от лат. valentia -сила) ввел
- 4. Валентность атома определяетсядля элементов главных подгрупп (S-и
- 5. Na 1S2 2S22p6 3S1валентные ēВалентность определяется числом
- 6. + энергия400 кДж/мольС 1S2 2S22p2 валентные ēЧисло
- 7. Возбуждённое состояние атомов для элементов побочных подгрупп
- 8. Валентность атома определяется числом неподеленных электронных пар
- 9. Упражнение 1:у элементов Mg, Be, Al, B
- 10. Степень окисления – условный (формальный ) заряд
- 11. неполярных связейPCl3C2H6N2Степень окисления численно совпадает с валентностью,
- 12. донорно-акцепторных связейCOHNO3O3Степень окисления численно совпадает с валентностью,
- 13. Степень окисления и ПСХЭвысшая (+) ст.ок-я большинства
- 14. Упражнение 2:определить валентность и степень окисления элементов в ионах; изобразить механизм образования связи: H3O+, BF4–, PH4+
- 15. Домашнее задание§1 стр 6, упр.1-7 записи в тетради, самостоятельная работаhttp://Учительский.сайт/Трухина-Ольга-Евгеньевна
Слайд 2Электронная конфигурация атома и валентность
основная цель изображения электронных структур атомов –
внешняя электронная оболочка атома, если она не полностью заполнена, называется валентной оболочкой;
электроны этой оболочки называются валентными ē;
число валентных ē определяет то, как атом связывается с другими атомами посредством химической связи;
путём образования химических связей атомы стремятся заполнить свои внешние валентные оболочки;
Слайд 3понятие «валентность» (от лат. valentia -сила) ввел Эдуард Франкланд (1853г);
валентность –
История становления понятия «валентность»
определяли валентность по водороду:
В(Н)=I
определяли валентность по кислороду:
В(O)=II
современное понятие «валентность» валентность – число химических связей, которое данный атом образует с другими атомами
Слайд 4Валентность атома определяется
для элементов главных подгрупп (S-и р-элементов) валентные ē находятся
для элементов побочных подгрупп (d-элементов) валентные ē, как правило, находятся на внешнем S- и предвнешнем d-подуровнях
числом неспаренных электронов
числом неподеленных электронных пар и свободных орбиталей
I
II
max валентность совпадает с №группы (искл. N, O, F )
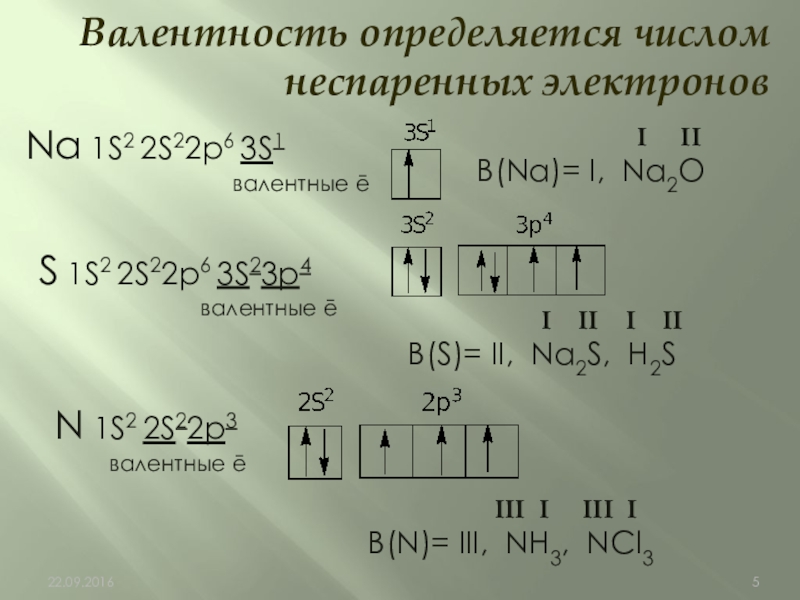
Слайд 5Na 1S2 2S22p6 3S1
валентные ē
Валентность определяется числом неспаренных электронов
S 1S2
валентные ē
I II
В(Na)= I, Na2O
I II I II
В(S)= II, Na2S, H2S
N 1S2 2S22p3
валентные ē
III I III I
В(N)= III, NH3, NCl3
Слайд 6+ энергия
400 кДж/моль
С 1S2 2S22p2
валентные ē
Число неспаренных ē-ов может увеличиваться
С* 1S2 2S12p3
валентные ē
основное или стационарное состояние атома
возбужденное состояние атома
Есв(С–Н)= 360кДж/моль
при образовании 2-х доп. связей выигрыш – 720кДж/моль, что превышает затраты на 320кДж/моль
Слайд 7Возбуждённое состояние атомов
для элементов побочных подгрупп (d-элементов)
Fe 1S2 2S22p6 3S23p63d64S2
валентные ē
Fe*
валентные ē
Fe*1S2 2S22p6 3S23p63d54S14p2
валентные ē
d-элементы
называют
переходными элементами
так же возможно и при спаривании электронов
О 1S2 2S22p4
валентные ē
S 1S2 2S22p6 3S23p4
валентные ē
S* 1S2 2S22p6 3S23p33d1
валентные ē
S**1S2 2S22p6 3S13p33d2
валентные ē
В(S)= II, Na2S, H2S
В(S)= IV, SCl4,SO2, H2SO3
В(S)= VI, SCl6, SO3, H2SO4
Слайд 8Валентность атома определяется числом неподеленных электронных пар и свободных орбиталей
в этом
В(N)= IV
В(C)= В(О)=III
молекула озона О3
молекула N2О5
В(N)= IV, В(О)= I, II
ст. ок-я(N)= +5, ст. ок-я(О)= –2
молекула HNО3
Слайд 9Упражнение 1:
у элементов Mg, Be, Al, B в соединениях всегда постоянная
каковы валентные возможности Cl и F; почему существуют различия?
Слайд 10Степень окисления – условный (формальный ) заряд атома элемента в соединении,
Валентность и степень окисления
валентность –
число хим. связей;
не имеет знака
(I, II, III);
не может равняться 0: (N≡N);
не может быть дробным числом;
имеет определенный предел применения.
степень окисления –
условный заряд атома;
имеет знак
(+) или (–);
может быть равна 0: N20;
может выражаться дробным числом KO2-½;
можно определять в любых веществах.
Трухина О.Е.
валентность и степень окисления могут совпадать или не совпадать по абсолютному значению
Слайд 11неполярных связей
PCl3
C2H6
N2
Степень окисления численно совпадает с валентностью, если в веществе нет
В(P)=
с.о.(P)= +3, с.о.(Cl)= –1
В(C)= IV, с.о.(C)= –3
В(N)= III, с.о.(N)= 0
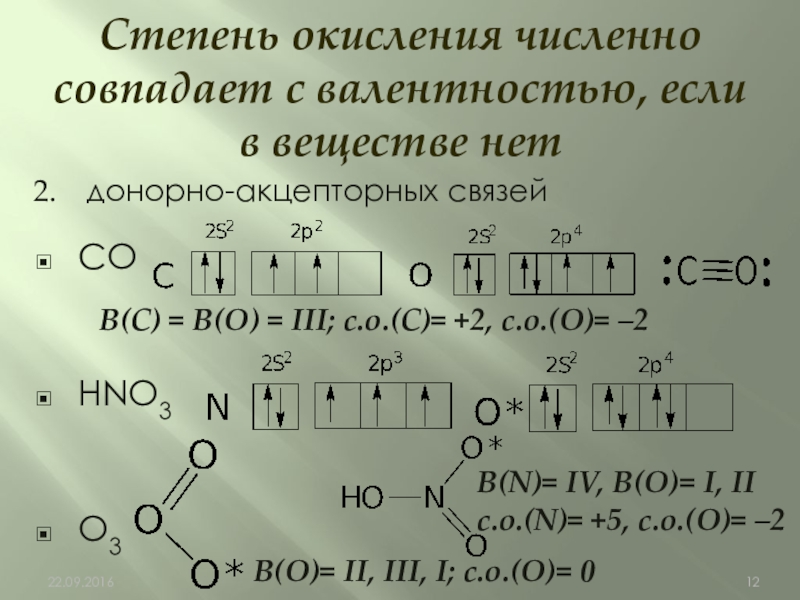
Слайд 12донорно-акцепторных связей
CO
HNO3
O3
Степень окисления численно совпадает с валентностью, если в веществе нет
В(C)
В(N)= IV, В(О)= I, II
с.о.(N)= +5, с.о.(О)= –2
В(O)= II, III, I; с.о.(O)= 0
Слайд 13Степень окисления и ПСХЭ
высшая (+) ст.ок-я большинства элементов обеих подгрупп равна
промежуточная (+) ст.ок-я м.б. любой: от 0 до max
низшая (–) ст.ок-я элемента – неметалла определяется числом электронов, которых не достает для заполнения валентного слоя (8 – №группы);
Слайд 14Упражнение 2:
определить валентность и степень окисления элементов в ионах; изобразить механизм
H3O+, BF4–, PH4+