- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии в 9 классе на тему Азотная кислота
Содержание
- 1. Презентация по химии в 9 классе на тему Азотная кислота
- 2. СОДЕРЖАНИЕ:СтроениеПолучение.Лабороторный способПромышленный способФизические свойстваХимические свойства.Общие с другими кислотамиХимические свойства.СпецифическиеТаблица 2Применение
- 3. Одна связь с кислородом образуется по
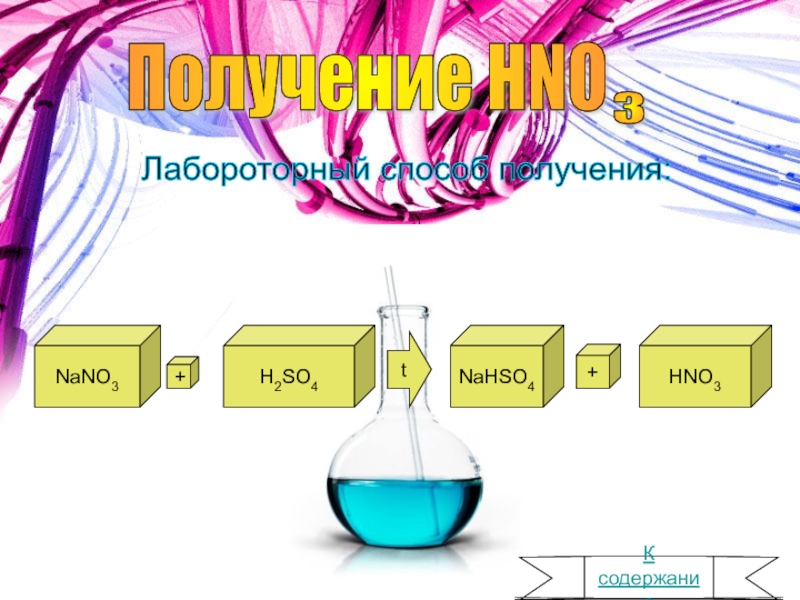
- 4. Получение HNO 3 Лабороторный способ получения: NaNO3 +H2SO4 tNaHSO4 +HNO3 К содержанию
- 5. 1) 4NH3 + 5O2 -> 4NO +
- 6. Физическиесвойствабесцветная жидкостьлетучая – на воздухе « дымит»
- 7. Химические свойства Общие с другими кислотами: 1.Сильный
- 8. Химические свойства Специфические:5. при нагревании и под
- 9. Таблица 2P.S концентрированная HNO3 >60% разбавленная
- 10. Азотная кислота широко используется для производства азотных
- 11. С началаВ содержание
СОДЕРЖАНИЕ:СтроениеПолучение.Лабороторный способПромышленный способФизические свойстваХимические свойства.Общие с другими кислотамиХимические свойства.СпецифическиеТаблица 2Применение
Слайд 2
СОДЕРЖАНИЕ:
Строение
Получение.Лабороторный способ
Промышленный способ
Физические свойства
Химические свойства.Общие с другими кислотами
Химические свойства.Специфические
Таблица 2
Применение
Слайд 3
Одна связь с кислородом образуется по донорно-акцепторному механизму, но
из-за близости расположения атомов в молекуле становятся равноценными.
Строение
К содержанию
Слайд 5
1) 4NH3 + 5O2 -> 4NO + 6H2O + Q
2) 2
NO + O2 -> 2NO2
3) 2 H2O + 4NO2 + O2 -> 4HNO3
Промышленный способ
К содержанию
Слайд 6
Физические
свойства
бесцветная
жидкость
летучая –
на воздухе
« дымит»
неограниченно
смешивается
с водой
tпл=-41,60C
tкип=82,60C
Физические свойства
К содержанию
Слайд 7
Химические свойства
Общие с другими кислотами:
1.Сильный электролит, хорошо диссоциируют на
ионы.
HNO3 -> H+ +NO3-
Изменяет окраску индикатора.
2. Реагирует с основными оксидами
СuO+2 HNO3 -> Cu(NO3)2 +H2O
3.реагирует с основаниями
HNO3 + KOH -> KNO3 + H2O
4. реагирует с солями более летучих кислот
Na2CO3 + 2HNO3 -> 2NaNO3 +H2CO3
cухая / \
H2O CO2
HNO3 -> H+ +NO3-
Изменяет окраску индикатора.
2. Реагирует с основными оксидами
СuO+2 HNO3 -> Cu(NO3)2 +H2O
3.реагирует с основаниями
HNO3 + KOH -> KNO3 + H2O
4. реагирует с солями более летучих кислот
Na2CO3 + 2HNO3 -> 2NaNO3 +H2CO3
cухая / \
H2O CO2
К содержанию
Слайд 8
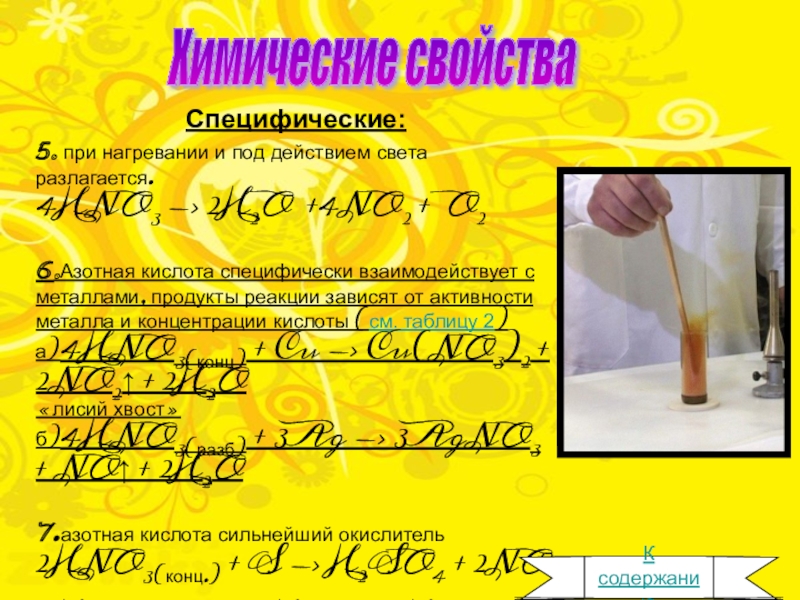
Химические свойства
Специфические:
5. при нагревании и под действием света
разлагается.
4HNO3 -> 2H2O
+4NO2 + O2
6.Азотная кислота специфически взаимодействует с металлами, продукты реакции зависят от активности металла и концентрации кислоты (см. таблицу 2)
а)4HNO3(конц) + Cu -> Cu(NO3)2 + 2NO2↑ + 2H2O «лисий хвост»
б)4HNO3(разб) + 3Ag -> 3AgNO3 + NO↑ + 2H2O
7.азотная кислота сильнейший окислитель
2HNO3(конц.) + S -> H2SO4 + 2NO
5HNO3 + 3P + 2H2O -> 3H3PO4 + 5NO↑
6.Азотная кислота специфически взаимодействует с металлами, продукты реакции зависят от активности металла и концентрации кислоты (см. таблицу 2)
а)4HNO3(конц) + Cu -> Cu(NO3)2 + 2NO2↑ + 2H2O «лисий хвост»
б)4HNO3(разб) + 3Ag -> 3AgNO3 + NO↑ + 2H2O
7.азотная кислота сильнейший окислитель
2HNO3(конц.) + S -> H2SO4 + 2NO
5HNO3 + 3P + 2H2O -> 3H3PO4 + 5NO↑
К содержанию
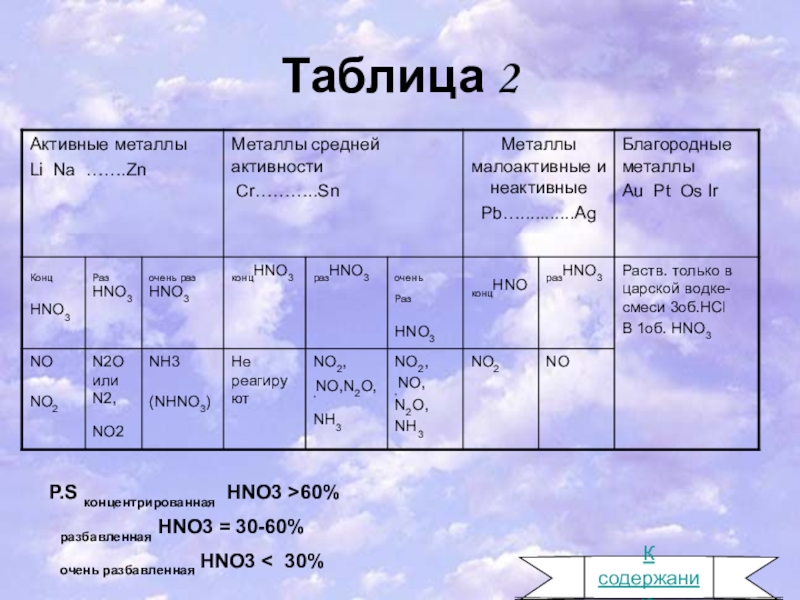
Слайд 9Таблица 2
P.S концентрированная HNO3 >60%
разбавленная HNO3 = 30-60%
очень разбавленная HNO3 < 30%
К содержанию
Слайд 10
Азотная кислота широко используется для производства азотных удобрений, искусственных волокон, органических
красителей, лаков и взрывчатых веществ.
Применение
К содержанию