- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Фосфор
Содержание
- 1. Фосфор
- 2. Фосфор-это…Фо́сфор — химический элемент 15-й группы (по устаревшей классификации — главной подгруппы
- 3. Строение атома фосфора.
- 4. Аллотропные модификации фосфора.Белый фосфор обладает молекулярной кристаллической
- 5. Противоядием при отравлении фосфором служит
- 6. Красный фосфор – порошок со слабо выраженной
- 7. Аллотропные модификации фосфораЧерный фосфорКрасный фосфорБелый фосфор
- 8. Нахождение в природе.Фосфор - составная часть растительных
- 9. Фосфор в продуктах.Молочные продукты(молоко, сыр и др.)Мясо,
- 10. Химические свойства фосфора
- 11. Оксиды фосфора.
- 12. Фосфорная кислота и ее свойства.
- 13. Получение.Официальной датой открытия фосфора считается 1669 год.
- 14. Спасибо за внимание!
Фосфор-это…Фо́сфор — химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) третьего периода периодической системы Д. И. Менделеева; имеет атомный номер 15. Элемент входит в группу пниктогенов. Фосфор — один из распространённых элементов земной коры. Концентрация в морской воде 0,07 мг/л. В свободном состоянии не встречается из-за высокой химической
Слайд 2Фосфор-это…
Фо́сфор — химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) третьего периода периодической
системы Д. И. Менделеева; имеет атомный номер 15. Элемент входит в группу пниктогенов. Фосфор — один из распространённых элементов земной коры. Концентрация в морской воде 0,07 мг/л. В свободном состоянии не встречается из-за высокой химической активности. Фосфор входит в состав важнейших биологических соединений — фосфолипидов. Содержится в животных тканях, входит в состав белков и других важнейших органических соединений, является элементом жизни.
Слайд 4Аллотропные модификации фосфора.
Белый фосфор обладает молекулярной кристаллической решеткой; это вещество желтоватого
цвета с чесночным запахом. В парах имеет состав Р 4.На воздухе воспламеняется при 18ºС. При хранении на свету переходит в красный. В воде нерастворим, зато хорошо растворим в сероуглероде, бензоле и других органических растворителях.
Он весьма ядовит: 0,1 г белого фосфора – смертельная доза для человека.
Он весьма ядовит: 0,1 г белого фосфора – смертельная доза для человека.
Слайд 5 Противоядием при отравлении фосфором служит 2% раствор медного купороса,
который следует давать больному через 5 минут по чайной ложке до появления рвоты.
Горящий фосфор не только причиняет очень сильные ожоги, но и вызывает отравление тканей, прилежащих к месту ожога, вследствие чего заживление идет крайне медленно. При ожогах фосфором противоядием служит мокрая повязка, пропитанная 5% раствором медного купороса. В связи с тем, что белый фосфор легко окисляется и воспламеняется, его хранят под водой.
Горящий фосфор не только причиняет очень сильные ожоги, но и вызывает отравление тканей, прилежащих к месту ожога, вследствие чего заживление идет крайне медленно. При ожогах фосфором противоядием служит мокрая повязка, пропитанная 5% раствором медного купороса. В связи с тем, что белый фосфор легко окисляется и воспламеняется, его хранят под водой.
Слайд 6Красный фосфор – порошок со слабо выраженной кристаллической структурой и поэтому
названный аморфным, темно- красного цвета, имеет атомную решетку, весьма гигроскопичен (легко поглощает воду), но в воде нерастворим; нерастворим он и в сероуглероде. Красный фосфор получается при длительном нагревании белого фосфора без доступа воздуха при 450ºС. В отличие от белого – не ядовит, запаха не имеет, воспламеняется при ºС.
Фиолетовый и черный фосфор также получают из белого при высоких давлении и температуре. Черный фосфор обладает металлическим блеском, проводит электричество и тепло. Следовательно, у фосфора в незначительной степени проявляются металлические свойства
Фиолетовый и черный фосфор также получают из белого при высоких давлении и температуре. Черный фосфор обладает металлическим блеском, проводит электричество и тепло. Следовательно, у фосфора в незначительной степени проявляются металлические свойства
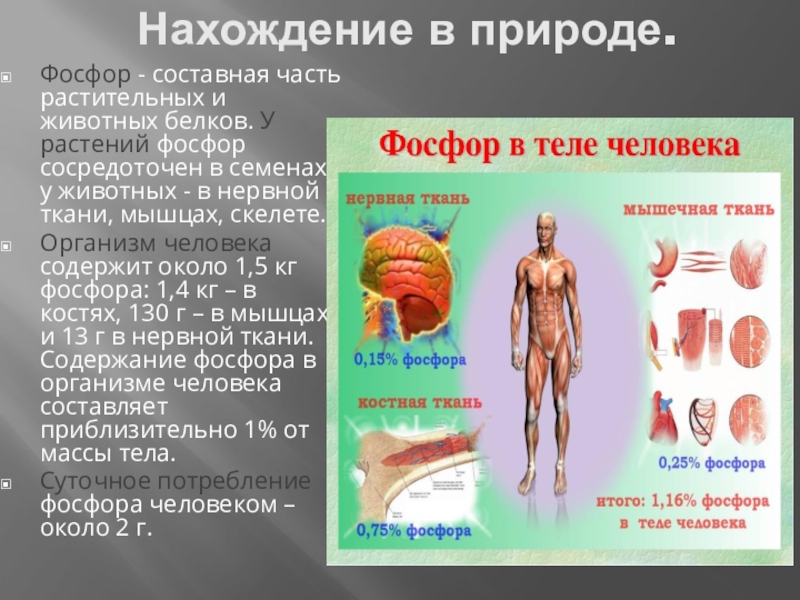
Слайд 8Нахождение в природе.
Фосфор - составная часть растительных и животных белков. У
растений фосфор сосредоточен в семенах, у животных - в нервной ткани, мышцах, скелете.
Организм человека содержит около 1,5 кг фосфора: 1,4 кг – в костях, 130 г – в мышцах и 13 г в нервной ткани. Содержание фосфора в организме человека составляет приблизительно 1% от массы тела.
Суточное потребление фосфора человеком – около 2 г.
Организм человека содержит около 1,5 кг фосфора: 1,4 кг – в костях, 130 г – в мышцах и 13 г в нервной ткани. Содержание фосфора в организме человека составляет приблизительно 1% от массы тела.
Суточное потребление фосфора человеком – около 2 г.
Слайд 9Фосфор в продуктах.
Молочные продукты(молоко, сыр и др.)
Мясо, птица, яйцо, субпродукты(говяжья печень)
Рыба,
икра осетровых
Хлеб, овсяная и гречневая крупы
Орехи грецкие, семечки
Овощи, зелень(тыква, петрушка, капуста, шпинат, чеснок, морковь)
Хлеб, овсяная и гречневая крупы
Орехи грецкие, семечки
Овощи, зелень(тыква, петрушка, капуста, шпинат, чеснок, морковь)
Слайд 13Получение.
Официальной датой открытия фосфора считается 1669 год. Именно тогда гамбургский алхимик
Хеннинг Бранд в поисках основы философского камня обрабатывал разные вещества, и особенно мочу, экскременты и кости. Он собрал около тонны мочи из казарм и выпаривал ее до образования сиропообразной жидкости. Затем вновь дистиллировал эту жидкость и получил красное «уринное масло». После перегонки вышел твердый остаток, а уж после его прокаливания — белый дым, оседавший на стенках сосуда и ярко светившийся в темноте.