- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии: Строение атома
Содержание
- 1. Презентация по химии: Строение атома
- 2. Эволюция представлений о строении атомаЗа 25 веков,
- 3. Современные представления о строении атома
- 4. Химический элемент - это вид
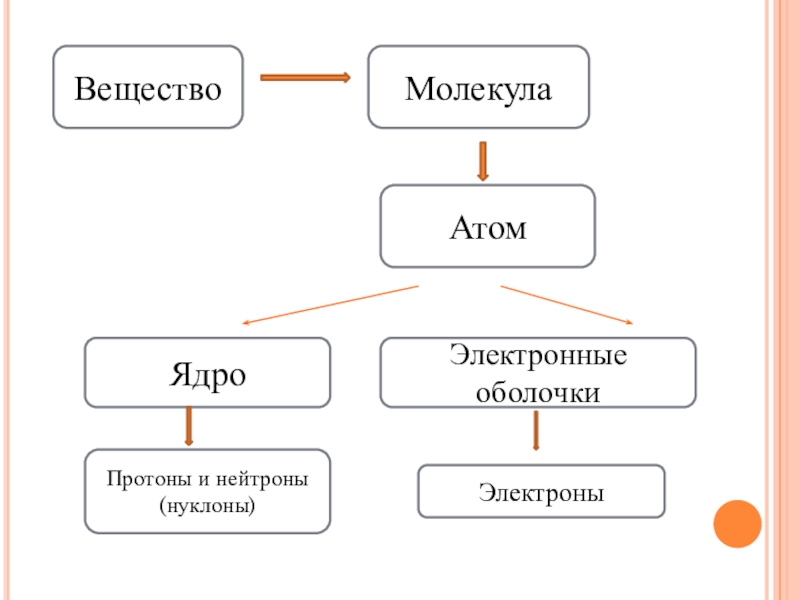
- 5. ВеществоМолекулаАтомЯдроЭлектронные оболочкиПротоны и нейтроны (нуклоны)Электроны
- 6. Слайд 6
- 7. Слайд 7
- 8. Параметры для характеристики атомовМассовое число А – сумма чисел
- 9. Слайд 9
- 10. Строение электронных оболочек атомовЭлектронная оболочка атома – это
- 11. Слайд 11
- 12. Порядок заполнения уровней и подуровней электронамиI.Электронные формулы
- 13. II. Порядок заполнения электронами атомных орбиталей определяется:1.Принципом наименьшей энергииШкала энергий:1s
- 14. III. Семейства химических элементов.Элементы, в атомах которых
- 15. Слайд 15
- 16. Слайд 16
- 17. Слайд 17
Эволюция представлений о строении атомаЗа 25 веков, со времен философов Древней Греции и до конца XIX в., В науке господствовало мнение о том, что атом — наименьшая неделимая частица вещества, которая остается неизменной при любых процессов
Слайд 2Эволюция представлений о строении атома
За 25 веков, со времен философов Древней
Греции и до конца XIX в., В науке господствовало мнение о том, что атом — наименьшая неделимая частица вещества, которая остается неизменной при любых процессов или явлений.
Однако в конце XIX в. в физике был сделан ряд открытий, которые показали сложное строение атома.
На основании новых открытий начала развиваться теория строения атома (модель строения атома Э. Резерфорда, 1911 г.; модель Н. Бора, 1913 г.).
Однако в конце XIX в. в физике был сделан ряд открытий, которые показали сложное строение атома.
На основании новых открытий начала развиваться теория строения атома (модель строения атома Э. Резерфорда, 1911 г.; модель Н. Бора, 1913 г.).
Слайд 3Современные представления о строении атома
Современная теория строения атома
возникла как результат переосмысления и дополнения теории Бора. Существенным нововведением стало понятие об электронном облаке. Электронным облом (орбиталью) называется пространство вокруг ядра, в котором находятся электроны. Современная квантовая теория строения атома учитывает волновые свойства электрона и других элементарных частиц — протонов, нейтронов и т.д..
Основные положения современной теории строения атома:
1. Электронам свойственна двойственная (корпускулярно — волновая) природа. Как частица электрон имеет определенную массу и заряд, а как волна — способность к дифракции (огибание препятствия).
2. Для электрона невозможно одновременно и точно измерить координату и энергию. В каждый момент времени можно определить только одно из этих свойств.
3. Электрон в атоме не вращается вокруг ядра по определенной траектории, а может двигаться в любой части околоядерного пространства. Однако вероятность нахождения его в разных частях пространства неодинакова.
4. Ядра атомов состоят из протонов и нейтронов. Число протонов равно атомному номеру элемента (протонное число), а сумма чисел протонов и нейтронов (нуклонов) соответствует его массовому числу.
Основные положения современной теории строения атома:
1. Электронам свойственна двойственная (корпускулярно — волновая) природа. Как частица электрон имеет определенную массу и заряд, а как волна — способность к дифракции (огибание препятствия).
2. Для электрона невозможно одновременно и точно измерить координату и энергию. В каждый момент времени можно определить только одно из этих свойств.
3. Электрон в атоме не вращается вокруг ядра по определенной траектории, а может двигаться в любой части околоядерного пространства. Однако вероятность нахождения его в разных частях пространства неодинакова.
4. Ядра атомов состоят из протонов и нейтронов. Число протонов равно атомному номеру элемента (протонное число), а сумма чисел протонов и нейтронов (нуклонов) соответствует его массовому числу.
Слайд 4 Химический элемент - это вид атомов с определённым положительным
зарядом ядра.
Атомы химических элементов в природе могут находиться в свободном состоянии (отдельные атомы), образовывать простые вещества и входить в состав соединений (сложных веществ).
Отдельные атомы характеризуют их строением.
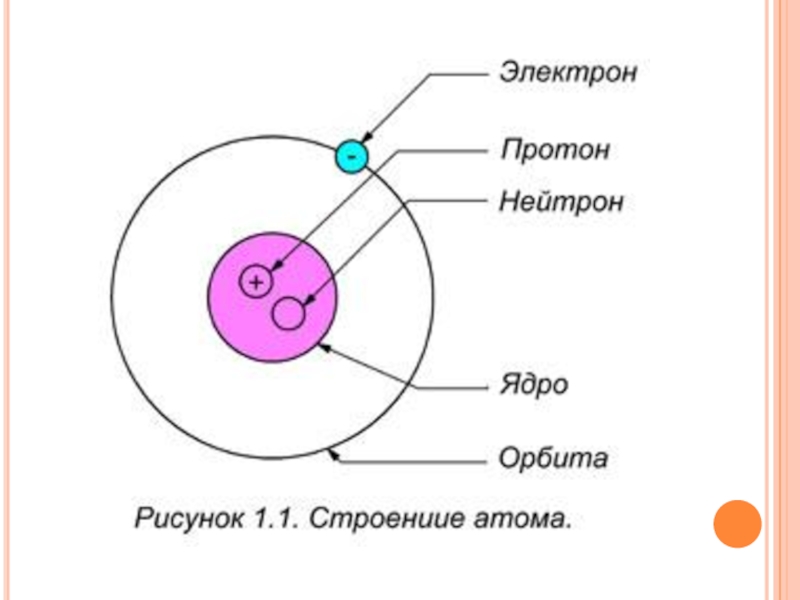
Атом состоит из ядра и окружающей ядро электронной оболочки.
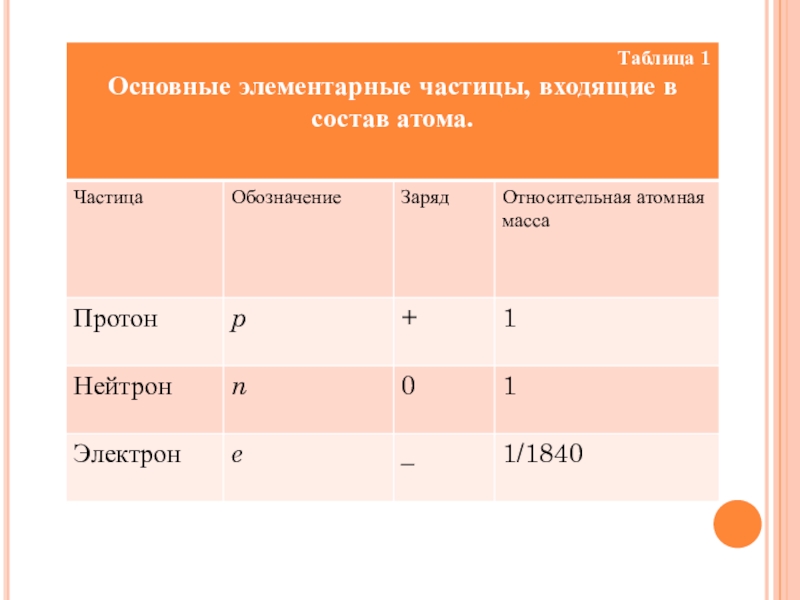
Основные элементарные частицы в составе атома представлены в таблице 1.
Атомы химических элементов в природе могут находиться в свободном состоянии (отдельные атомы), образовывать простые вещества и входить в состав соединений (сложных веществ).
Отдельные атомы характеризуют их строением.
Атом состоит из ядра и окружающей ядро электронной оболочки.
Основные элементарные частицы в составе атома представлены в таблице 1.
Слайд 8Параметры для характеристики атомов
Массовое число А – сумма чисел протонов и нейтронов атома.
Заряд
ядра Z – число протонов, определяется по порядковому номеру элемента в таблице Д.И.Менделеева. В 1913 г. английским физиком Г.Мозли было установлено, что положительный заряд ядра атома (в условных единицах) равен порядковому номеру элемента в периодической системе Д.И.Менделеева.
Число нейтронов N определяется как разность между массовым числом и зарядом ядра (учитывая, что массой электрона можно пренебречь).
Изотопы – атомы одного элемента, имеющие одинаковый заряд ядра (следовательно, и количество электронов), но различное число нейтронов (следовательно, различные массовые числа). Например, элемент водород имеет три изотопа: протий, дейтерий и тритий. Первые два существуют в природе, тритий получен искусственным путем. Относительная атомная масса элемента, которая приводится в периодической системе, – это средняя величина массовых чисел природных изотопов данного элемента с учетом процентного содержания каждого из этих изотопов. Химические свойства всех изотопов одного химического элемента одинаковы. Следовательно, химические свойства элемента зависят не от атомной массы, а от заряда ядра.
Число нейтронов N определяется как разность между массовым числом и зарядом ядра (учитывая, что массой электрона можно пренебречь).
Изотопы – атомы одного элемента, имеющие одинаковый заряд ядра (следовательно, и количество электронов), но различное число нейтронов (следовательно, различные массовые числа). Например, элемент водород имеет три изотопа: протий, дейтерий и тритий. Первые два существуют в природе, тритий получен искусственным путем. Относительная атомная масса элемента, которая приводится в периодической системе, – это средняя величина массовых чисел природных изотопов данного элемента с учетом процентного содержания каждого из этих изотопов. Химические свойства всех изотопов одного химического элемента одинаковы. Следовательно, химические свойства элемента зависят не от атомной массы, а от заряда ядра.
Слайд 10Строение электронных оболочек атомов
Электронная оболочка атома – это совокупность всех электронов в
данном атоме. От строения электронной оболочки атома напрямую зависят химические свойства данного химического элемента. Согласно квантовой теории каждый электрон в атоме занимает определенную орбиталь и образует электронное облако, которое является совокупностью различных положений быстро движущегося электрона.
Для характеристики орбиталей и электронов используют квантовые числа.
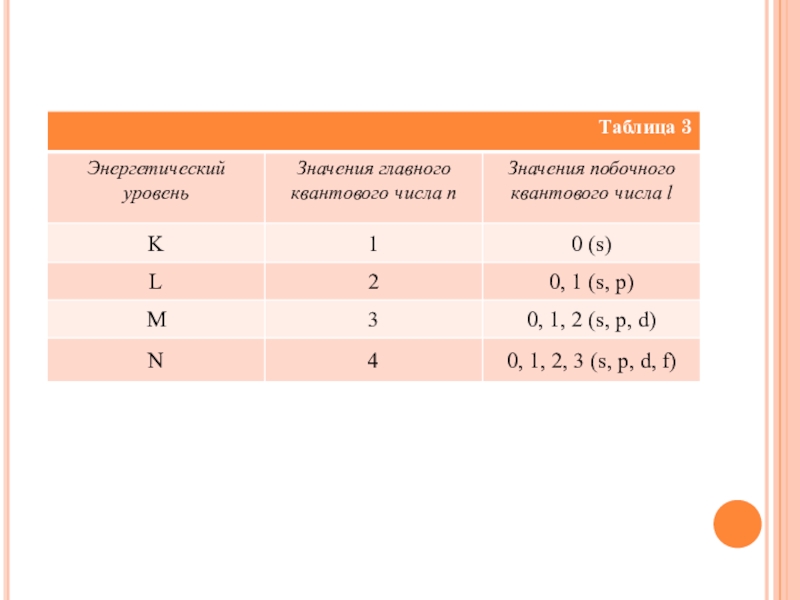
Главное квантовое число n характеризует энергию и размеры орбитали и электронного облака, принимает значения целых чисел – от 1 до бесконечности (n = 1, 2, 3, 4, 5, 6…). Орбитали, имеющие одинаковые значения n, близки между собой по энергии и по размерам, они образуют один энергетический уровень.
Энергетический уровень – это совокупность орбиталей, имеющих одинаковое значение главного квантового числа. Энергетические уровни обозначают либо цифрами, либо большими буквами латинского алфавита (1 – K, 2 – L, 3 – M, 4 – N, 5 – O, 6 – P, 7 – Q). С увеличением порядкового номера энергия орбиталей увеличивается.
Электронный слой – это совокупность электронов, находящихся на одном энергетическом уровне.
На одном энергетическом уровне могут находиться электронные облака, имеющие различные геометрические формы.
Побочное (орбитальное) квантовое число l характеризует формы орбиталей и облаков, принимает значения целых чисел от 0 до n – 1.
Для характеристики орбиталей и электронов используют квантовые числа.
Главное квантовое число n характеризует энергию и размеры орбитали и электронного облака, принимает значения целых чисел – от 1 до бесконечности (n = 1, 2, 3, 4, 5, 6…). Орбитали, имеющие одинаковые значения n, близки между собой по энергии и по размерам, они образуют один энергетический уровень.
Энергетический уровень – это совокупность орбиталей, имеющих одинаковое значение главного квантового числа. Энергетические уровни обозначают либо цифрами, либо большими буквами латинского алфавита (1 – K, 2 – L, 3 – M, 4 – N, 5 – O, 6 – P, 7 – Q). С увеличением порядкового номера энергия орбиталей увеличивается.
Электронный слой – это совокупность электронов, находящихся на одном энергетическом уровне.
На одном энергетическом уровне могут находиться электронные облака, имеющие различные геометрические формы.
Побочное (орбитальное) квантовое число l характеризует формы орбиталей и облаков, принимает значения целых чисел от 0 до n – 1.
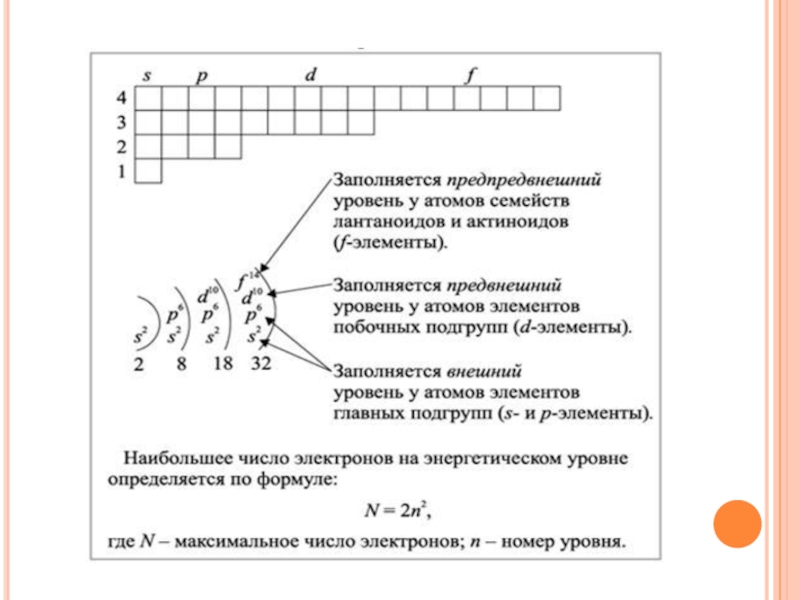
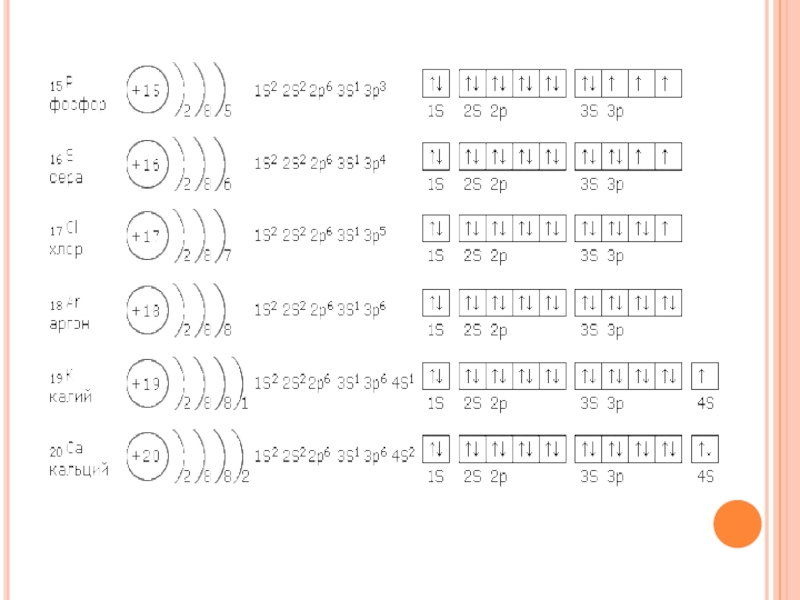
Слайд 12Порядок заполнения уровней и подуровней электронами
I.Электронные формулы атомов химических элементов составляют
в следующем порядке:
Сначала по номеру элемента в таблице Д. И. Менделеева определяют общее число электронов в атоме;
Затем по номеру периода, в котором расположен элемент, определяют число энергетических уровней;
Уровни разбивают на подуровни и орбитали, и заполняют их электронами в соответствии Принципом наименьшей энергии
Для удобства электроны можно распределить по энергетическим уровням, воспользовавшись формулой N=2n2 и с учётом того, что:
У элементов главных подгрупп (s-;p-элементы) число электронов на внешнем уровне равно номеру группы.
У элементов побочных подгрупп на внешнем уровне обычно два электрона (исключение составляют атомы Cu, Ag, Au, Cr, Nb, Mo, Ru, Rh, у которых на внешнем уровне один электрон, у Pd на внешнем уровне ноль электронов);
Число электронов на предпоследнем уровне равно общему числу электронов в атоме минус число электронов на всех остальных уровнях.
Сначала по номеру элемента в таблице Д. И. Менделеева определяют общее число электронов в атоме;
Затем по номеру периода, в котором расположен элемент, определяют число энергетических уровней;
Уровни разбивают на подуровни и орбитали, и заполняют их электронами в соответствии Принципом наименьшей энергии
Для удобства электроны можно распределить по энергетическим уровням, воспользовавшись формулой N=2n2 и с учётом того, что:
У элементов главных подгрупп (s-;p-элементы) число электронов на внешнем уровне равно номеру группы.
У элементов побочных подгрупп на внешнем уровне обычно два электрона (исключение составляют атомы Cu, Ag, Au, Cr, Nb, Mo, Ru, Rh, у которых на внешнем уровне один электрон, у Pd на внешнем уровне ноль электронов);
Число электронов на предпоследнем уровне равно общему числу электронов в атоме минус число электронов на всех остальных уровнях.
Слайд 13II. Порядок заполнения электронами атомных орбиталей определяется:
1.Принципом наименьшей энергии
Шкала энергий:
1s
атома с полностью или наполовину заполненным подуровнем (т. е. когда на каждой орбитали имеется по одному неспаренному электрону) является более устойчивым.
Этим объясняется «провал» электрона. Так, устойчивому состоянию атома хрома соответствует следующее распределение электронов:
Cr: 1s22s22p63s23p64s13d5, а не 1s22s22p63s23p64s23d4,
т. е. происходит «провал» электрона с 4s-подуровня на 3d-подуровень.
Этим объясняется «провал» электрона. Так, устойчивому состоянию атома хрома соответствует следующее распределение электронов:
Cr: 1s22s22p63s23p64s13d5, а не 1s22s22p63s23p64s23d4,
т. е. происходит «провал» электрона с 4s-подуровня на 3d-подуровень.
Слайд 14III. Семейства химических элементов.
Элементы, в атомах которых происходит заполнение электронами s-подуровня
внешнего энергетического уровня, называются s-элементами. Это первые 2 элемента каждого периода, составляющие главные подгруппы I и II групп.
Элементы, в атомах которых электронами заполняется p-подуровень внешнего энергетического уровня, называются p-элементами. Это последние 6 элементов каждого периода (за исключением I и VII), составляющие главные подгруппы III-VIII групп.
Элементы, в которых заполняется d-подуровень второго снаружи уровня, называются d-элементами. Это элементы вставных декад IV, V, VI периодов.
Элементы, в которых заполняется f-подуровень третьего снаружи уровня, называются f-элементами. К f-элементам относятся лантаноиды и актиноиды.
Элементы, в атомах которых электронами заполняется p-подуровень внешнего энергетического уровня, называются p-элементами. Это последние 6 элементов каждого периода (за исключением I и VII), составляющие главные подгруппы III-VIII групп.
Элементы, в которых заполняется d-подуровень второго снаружи уровня, называются d-элементами. Это элементы вставных декад IV, V, VI периодов.
Элементы, в которых заполняется f-подуровень третьего снаружи уровня, называются f-элементами. К f-элементам относятся лантаноиды и актиноиды.