- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Скорость химических реакций
Содержание
- 1. Презентация по химии Скорость химических реакций
- 2. Химическая кинетика – это раздел химии, изучающий скорости и механизмы химических реакций
- 3. Химические реакции протекают с различными
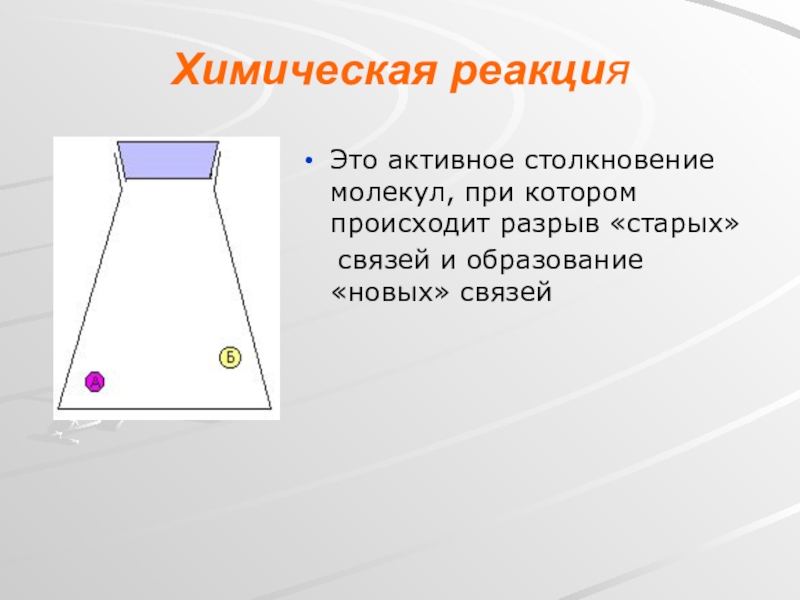
- 4. Химическая реакцияЭто активное столкновение молекул, при котором происходит разрыв «старых» связей и образование «новых» связей
- 5. Энергия, которую надо сообщить молекулам, чтобы превратить
- 6. Формулы для расчета скорости реакции
- 7. Химическая реакция протекает в растворе, согласно уравнению:
- 8. Решение:Дано: С(А) = 0,80 моль/л; С(А1) =
- 9. Факторы, влияющие на скорость реакцииПрирода реагирующих веществПлощадь поверхности твердого веществаКонцентрация реагирующих веществТемператураКатализатор
- 10. 1. Природа реагирующих веществ Под природой реагирующих
- 11. 2. Площадь поверхности твердого веществаЕсли в реакции
- 12. 3. Концентрация реагирующих веществЧем больше концентрация реагирующих
- 13. Проведи экспериментВ 1 пробирку налей раствор НСl.Во
- 14. 4. Влияние температуры
- 15. Применение правила Вант-Гоффа
- 16. Проведи экспериментВ 2 пробирки налейте уксусной кислоты
- 17. 5. КатализаторКатализаторами называются вещества, которые ускоряют реакцию,
- 18. Проведи экспериментВ 2 пробирки налить по 2
Слайд 3 Химические реакции протекают с различными скоростями. Одни идут медленно,
Другие заканчиваются очень быстро, например осаждение нерастворимых солей, а некоторые протекают мгновенно, например взрывы.
Очень быстро идут многие реакции в водных растворах
Слайд 4Химическая реакция
Это активное столкновение молекул, при котором происходит разрыв «старых»
Слайд 5Энергия, которую надо сообщить молекулам, чтобы превратить их в активные, называется
Для того, чтобы молекулы А и Б прореагировали между собой, они должны сначала столкнуться. Причем столкновение должно быть достаточно энергичным. Энергия, запасенная в молекулах А и Б, должна быть больше какой-то определенной величины - иначе они просто отталкиваются друг от друга, не вступая в реакцию
Если же энергия столкновения достаточна, образуется продукт В
Слайд 7Химическая реакция протекает в растворе, согласно уравнению:
А+В=С
Исходная концентрация: вещества
Определите среднюю скорость реакции за этот промежуток времени?
Задача:
Слайд 8Решение:
Дано: С(А) = 0,80 моль/л; С(А1) = 0,74 моль/л; Δt =
Найти: Vгомог.=?
Решение:
1. Определение средней скорости реакции в растворе производится по формуле: V= ΔC/Δt
Подставим значения в формулу:
V= 0,8 – 0,74 / 20 = 0,003 моль / л∙мин.
Ответ: 0,003 моль / л∙мин.
Слайд 9Факторы, влияющие на скорость реакции
Природа реагирующих веществ
Площадь поверхности твердого вещества
Концентрация реагирующих
Температура
Катализатор
Слайд 101. Природа реагирующих веществ
Под природой реагирующих веществ понимают их состав,
Проведи эксперимент
Налейте в две пробирки соляную и уксусную кислоты.
В каждую пробирку добавьте кусочек цинка.
В какой пробирке реакция протекает быстрее? Почему?
Слайд 112. Площадь поверхности твердого вещества
Если в реакции кроме жидкости (или газа)
Проведи эксперимент
Налейте в 2 пробирки уксусной кислоты.
Добавьте в 1 пробирку кусочек мела.
Во 2 пробирку порошок мела.
Как зависит скорость реакции от площади соприкосновения веществ?
Слайд 123. Концентрация реагирующих веществ
Чем больше концентрация реагирующих веществ, тем больше скорость
Математически зависимость скорости от концентрации для реакции: 2А+В=АВ выражается следующим образом:
Слайд 13Проведи эксперимент
В 1 пробирку налей раствор НСl.
Во 2 пробирку концентрированную НСl.
В
В какой пробирке реакция идет быстрее?
Как влияет концентрация реагирующих веществ на скорость реакции? Почему?
Слайд 144. Влияние температуры
Правило Вант-Гоффа:
При повышении температуры на каждые 10 градусов скорость реакций увеличивается в 2-4 раза
Число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры на 10° С, называют температурным коэффициентом.
Слайд 16Проведи эксперимент
В 2 пробирки налейте уксусной кислоты и добавьте несколько гранул
Одну пробирку нагрейте.
В какой из пробирок реакция идет быстрее?
Как влияет температура на скорость реакции?
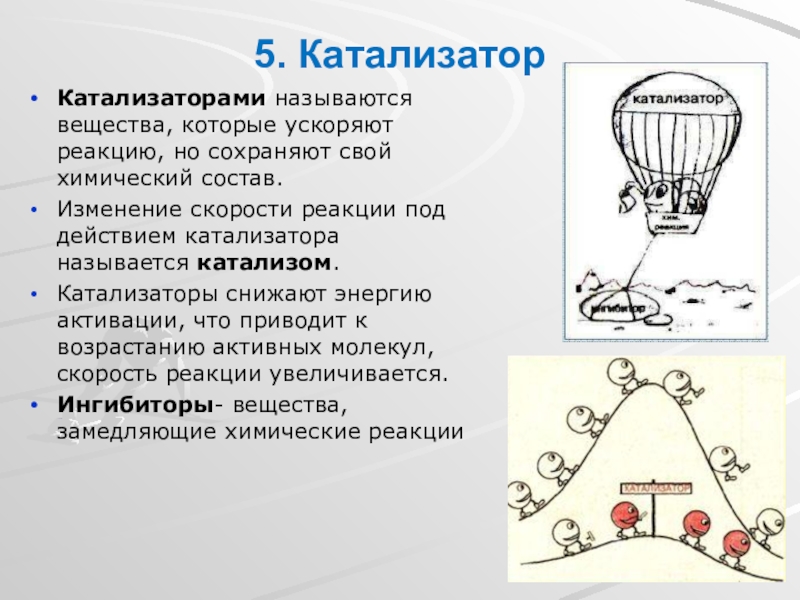
Слайд 175. Катализатор
Катализаторами называются вещества, которые ускоряют реакцию, но сохраняют свой химический
Изменение скорости реакции под действием катализатора называется катализом.
Катализаторы снижают энергию активации, что приводит к возрастанию активных молекул, скорость реакции увеличивается.
Ингибиторы- вещества, замедляющие химические реакции
Слайд 18Проведи эксперимент
В 2 пробирки налить по 2 мл раствора медного купороса
В одну из пробирок добавить несколько кристаллов хлорида натрия.
Что наблюдаете?
Запишите уравнение реакции.