- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Скорость химичеких реакций
Содержание
- 1. Презентация по химии Скорость химичеких реакций
- 2. ОпределениеСкорость химической реакции - это изменение молярной концентрации
- 3. ПримерПопробуем определить скорость этой реакции по расходованию
- 4. ПримерРеакция идет в мольном соотношении 1:1, а
- 5. Влияние концентраций веществ на скорость химической реакции
- 6. Влияние концентраций веществ на скорость химической реакции
- 7. Влияние давления на скорость химической реакции Давление
- 8. Катализ и ингибирование Есть вещества, которые влияют
- 9. Катализ и ингибирование Все биохимические реакции, протекающие
- 10. Катализ и ингибирование Действие катализаторов основано на
- 11. Влияние скорости реакции от температуры Зависимость скорости
- 12. Источникиhttp://zadachi-po-khimii.ru/wp-content/uploads/2014/09/c378bdeaf96d9602209339c4963a1189.jpghttps://ru.wikipedia.org/wiki/%D0%A1%D0%BA%D0%BE%D1%80%D0%BE%D1%81%D1%82%D1%8C_%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B9_%D1%80%D0%B5%D0%B0%D0%BA%D1%86%D0%B8%D0%B8http://www.chem.msu.su/rus/teaching/Kinetics-online/welcome.htmlhttp://zadachi-po-khimii.ru/obshaya-himiya/skorost-ximicheskoj-reakcii.html
- 13. Спасибо за внимание!
Слайд 1Скорость химической реакции
Презентацию подготовил ученик 11 класса Иванов Роман
Руководитель учитель химии
Слайд 2Определение
Скорость химической реакции - это изменение молярной концентрации одного из участвующих в
v = Dc/Dt [моль/литр*сек]
В качестве примера рассмотрим следующую реакцию:
H2 + I2 = 2HI
Слайд 3Пример
Попробуем определить скорость этой реакции по расходованию реагентов в единицу времени.
v(H2) = m(H2)/Dt, v(I2) = m(I2)/Dt
v - скорость реакции
m - убыль массы соответствующего реагента
Dt - отрезок времени.
v(H2) не равно v(I2), т.к. массы водорода и иода, прореагировавших в единицу времени, не равны.
Слайд 4Пример
Реакция идет в мольном соотношении 1:1, а не в массовом!
Попробуем
v(H2) = n(H2)/Dt, v(I2) = n(I2)/Dt
взяв вместо масс количества веществ.
v(H2) = v(I2)
Приведем эти выражения к единице объема
v(H2) = n(H2)/VDt = Dc(H2)/Dt
v(I2) = n(I2)/VDt=Dc(I2)/D t
Dc - изменения молярных концентраций соответствующих веществ.
Тогда vH2 = vI2 = v данной реакции!
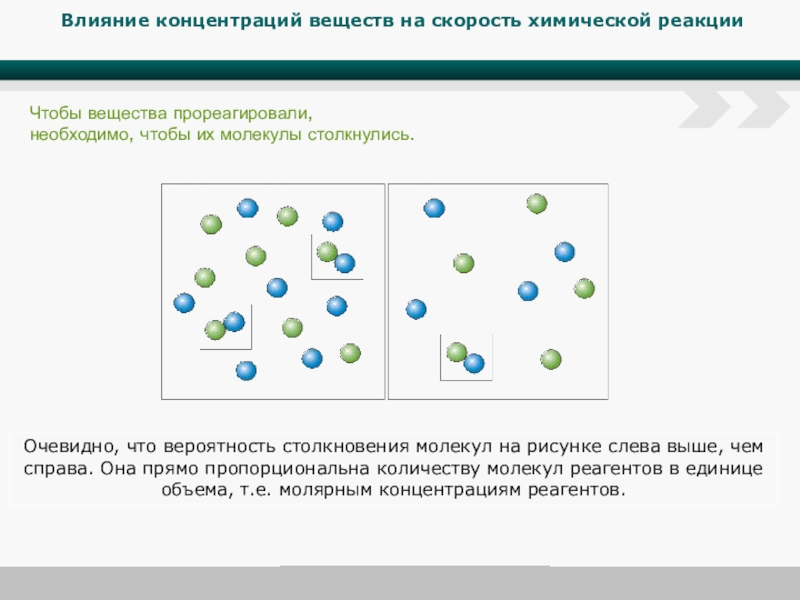
Слайд 5Влияние концентраций веществ на скорость химической реакции
Чтобы вещества прореагировали, необходимо, чтобы
Очевидно, что вероятность столкновения молекул на рисунке слева выше, чем справа. Она прямо пропорциональна количеству молекул реагентов в единице объема, т.е. молярным концентрациям реагентов.
Слайд 6Влияние концентраций веществ на скорость химической реакции
В середине XIX в. (1865
Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в некоторые степени:
v = k[A]n[B]m, для реакции aA + bB = ...
Числа n, m в выражении закона действующих масс называются порядками реакции по соответствующим веществам. Это экспериментально определяемые величины. Сумма показателей степеней n, m называется общим порядком реакции.
Коэффициент пропорциональности k называется константой скорости реакции.
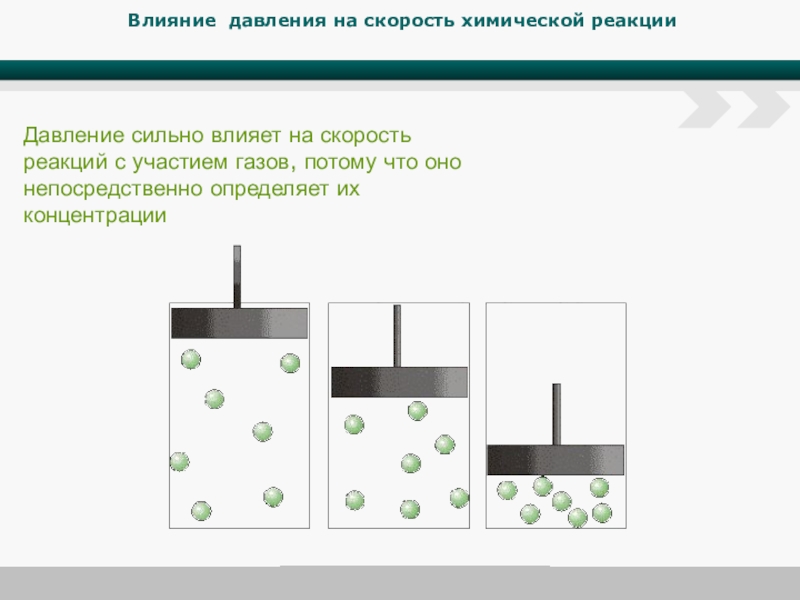
Слайд 7Влияние давления на скорость химической реакции
Давление сильно влияет на скорость реакций
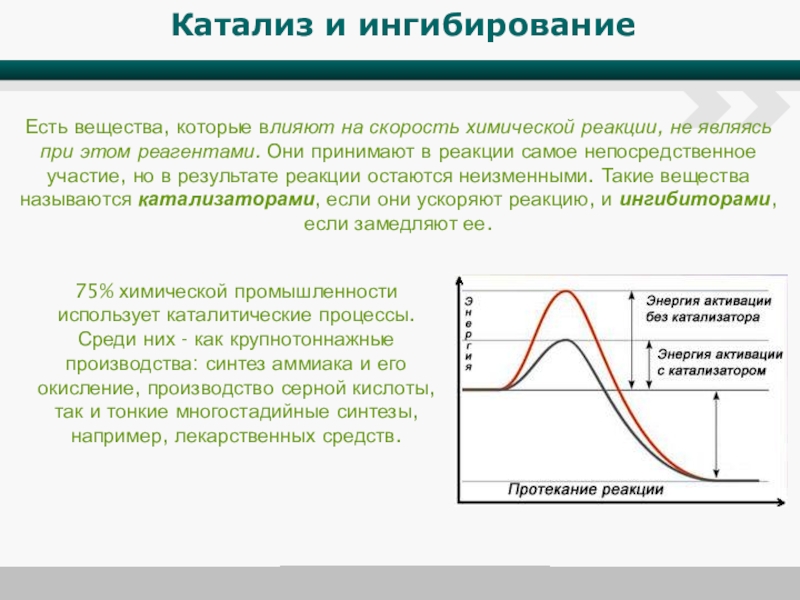
Слайд 8Катализ и ингибирование
Есть вещества, которые влияют на скорость химической реакции, не
75% химической промышленности использует каталитические процессы. Среди них - как крупнотоннажные производства: синтез аммиака и его окисление, производство серной кислоты, так и тонкие многостадийные синтезы, например, лекарственных средств.
Слайд 9Катализ и ингибирование
Все биохимические реакции, протекающие в живых организмах, требуют участия
Слайд 10Катализ и ингибирование
Действие катализаторов основано на том, что они уменьшают энергию активации
Многие катализаторы не просто ускоряют реакции, а ведут их по другому пути. Так, реакция окисления аммиака без катализатора:
4NH3 + 3O2 = 2N2 + 6H2O
не представляет никакого интереса для промышленности, а в результате каталитического окисления на платине:
4NH3 + 5O2 = 4NO + 6H2O
получается ценный продукт - оксид азота(II).
Слайд 11Влияние скорости реакции от температуры
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа
где k — константа скорости реакции
Еа -энергия активации – минимальная (критическая) энергия, необходимая для осуществления реакции, единица измерения Дж/моль
Т — абсолютная температура
R – газовая постоянная, R = 8,314 Дж/моль·град
A — предэкспоненциальный множитель (частотный фактор), единица измерения совпадает с k. Эта константа выражает вероятность того, что при столкновении молекулы будут ориентированы так, чтобы взаимодействие было возможно.