подготовила учитель химии Мещерякова Т.А.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Простые и сложные вещества
Содержание
- 1. Презентация по химии Простые и сложные вещества
- 2. Химические элементы существуют в виде химических соединений.химические
- 3. Простые вещества состоят из атомов одного вида
- 4. Запись качественного и количественного состава вещества с помощью знаков хим. элементов называется ХИМИЧЕСКАЯ ФОРМУЛА 4
- 5. Молекулы простых веществ, которые состоят из
- 6. Простые вещества(по свойствам)металлы неметаллыжелезо,
- 7. Русские названия простых веществ обычно совпадают с
- 8. Свойства простых веществ - металловТвердые (исключение –
- 9. Плохо проводят теплотуНе проводят эл. токОбладают хрупкостьюОкрашены
- 10. В начале XX века в Петербурге на
- 11. «Оловянная чума»
- 12. Аллотропия – способность атомов одного химического элемента
- 13. Аллотропные модификации кислородаО2- кислородбесцветный газ;не имеет запаха;плохо
- 14. Аллотропные модификации углеродаГрафитАлмазМягкийИмеет серый цветСлабый металлический блеск Электропроводен Оставляет след на бумаге.ТвёрдыйБесцветныйРежет стеклоПреломляет светДиэлектрик
- 15. Аллотропные модификации фосфораР(красный фосфор)
- 16. Правила составления формулы веществУказать знаки элементовУказать с
- 17. два Бинарное соединение состоит из двух
- 18. Закон постоянства состава веществ Жозеф Луи Пруст
- 19. N2O, Р, NH3,О2, Mg3N2, N2O5, Na3NH2O, CH4,
- 20. ОТВЕТЫ
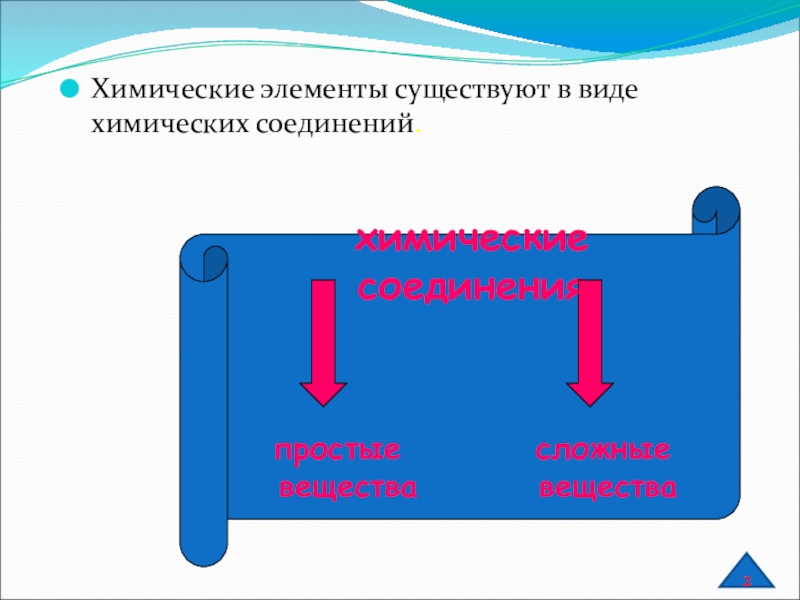
Слайд 2Химические элементы существуют в виде химических соединений.
химические соединения
простые сложные
вещества вещества
2
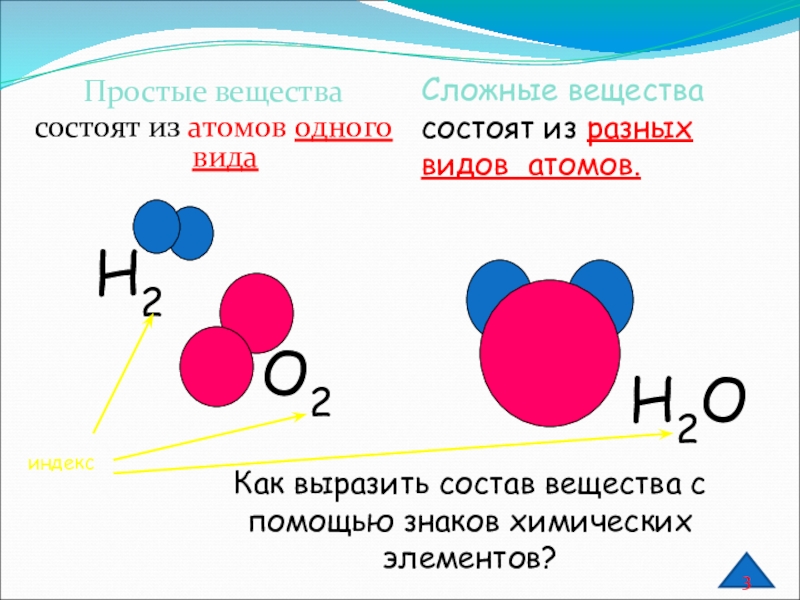
Слайд 3Простые вещества
состоят из атомов одного вида
Сложные вещества состоят из разных
видов атомов.
Как выразить состав вещества с помощью знаков химических элементов?
О2
Н2
Н2О
индекс
3
Слайд 4Запись качественного и количественного состава вещества с помощью знаков хим. элементов
4
Слайд 5Молекулы простых веществ,
которые состоят из 2 атомов:
Азот
Кислород О2
Фтор F 2
Хлор Cl 2
Бром Br 2
Иод I 2
Формулы немолекулярных простых веществ –знаки соответствующих элементов: Fe, Al, Cu,
5
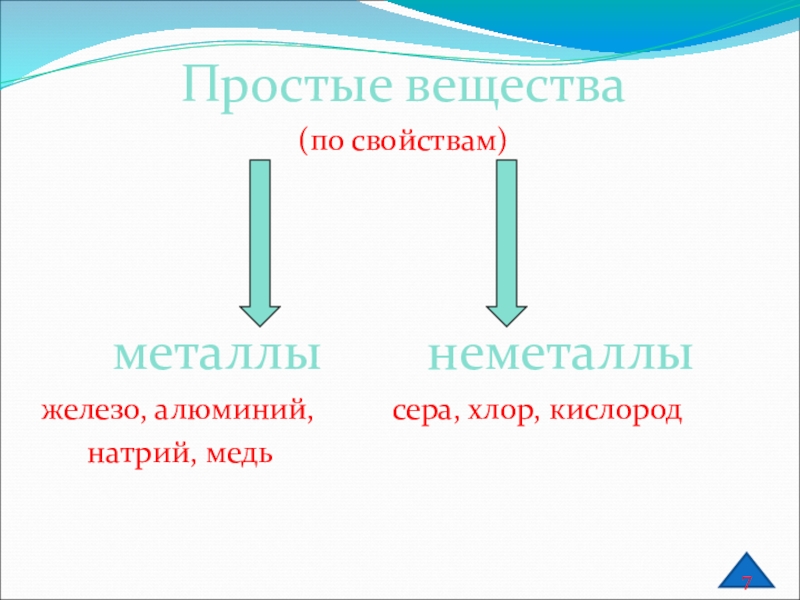
Слайд 6Простые вещества
(по свойствам)
металлы неметаллы
железо, алюминий,
натрий, медь
7
Слайд 7Русские названия простых веществ обычно совпадают с русскими названиями соответствующих химических
(водород – водород, медь – медь)
Есть исключения: химический элемент углерод образует несколько простых веществ(сажа, алмаз, графит)
8
Слайд 8Свойства простых веществ - металлов
Твердые (исключение – ртуть)
Хорошо проводят эл. ток,
Обладают пластичностью
Серый, серебристый цвет, блеск
(исключение: золото, медь)
10
Слайд 9Плохо проводят теплоту
Не проводят эл. ток
Обладают хрупкостью
Окрашены в разнообразные цвета
Бывают при
Свойства простых неметаллов
9
Слайд 10В начале XX века в Петербурге на складе военного оборудования произошла
Слайд 11«Оловянная чума»
Белое олово
устойчиво при t0 >130С
Серое олово
устойчиво при t0 <130С
При t0 = -330С
скорость максимальна
Слайд 12Аллотропия – способность атомов одного химического элемента образовывать несколько простых веществ.
Аллотропные
Слайд 13Аллотропные модификации кислорода
О2- кислород
бесцветный газ;
не имеет запаха;
плохо растворим в воде;
температура кипения
О3 – озон
(«пахнущий»)
газ бледно-фиолетового цвета;
имеет резкий запах;
растворяется в 10 раз лучше, чем кислород;
температура кипения
-111,9 С;
наиболее бактерициден.
Слайд 14Аллотропные модификации углерода
Графит
Алмаз
Мягкий
Имеет серый цвет
Слабый
металлический блеск
Электропроводен
Оставляет след
Твёрдый
Бесцветный
Режет стекло
Преломляет свет
Диэлектрик
Слайд 15Аллотропные модификации фосфора
Р(красный фосфор)
Р4
Без запаха,
не светится в темноте,
не ядовит !
Имеет чесночный запах,
светится в темноте,
ядовит!
Слайд 16Правила составления формулы веществ
Указать знаки элементов
Указать с помощью индексов число атомов
Атом кислорода
Атом водорода
14
Молекула перекиси водорода
Слайд 17 два
Бинарное соединение состоит из двух элементов:
Металл + неметалл
Неметалл + неметалл
Читают формулу справа налево
Второй элемент называют латинским названием с добавлением суффикса – ИД
Первый элемент произносят в родительном падеже
Al Cl3 хлорид алюминия (chlorum)
Ca3 N2 нитрид кальция (nitrogenium)
SO2 оксид серы (oxygenium)
15
Слайд 18Закон постоянства состава веществ
Жозеф Луи Пруст (1754 – 1826) –
Исследование состава различных веществ, выполненное им в 1799-1803 годах, послужило основой открытия закона постоянства состава для веществ молекулярного строения.
Каждое химически чистое вещество независимо от местонахождения и способа получения имеет постоянный состав и свойства.
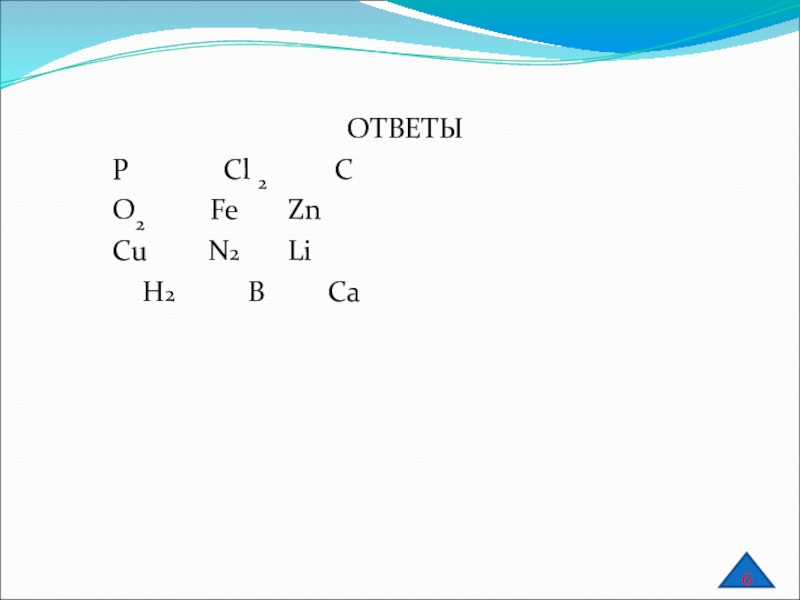
Слайд 19N2O, Р, NH3,О2, Mg3N2, N2O5, Na3N
H2O, CH4, PH3, SiH4, H2S, HCl
Li,
H2SiO3, Zn
CO2, CaC, CO, C2H2, HCOH, CH3COOH
H3PO4, LiCl, NaCl, MgCl2, AlCl3, KCl, CaCl2,
H2 , B, P2O5 , Ca
Напишите формулы простых веществ