- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии: Предельные одноатомные спирты.
Содержание
- 1. Презентация по химии: Предельные одноатомные спирты.
- 2. Оглавление1.Определение.2.Разновидность спиртов.3.Физические свойства.4.Химические свойства.5.Получение.6.Применение.
- 3. 1.ОпределениеСпирты́— органические соединения, содержащие одну или несколько
- 4. 2.Разновидность спиртов.Атомность спирта определяется числом гидроксильных групп
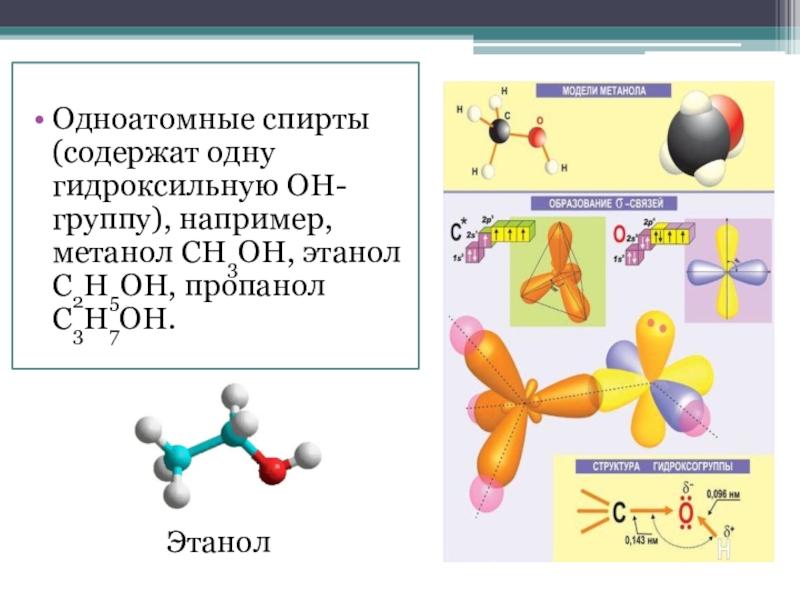
- 5. Одноатомные спирты (содержат одну гидроксильную ОН-группу), например, метанол СН3ОН, этанол С2Н5ОН, пропанол С3Н7ОН.Этанол
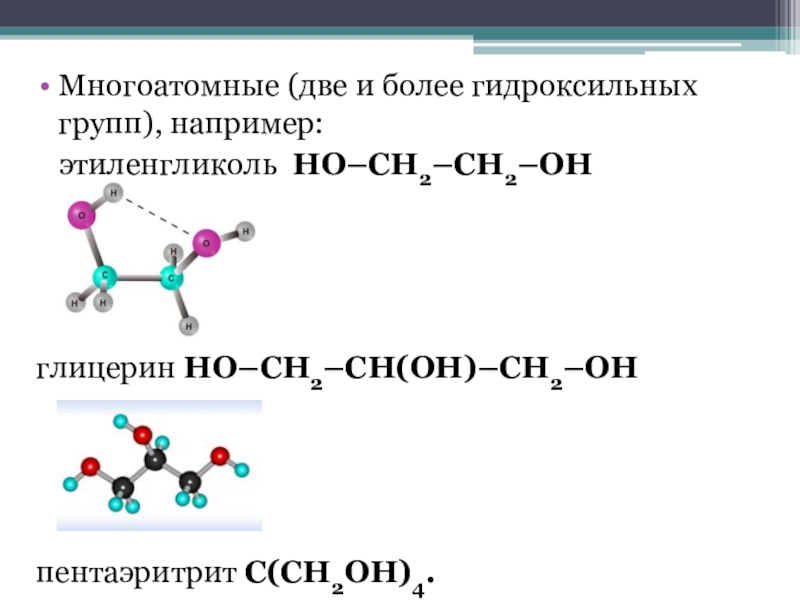
- 6. Многоатомные (две и более гидроксильных групп), например: этиленгликоль HO–СH2–CH2–OH глицерин HO–СH2–СН(ОН)–CH2–OH пентаэритрит С(СН2ОН)4.
- 7. 3.Физические свойства.Низшие спирты — жидкости ( С
- 8. 4.Химические свойства.Алифатические спирты — (слабые кислоты) могут
- 9. 5.Получение.Окисление предельных углеводородов Взаимодействие галогенопроизводных углеводородов со
- 10. 6.Применение.
Оглавление1.Определение.2.Разновидность спиртов.3.Физические свойства.4.Химические свойства.5.Получение.6.Применение.
Слайд 2Оглавление
1.Определение.
2.Разновидность спиртов.
3.Физические свойства.
4.Химические свойства.
5.Получение.
6.Применение.
Слайд 31.Определение
Спирты́— органические соединения, содержащие одну или несколько гидроксильных групп (гидроксил, -OH),
связанных с атомом углерода в углеводородном радикале. Общая формула простых предельных спиртов CnH2n+1OH.
Слайд 42.Разновидность спиртов.
Атомность спирта определяется числом гидроксильных групп в молекуле. По числу
гидроксильных групп спирты могут быть одно-, двух-, трёха́томными и более.
Одноатомные спирты называют алкоголями, двухатомные — гликолями (этиленгликоль), трёхатомные — глицеринами (глицерол). Спирты, содержащие больше трёх групп —OH объединяют названием многоатомные спирты (ксилит, или ксилитол).
Одноатомные спирты называют алкоголями, двухатомные — гликолями (этиленгликоль), трёхатомные — глицеринами (глицерол). Спирты, содержащие больше трёх групп —OH объединяют названием многоатомные спирты (ксилит, или ксилитол).
Слайд 5
Одноатомные спирты (содержат одну гидроксильную ОН-группу), например, метанол СН3ОН, этанол С2Н5ОН,
пропанол С3Н7ОН.
Этанол
Слайд 6Многоатомные (две и более гидроксильных групп), например:
этиленгликоль HO–СH2–CH2–OH
глицерин HO–СH2–СН(ОН)–CH2–OH
пентаэритрит С(СН2ОН)4.
Слайд 73.Физические свойства.
Низшие спирты — жидкости ( С 1 по 11), высшие
спирты — твёрдые вещества (начиная с С12 Н25 ОН), похожие на парафин.
Слайд 84.Химические свойства.
Алифатические спирты — (слабые кислоты) могут образовывать соли и комплексные
вещества с активными металлами. Например:
СН3-ОН + Na —> СН3—О—Na + Н2
Взаимодействие с галогеноводородами:
R-OH + HHal -> RHal + H2O
Межмолекулярная дегидратация(образование простых эфиров):
R-OH + R'-OH -> R-O-R' + H2O
СН3-ОН + Na —> СН3—О—Na + Н2
Взаимодействие с галогеноводородами:
R-OH + HHal -> RHal + H2O
Межмолекулярная дегидратация(образование простых эфиров):
R-OH + R'-OH -> R-O-R' + H2O
Слайд 95.Получение.
Окисление предельных углеводородов
Взаимодействие галогенопроизводных углеводородов со щелочью (гидролиз галогеналканов):
R—Cl + NaOH -> R—ОН + NaCl
Гидратацией непредельных углеводородов в присутствии концентрированной серной кислоты:
СН2=СН2 + Н2O -> СН3—СН2—ОН
Спирты образуются при брожении сахаристых веществ.
Гидратацией непредельных углеводородов в присутствии концентрированной серной кислоты:
СН2=СН2 + Н2O -> СН3—СН2—ОН
Спирты образуются при брожении сахаристых веществ.