- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии по теме Железо (9кл)
Содержание
- 1. Презентация по химии по теме Железо (9кл)
- 2. В народе без железа, как при обеде
- 3. Fe как химический элементПорядковый номер, номер периода
- 4. В земной коре 4 % железа, 2
- 5. Кристаллическая решетка железаОбъемно-центрированная кубическая решетка Гранецентрированная кубическая
- 6. Внимание посетителей Всемирной промышленной выставки в 1958г
- 7. Физические свойства железасеребристо- серый металлтускнеет на влажном
- 8. Химические свойства железа 1. реакция с кислородом
- 9. Fe+ CuCl2→ Cu+ FeCl24. реакция с солями5.
- 10. Железо в организме человекаобеспечивает кислородом все ткани
- 11. Слайд 11
- 12. Исаакиевский собор
- 13. Зеленый мост
- 14. Фонарь зеленого моста
- 15. Львиный мост
- 16. Чугунные перила Аничкова моста
- 17. Решетка летнего сада
- 18. Воронихинские ворота ,Казанский собор
- 19. Ящик для сбора пожертвований XVII в
- 20. Донская церковь
- 21. Ограда Благовещенского моста
- 22. Задания 1. При хранении железных изделий
- 23. 3. Установите соответствия меду формулами исходных веществ
Слайд 2В народе без железа, как при обеде без соли.
Куешь железо –
Человека губит горе, железо портит влага.
Железо в огне закаляется, человек -в нужде.
Урезонить сварливую жену все равно что ковать остывшее железо.
Слайд 3Fe как химический элемент
Порядковый номер, номер периода , группа, подгруппа
Порядковый
Заряд ядра, распределение электронов по уровням
Заряд ядра +26, распределение é 2, 8, 14, 2
Электронная формула внешнего уровня
…4s2 3d6
Степень окисления
+2, + 3
Слайд 4В земной коре 4 % железа,
2 место после алюминия.
По запасам железных
Магнитный железняк ( Fe3O4)- Урал
Красный железняк (Fe2O3) –
Кривой Рог
Лимонит (Fe2O3 * n H2O) –
Курск, Сибирь, Дальний Восток
Пирит ( FeS2)- Урал
Cидерит (FeCO3)
Слайд 5
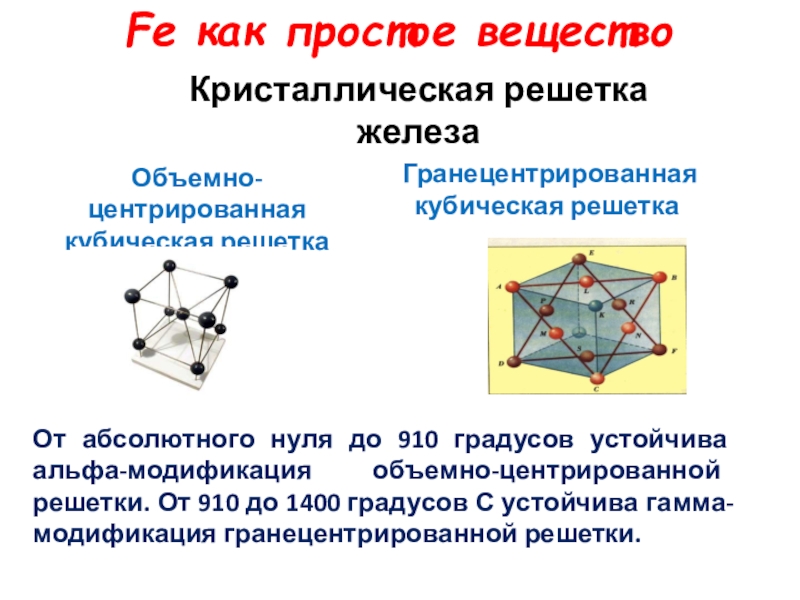
Кристаллическая решетка железа
Объемно-центрированная кубическая решетка
Гранецентрированная кубическая решетка
От абсолютного нуля до
Fe как простое вещество
Слайд 6Внимание посетителей Всемирной промышленной выставки в 1958г в Брюсселе привлекло здание
Слайд 7Физические свойства железа
серебристо- серый металл
тускнеет на влажном воздухе или в воде
пластично
температура
проводит ток и тепло
притягивается к магниту
Слайд 8Химические свойства железа
1. реакция с кислородом
Fe + O2 →
2. реакция с неметаллами
Fe + S→ Fe S
Fe + Сl 2→ Fe Cl 3
3. реакция с водой
Fe + Н2O→ Fe3O4 + Н 2
4. реакция с кислотами
Fe + H2SO4 → FeSO4 + H2
Слайд 9Fe+ CuCl2→ Cu+ FeCl2
4. реакция с солями
5. Особые свойства
Fe + Н2O
6. Реакции с азотной и концентрированной серной кислотами: не реагирует на холоду с конц. кислотами.
Fe+ разб.HNO3→ Fe(NO3)3+NO+ H2O
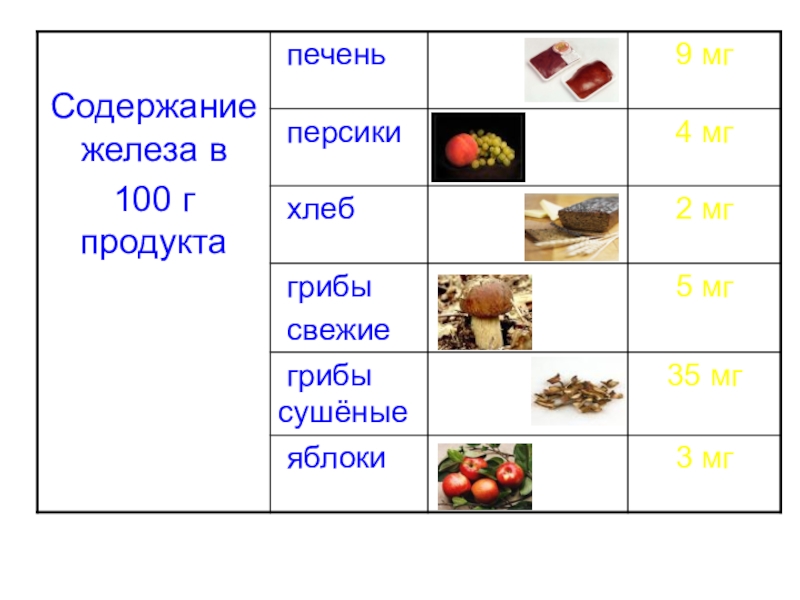
Слайд 10Железо в организме человека
обеспечивает кислородом все ткани нашего тела
синтез красных кровяных
защита организма от бактерий, участвует в образовании иммунных клеток.
является составной частью более 70 ферментов.
помогает полноценному процессу фагоцитоза, синтезу лизоцима.
Слайд 22Задания
1. При хранении железных изделий на воздухе в присутствии
2. Верны ли следующие суждения?
А. Сталь – это сплав железа с углеродом, где массовая доля углерода от 0,3% до 2%.
Б. Чугун обладает прочностью и хрупкостью.
1) верно только А;
2) верно только Б;
3) верны оба суждения;
4) оба суждения неверны.
Слайд 23
3. Установите соответствия меду формулами исходных веществ и продуктами реакции.
Исходные вещества:
содержащие железо:
А) Fe + Cl2 1) FeCl2
Б ) Fe + HCl 2) FeS
B) Fe + S 3) FeSO4
Г) Fe +H2SO4(конц) 4) FeCl3
Д) Fe +H2SO4 (разб) 5) Fe2(SO4)3