- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии по теме Галогены к обобщающему уроку 9 класс
Содержание
- 1. Презентация по химии по теме Галогены к обобщающему уроку 9 класс
- 2. К галогенам относятся пять основных неметаллических элементов,
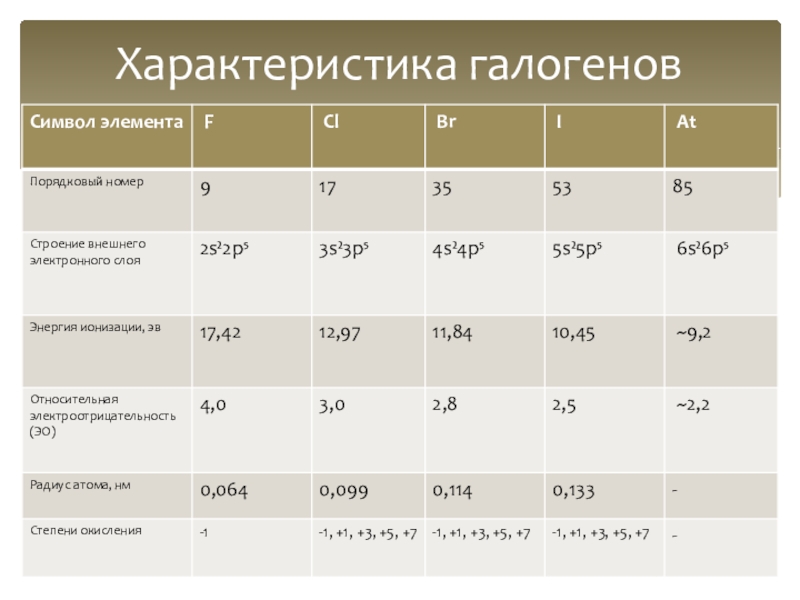
- 3. Характеристика галогенов
- 4. Названия галогенов, за исключением фтора, происходят от
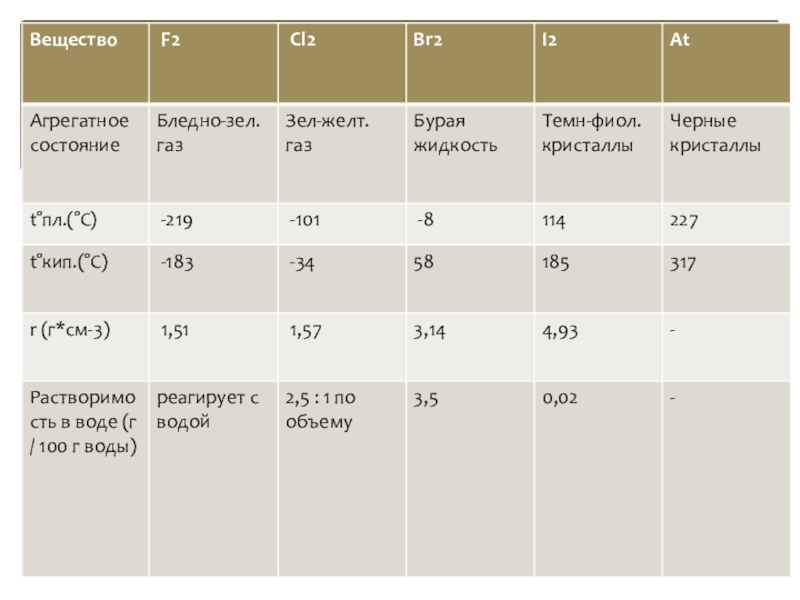
- 5. 1.Состоят из двух атомов; 2. Агрегатное состояние:F2
- 6. Слайд 6
- 7. I. Взаимодействие с неорганическими веществами:1. Взаимодействие с
- 8. Промышленное получение фтора и хлора связано с электролитическими процессами. Ввиду высокой окислительной активности фтора его получают исключительно электролизом расплавов фторидов металлов (в том числе и в лабораториях); хлор получают электролизом как расплавов, так и растворов
- 9. Применение фтора и его соединенийкерамикав имплантантахэмаль,
- 10. Применение хлора и его соединенийдезинтоксикационное средство
- 11. Применение бромаисходный продукт для получения ряда
- 12. Применение йодаВ аналитической химииОрганический синтезВ медицинедля
- 13. Хлор — один важнейших элементов, входящих в
- 14. F CaF2 - флюорит или плавиковый шпат
- 15. Фтор участвует в построении зубной эмали и
- 16. 1. Среди галогенов – простых веществ -
- 17. 1. Среди галогенов – простых веществ -
- 18. Примеры решения задач
- 19. 1 вариантВариант 1 2 3 4 5
Слайд 2К галогенам относятся пять основных неметаллических элементов, которые расположены в VII
Поскольку, до завершения энергетического уровня галогенам не хватает всего 1-го электрона, в ОВР они чаще всего проявляют свойства окислителей. Единственный элемент группы галогенов – фтор – проявляет только одну степень окисления «-1» и является самым электроотрицательным элементом
Реагируют почти со всеми простыми веществами, кроме некоторых неметаллов. Все галогены — энергичные окислители, поэтому встречаются в природе в виде соединений
Общая электронная конфигурация внешнего энергетического уровня - nS²nP⁵
Общая характеристика
Слайд 4Названия галогенов, за исключением фтора, происходят от греческих слов.
Слог «ген» в
О происхождении названий галогенов
Фтор флуо (лат.) течь, текучий (в
старину минерал полевой шпат CaF,
использовали в металлургии в качестве
флюса для придания легкоплавкости
шлакам)
Хлор хлорос (греч.) зеленовато-желтый
Бром бромос (греч.) зловонный
Йод иодес (греч.) фиолетовый
Астат астатос (греч.) неустойчивый
Слайд 51.Состоят из двух атомов;
2. Агрегатное состояние:
F2 – газ;
Cl2 – газ;
Br2 –
I2, At – твёрдые вещества.
3. Температура плавления, кипения и плотность повышаются с увеличением атомной массы. При этом их окраска становится более темной.
4. При каждом увеличении порядкового номера, уменьшается химическая активность, электроотрицательность и более слабыми становятся неметаллические свойства.
5. Обладают способностью образовывать соединения между собой, как например BrCl.
6. При комнатной температуре могут находиться во всех трех состояниях материи.
7. Относятся к токсичным химическим веществам.
Физические свойства галогенов
Слайд 7I. Взаимодействие с неорганическими веществами:
1. Взаимодействие с металлами:
Sn + Cl2 = SnCl2
2Fe + 3Cl2 = 2FeCl3
Cu + Br2 = CuBr2
Zn + I2 = ZnI2
2. Взаимодействие с водородом: Cl2 + H2 = 2HCl
3. Взаимодействие с водой: Cl2 + H2O = HCl + HClO (хлорноватистая кислота)
2Br2 + 2H2O = 4HF + O2
4. Взаимодействие со щелочами: Cl2 + 2KOH = KClO + KCl + H2O (без нагревания)
3Cl2 + 6KOH KClO3 + 5KCl + 3H2O (с нагреванием)
5. Взаимодействие с галогенидами - соединениями галогенов с металлами:
фтор вытесняет из солей хлор: 2NaCl + F2 = 2NaF + Cl2
фтор вытесняет из солей бром: 2KBr + F2 = 2KF + Br2
хлор вытесняет из солей бром: 2KBr + Cl2 = 2KCl + Br2
бром вытесняет из солей йод: KI + Br2 = 2KBr + I2
II. Взаимодействие органическими веществами (галогенирование - присоединение галогена). Галогены взаимодействуют со всеми классами органических соединений.
1. С алканами: CH3-CH3 + Cl2 → CH2Cl-CH3 + HCl (хлорэтан)
2. С алкенами: CH2=CH2 + Br2 → CH2Br-CH2Br (1,2-дибромэтан)
3. С алкинами: HC≡CH + Br2 → CHBr=CHBr (1,2-дибромэтен)
Химические свойства
Слайд 8Промышленное получение фтора и хлора связано с электролитическими процессами. Ввиду высокой окислительной активности фтора его получают исключительно электролизом расплавов фторидов металлов (в том числе и в лабораториях); хлор получают электролизом как расплавов, так и растворов хлоридов. Бром и йод получают химическим способом.
Например:
Фтор получают
В промышленности хлор в основном получают электролизом водного раствора хлорида натрия: 2NaCl + 2Н2О → Н2↑ + 2NaОН + Сl2↑
В лаборатории хлор получают действием различных окислителей на соляную кислоту: МnО2 + 4НСl → МnСl2 + Сl2↑ + 2Н2О
2KMnO4 + 16HCl →2MnCl2 + 5Cl2 + 2KCl + 8H2O
K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2 + 7H2O
Аналогично получают бром и йод, окисляя НВr, НI или их соли:
6КВr + К2Сr2О7 +7Н2SО4 → ЗВr2 + Сr2(SО4)3 + 4К2SО4 + 7Н2О.
Получение
Слайд 9
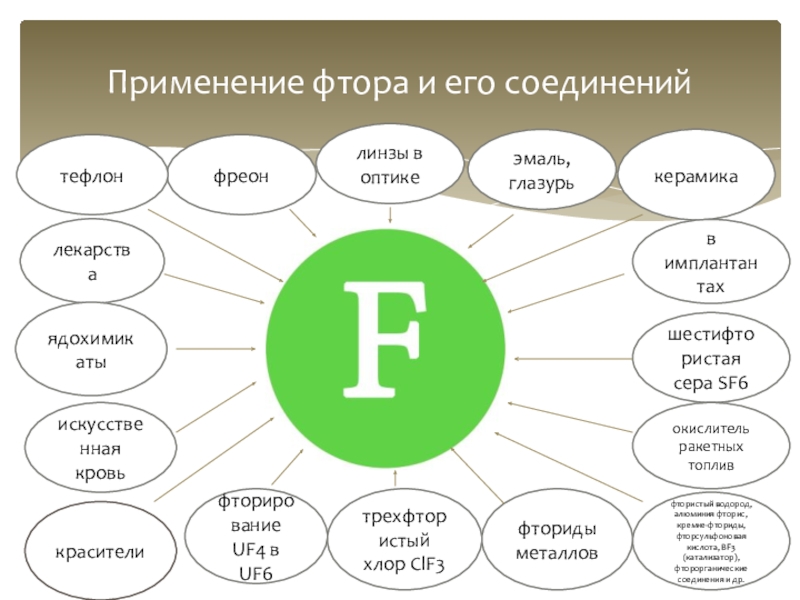
Применение фтора и его соединений
керамика
в имплантантах
эмаль, глазурь
линзы в оптике
фреон
тефлон
лекарства
ядохимикаты
искусственная кровь
красители
фторирование UF4
трехфтористый хлор СlF3
шестифтористая сера SF6
фториды металлов
фтористый водород, алюминия фторис, кремне-фториды, фторсульфоновая кислота, ВF3 (катализатор), фторорганические соединения и др.
окислитель ракетных топлив
Слайд 10
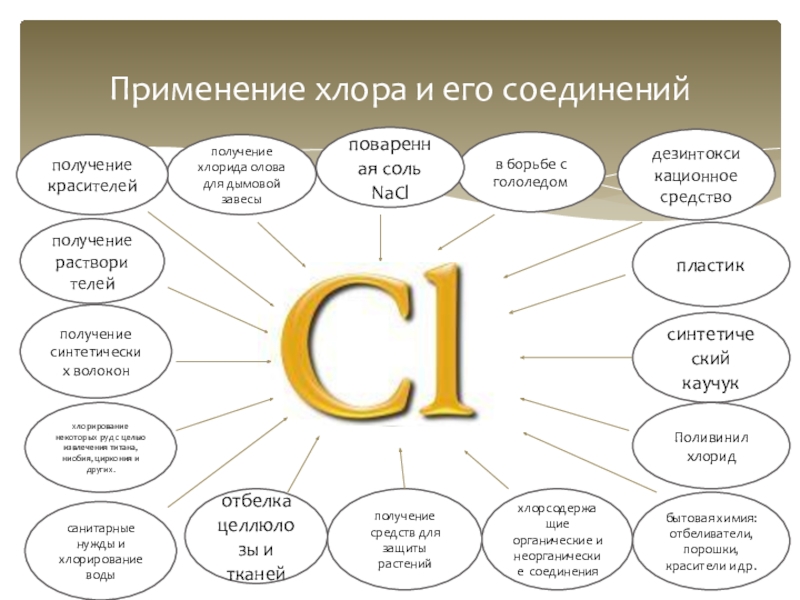
Применение хлора и его соединений
дезинтоксикационное средство
пластик
в борьбе с гололедом
поваренная соль
получение хлорида олова для дымовой завесы
получение красителей
получение раствори телей
получение синтетических волокон
хлорирование некоторых руд с целью извлечения титана, ниобия, циркония и других.
санитарные нужды и хлорирование воды
отбелка целлюлозы и тканей
получение средств для защиты растений
синтетический каучук
хлорсодержа щие органические и неорганические соединения
бытовая химия: отбеливатели, порошки, красители и др.
Поливинил хлорид
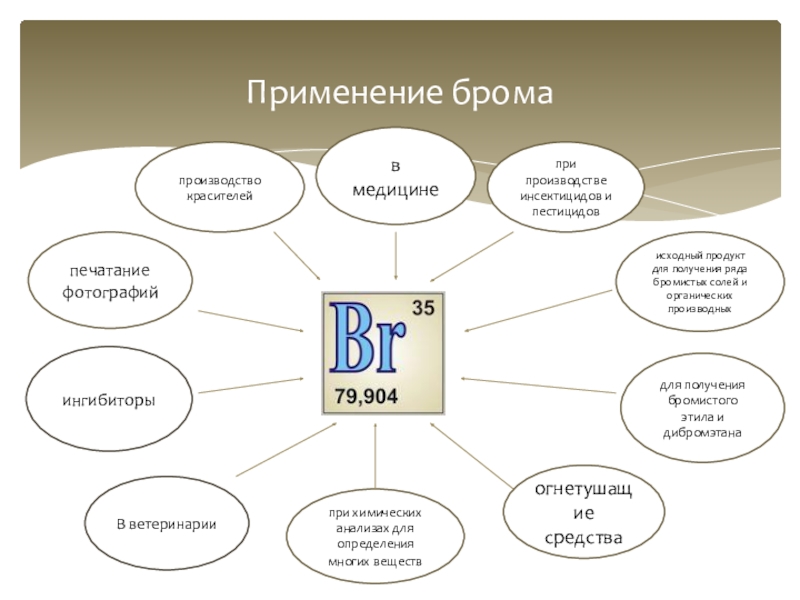
Слайд 11
Применение брома
исходный продукт для получения ряда бромистых солей и органических производных
для
при производстве инсектицидов и пестицидов
в медицине
производство красителей
печатание фотографий
ингибиторы
В ветеринарии
огнетушащие средства
при химических анализах для определения многих веществ
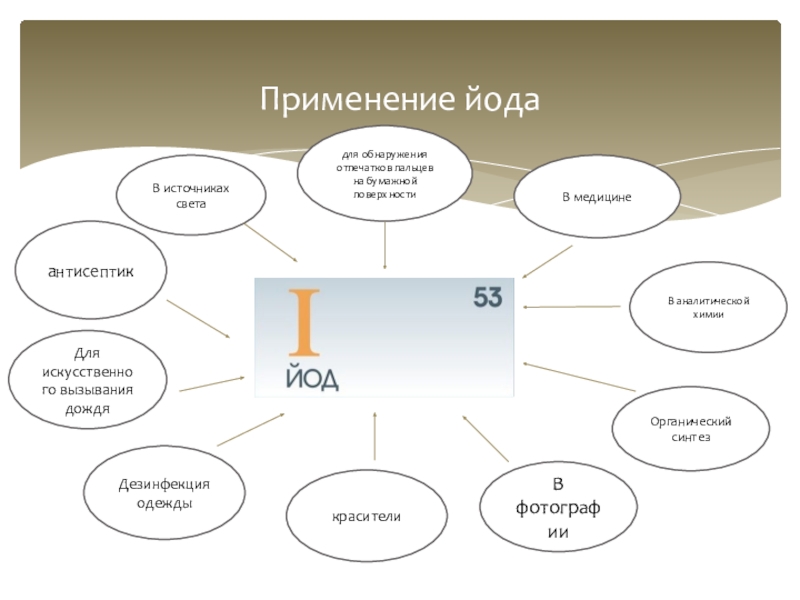
Слайд 12
Применение йода
В аналитической химии
Органический синтез
В медицине
для обнаружения отпечатков пальцев на бумажной
В источниках света
антисептик
Для искусственного вызывания дождя
Дезинфекция одежды
В фотографии
красители
Слайд 13Хлор — один важнейших элементов, входящих в состав живых организмов. В
HCl, входящая в состав желудочного сока, контролирует процессы пищеварения. В отсутствие 0,2%-ной НСl процесс переваривания пищи практически прекращается.
Водоросли, а также некоторые другие растения активно накапливают бром. Морская вода содержит самое большое количество брома, который способен переходить в воздух, поэтому его содержание в воздухе приморских районов всегда больше, чем в районах, далеких от моря.
Йод, как и хлор — один важнейших элементов, входящих в состав живых организмов. Недостаток йода в воде и пище снижает выработку гормона щитовидной железы и приводит к заболеванию эндемическим зобом. Йод попадает в организм вместе с пищей: хлебом, яйцами, молоком, водой, морской капустой и с воздухом (особенно морским) при дыхании.
Биологическое значение
Слайд 14F
CaF2 - флюорит или плавиковый шпат
3Ca(PO4 ) 2*CaF2 -
Na3 AlF6 – криолит
Cl
NaCl - галит (каменной соли)
KCl *NaCl – сильвинит
MgCl 2*2H2O - бишофит
KCl*NaCl 2*6H2O - карналлит
KCl*MgSO 4*3H2O - каинит
Br
AgBr – бромаргирит
Морская вода – главный источник рассеянного элемента – брома. В организме человека больше всего брома содержится в мозге, а среди растений больше всего накапливают бром бобовые и морские водоросли.
I
Йод не образует самостоятельных месторождений, характеризуется крайней рассеянностью в природе. Большая часть содержится в морской воде, в водорослях.
Нахождение в природе
Слайд 15Фтор участвует в построении зубной эмали и костей, повышает устойчивость зубов
Хлор участвует в сохранении водно-солевого баланса и поддерживании осмотического давления, участвует в обмене веществ, построении тканей, в избавление от лишнего веса. Без соляной кислоты, находящейся в составе желудочного сока невозможен процесс переваривания пищи. Если норму поступления хлора в организм превысить или снизить, то появятся отеки, головные боли и другие симптомы, которые способны нарушить обмен веществ и вызвать заболевания кишечника.
У человека в мозге, почках, крови и печени присутствует небольшое количество брома. В медицинских целях бром применяют, как успокоительное средство. Передозировка может привести к угнетенному состоянию нервной системы, а в некоторых случаях к психическим расстройствам. Недостаток брома ведет к дисбалансу между процессами возбуждения и торможения.
Без йода щитовидная железа не может обходиться, он убивает микробы, поступающие в наше тело. При дефиците йода может начаться заболевание щитовидной железы - зоб.
Вывод: без галогенов человек не только лишиться многих необходимых в повседневной жизни вещей, но и не сможет нормально функционировать наш организм.
Роль галогенов и их соединений для здоровья человека
Слайд 16
1. Среди галогенов – простых веществ - твердым является
1.фтор
2.хлор
3.бром
4.иод.
2.
1.самый активный;
2.самый электроотрицательный;
3.самый агрессивный;
4.самый легкий элемент.
3. Наиболее ярко выражены восстановительные свойства у
1.фтора
2.хлора
3.брома
4.иода.
4. Из галогенов как отравляющее вещество в боевых действиях был применен впервые
1.фтор
2.хлор
3.бром
4.иод.
5. Степень окисления хлора в соединении Са (ОСl)2
1.-1
2.+1
3.+3
4.+5
6. Сила галогеноводородных кислот возрастает в ряду
1.НСl, НВr, НI;
2.НI, НВr, НСl;
3.НВr, НI, НСl;
4.НI, НСl, НВr.
7. При сливании растворов бромида калия и нитрата серебра образуется осадок
1.белого цвета;
2.желтоватого цвета;
3.желтого цвета;
4.оранжевого цвета.
8. Смешали два раствора, содержащие равные массы хлорида натрия и нитрата серебра по 20 г каждого. Масса выпавшего осадка равна
1.16,8 г
2.33,6 г
3.48,8 г
4.97,7 г
9. Фтор взаимодействует с водой по уравнению _____________________
10. Хлор взаимодействует с горячим раствором гидроксида калия по уравнению ____________________________________________________
Тема «Галогены». Вар. 1
Слайд 171. Среди галогенов – простых веществ - жидким является
1.фтор
2.хлор
3.бром
4.иод.
2. Электронную
1.ns2np2
2.ns2np3
3.ns2np4
4.ns2np5.
3. Наиболее ярко выражены окислительные свойства у
1.фтора
2.хлора
3.брома
4.иода.
4. С какими из перечисленных веществ хлор не взаимодействует?
1.Водой;
2.раствором хлорида натрия;
3.раствором бромида натрия;
4.раствором щелочи.
5. Наиболее сильной из кислот является
1.НСlО
2.НСlО2
3.НСlО3
4.НСlО4
6. Раствор фтора в воде получить нельзя, так как
1.фтор не растворяется в воде;
2.фтор разлагает воду; фтор частично растворяется в воде;
3.фтор вытесняет из воды водород.
7. При сливании растворов иодида натрия и нитрата серебра образуется осадок
1.белого цвета;
2.желтоватого цвета;
3.желтого цвета;
4.оранжевого цвета.
8. В раствор, полученный при пропускании 11,2 л газообразного хлороводорода в 100 см3 воды, поместили 13 г цинка. Объем выделившегося газа равен (при н. у.)
1.22,4 л
2.11,2 л
3.5,6 л
4.4,48 л.
9. Хлор в лаборатории получают при взаимодействии соляной кислоты с оксидом марганца (IV) по уравнению ______________________________________
10. Хлор взаимодействует с холодным раствором гидроксида калия по уравнению _______________________________________________________
Тема «Галогены». Вар. 2
Слайд 191 вариант
Вариант 1 2 3 4 5 6 7 8
Ответ
9. 2F2 + 2H2O = 4HF + O2
t
10. 3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
2 вариант
Вариант 1 2 3 4 5 6 7 8
Ответ 3 4 1 2 4 2 3 4
9. 4HCl + MnO2 = MnCl2 + Cl2 + 2H2O 10. Cl2 + 2KOH = KCl + KClO + H2O
Вопросы 1–8 оцениваются 1 баллом, вопросы 9–10 – 2 баллами.
Максимальное количество баллов – 12.
Шкала перевода баллов в отметку:
10–12 баллов - «5», 7–9 баллов - «4», 4–6 баллов - «3».
Тема «Галогены» (решения и ответы)