- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Оксиды, их классификация и свойства
Содержание
- 1. Презентация по химии Оксиды, их классификация и свойства
- 2. Цель урокаОбобщить сведения об оксидах;Развивать навыки в
- 3. Оксиды – сложные вещества,состоящие из двухэлементов, один из которыхкислород со степеньюокисления -2.
- 4. Карточка№1Напишите формулы оксидов, которым будут соответствовать следующие
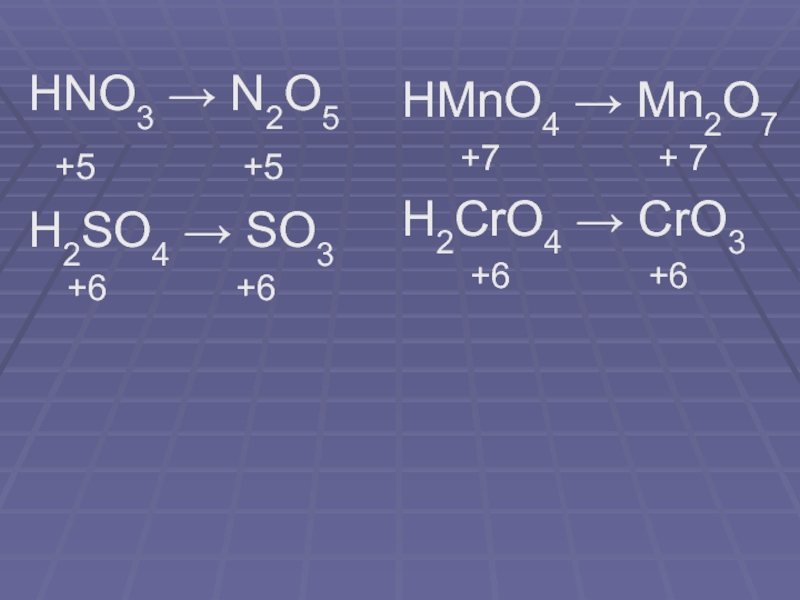
- 5. Карточка №2Напишите формулы оксидов, соответствующих следующим гидроксидам: HNO3; H2SO4; HMnO4; H2CrO4.Определите степень окисления элементов
- 6. Физические свойства оксидовкварцаметистхалцедон
- 7. Слайд 7
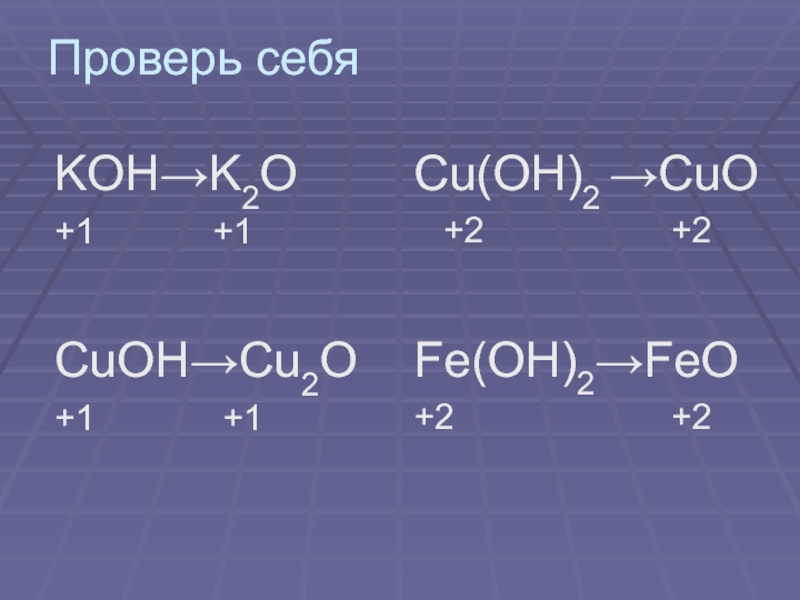
- 8. Проверь себяKOH→K2O+1
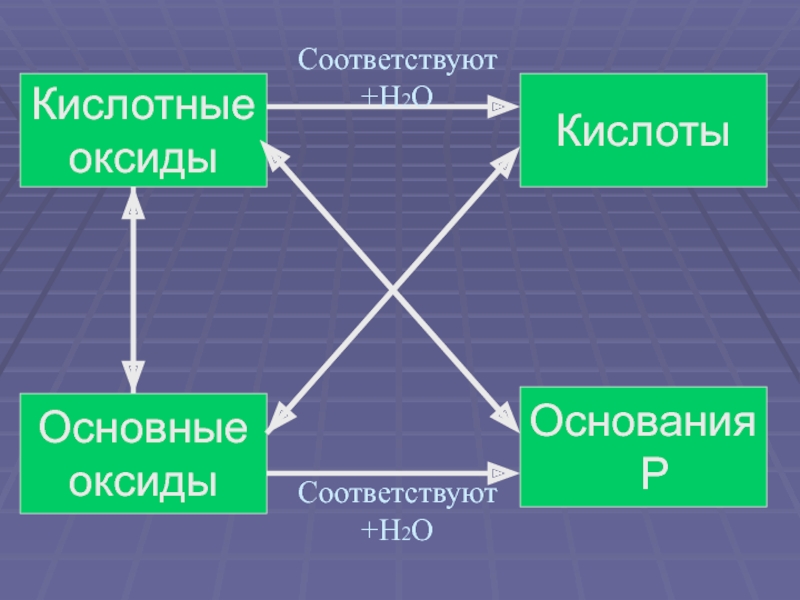
- 9. Основные оксиды - это оксиды металлов со степенью окисления +1;+ 2Им соответствуют основания
- 10. HNO3 → N2O5 +5
- 11. Кислотные оксиды - это оксидынеметаллов, а также оксиды металлов с большим значением степени окисления.Им соответствуют кислоты.
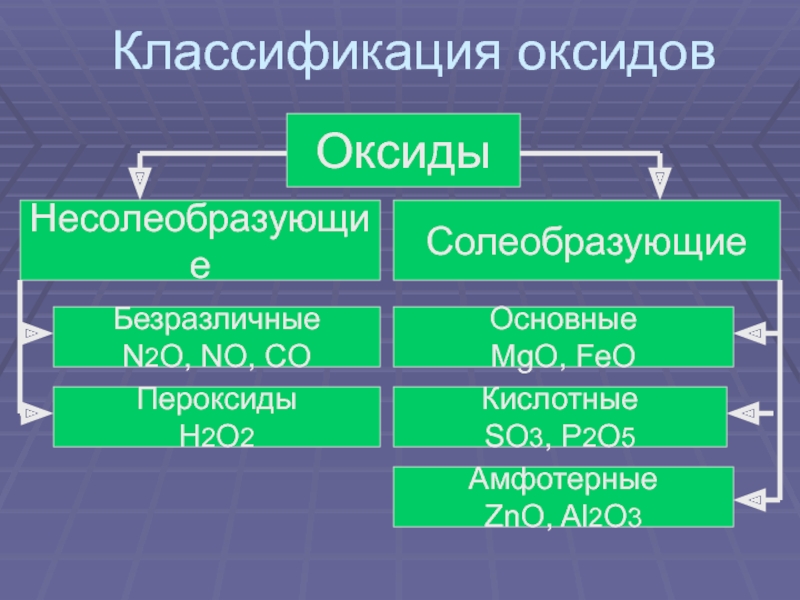
- 12. Классификация оксидовОксидыНесолеобразующиеСолеобразующиеБезразличныеN2O, NO, COПероксидыH2O2ОсновныеMgO, FeOАмфотерныеZnO, Al2O3КислотныеSO3, P2O5
- 13. Несолеобразующими оксидами называют такие оксиды, которые не
- 14. Химические свойстваI группа Взаимодействие основных оксидов: а)
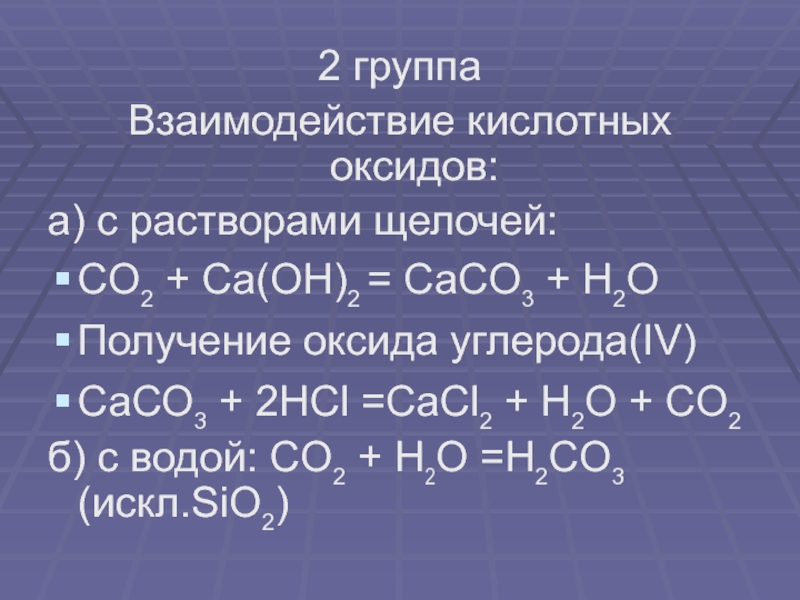
- 15. 2 группаВзаимодействие кислотных оксидов: а) с растворами
- 16. в) взаимодействие основных и кислотных оксидов между собой:CaO + CO2 = CaCO3
- 17. КислотыКислотныеоксидыОснования РОсновныеоксидыСоответствуют +H2OСоответствуют +H2O
- 18. В периодах слева направоОсновные свойства оксидов ослабеваютКислотные свойства - усиливаются
- 19. Тестирование1) Неправильно составлена формула оксида: А) MgO
- 20. 4)Оксид, реагирующий с кислотой:А) FeO Б)
- 21. 6) Выберите ряд оксидов, реагирующих с водой:А)
- 22. 7)Основные свойства в ряду веществLi2O – BeO – B2O3А) ослабевают Б) усиливаются В) не изменяются
- 23. Ответы1) г
- 24. Оценивание работы за 7 правильных ответов
Цель урокаОбобщить сведения об оксидах;Развивать навыки в определении степени окисления элементов;Научить узнавать основные и кислотные оксиды;Изучить химические свойства основных и кислотных оксидов.
Слайд 2Цель урока
Обобщить сведения об оксидах;
Развивать навыки в определении степени окисления элементов;
Научить
узнавать основные и кислотные оксиды;
Изучить химические свойства основных и кислотных оксидов.
Изучить химические свойства основных и кислотных оксидов.
Слайд 3Оксиды – сложные вещества,
состоящие из двух
элементов, один из которых
кислород со степенью
окисления
-2.
Слайд 4Карточка№1
Напишите формулы оксидов, которым будут соответствовать следующие основания: KOH; CuOH; Cu(OH)2;
Fe(OH)2;
Определите степень окисления металлов в написанных формулах;
Определите степень окисления металлов в написанных формулах;
Слайд 5Карточка №2
Напишите формулы оксидов, соответствующих следующим гидроксидам:
HNO3; H2SO4; HMnO4;
H2CrO4.
Определите степень окисления элементов
Определите степень окисления элементов
Слайд 11Кислотные оксиды - это оксиды
неметаллов, а также оксиды металлов с большим
значением степени окисления.
Им соответствуют кислоты.
Им соответствуют кислоты.
Слайд 12Классификация оксидов
Оксиды
Несолеобразующие
Солеобразующие
Безразличные
N2O, NO, CO
Пероксиды
H2O2
Основные
MgO, FeO
Амфотерные
ZnO, Al2O3
Кислотные
SO3, P2O5
Слайд 13Несолеобразующими оксидами называют такие оксиды, которые не взаимодействуют ни с кислотами,
ни со щелочами и не образуют солей.
Солеобразующими называют такие оксиды, которые взаимодействуют с кислотами или основаниями и образуют при этом соль и воду.
Солеобразующими называют такие оксиды, которые взаимодействуют с кислотами или основаниями и образуют при этом соль и воду.
Слайд 14Химические свойства
I группа
Взаимодействие основных оксидов:
а) с растворами кислот:
CuO +
H2SO4 = CuSO4 + H2O
CuO + 2H+ = Cu 2+ +H2O
б) с водой: CaO + H2O =Ca(OH)2
Р
CuO + 2H+ = Cu 2+ +H2O
б) с водой: CaO + H2O =Ca(OH)2
Р
Слайд 152 группа
Взаимодействие кислотных оксидов:
а) с растворами щелочей:
СO2 + Сa(OH)2 =
СаCO3 + H2O
Получение оксида углерода(IV)
СаСО3 + 2HCl =CaCl2 + H2O + CO2
б) с водой: CO2 + H2O =H2CO3 (искл.SiO2)
Получение оксида углерода(IV)
СаСО3 + 2HCl =CaCl2 + H2O + CO2
б) с водой: CO2 + H2O =H2CO3 (искл.SiO2)
Слайд 18В периодах слева направо
Основные свойства оксидов ослабевают
Кислотные свойства - усиливаются
Слайд 19Тестирование
1) Неправильно составлена формула оксида:
А) MgO Б) Al2O3
В) N2O5 Г) LiO2
2) Кислотный оксид – это:
А) Na2O Б) SO2 В) BaO Г) K2O
3) Основный оксид – это:
А) SO2 Б) CO2 В) CaO Г)CrO3
2) Кислотный оксид – это:
А) Na2O Б) SO2 В) BaO Г) K2O
3) Основный оксид – это:
А) SO2 Б) CO2 В) CaO Г)CrO3
Слайд 20
4)Оксид, реагирующий с кислотой:
А) FeO Б) CrO3 В) SO3
Г)CO2
5)Оксид, реагирующий с растворимым основанием:
А) CuO Б) CaO В) CO2 Г)MgO
5)Оксид, реагирующий с растворимым основанием:
А) CuO Б) CaO В) CO2 Г)MgO
Слайд 216) Выберите ряд оксидов, реагирующих с водой:
А) MnO, SO3, CuO
Б) Na2O,
Ag2O, CaO
В) ZnO, Al2O3, CO2
Г) Na2O, CO2, CaO
В) ZnO, Al2O3, CO2
Г) Na2O, CO2, CaO
Слайд 227)Основные свойства в ряду веществ
Li2O – BeO – B2O3
А) ослабевают Б)
усиливаются
В) не изменяются
В) не изменяются
Слайд 24Оценивание работы
за 7 правильных ответов – «5»
за 6
- 5 правильных ответов – «4»
за 4 правильных ответа – «3»
Домашнее задание
§40, упр. №1,3 стр.221
за 4 правильных ответа – «3»
Домашнее задание
§40, упр. №1,3 стр.221