- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку химии в 9 классе по теме
Содержание
- 1. Презентация к уроку химии в 9 классе по теме
- 2. Кислород как элемент.1. Элемент кислород находится в
- 3. Кислород как элемент (продолжение).4. В земной коре
- 4. Физические свойства Газ - без цвета, вкуса
- 5. Химические свойстваС неметалламиC + O2 → CO2S
- 6. Способы полученияПромышленный способ (перегонка жидкого воздуха).Лабораторный способ
- 7. Способы получения кислорода (продолжение).перманганата калия при нагревании:2KMnO4
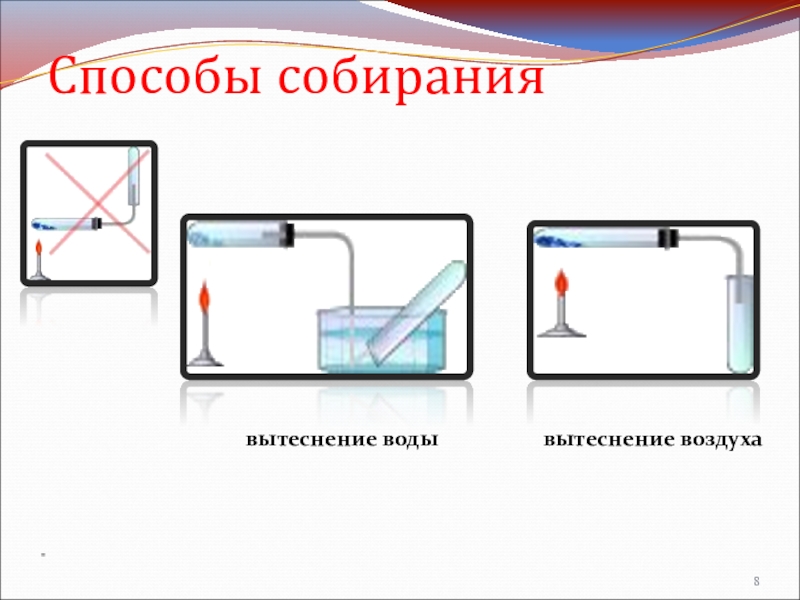
- 8. Способы собирания
- 9. Применение кислорода:Находит широкое применение в медицине и
Слайд 2Кислород как элемент.
1. Элемент кислород находится в VI группе, главной подгруппе,
Ar = 16.
2. Строение атома:
P11 = 8; n01 = 8; ē = 8
валентность II, степень окисления -2
(редко +2; +1; -1).
3. Входит в состав оксидов, оснований, солей, кислот, органических веществ, в том числе живых организмов- до 65% по массе.
Слайд 3Кислород как элемент (продолжение).
4. В земной коре его 49% по массе,
5. В составе воздуха (в виде простого вещества) – 20-21% по объёму.
Состав воздуха:
О2 – 20-21 %; N2 – 78%; CO2 – 0,03%,
остальное приходится на инертные газы, пары воды, примеси.
Кислород является самым распространённым элементом нашей планеты. По весу на его долю приходится примерно половина общей массы всех элементов земной коры.
Слайд 4Физические свойства
Газ - без цвета, вкуса и запаха; в 100V
t°кип= -183°С; t°пл = -219°C; d по воздуху = 1,1.
При давлении 760 мм. рт.ст. и температуре
–183 °С кислород сжижается
Слайд 5Химические свойства
С неметаллами
C + O2 → CO2
S + O2 → SO2
2H2
5
Со сложными веществами
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
2H2S + 3O2 → 2SO2 + 2H2O
CH4 + 2O2 → CO2 + 2H2O
С металлами
2Mg + O2 → 2MgO
2Cu + O2 –t°→ 2CuO
Взаимодействие веществ с кислородом называется окислением.
С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех реакциях (кроме взаимодействия со фтором) кислород - окислитель.
1. Неустойчив: O3 → O2 + O
2. Сильный окислитель: 2KI + O3 + H2O → 2KOH + I2 + O2
Обесцвечивает красящие вещества, отражает УФ - лучи, уничтожает микроорганизмы.
Слайд 6Способы получения
Промышленный способ (перегонка жидкого воздуха).
Лабораторный способ (разложение некоторых кислородосодержащих веществ)
2H2O2 –MnO2→ 2H2O + O2↑
Получение 3O2 → 2O3
Во время грозы (в природе),
(в лаборатории) в озонаторе
6
Слайд 7Способы получения кислорода (продолжение).
перманганата калия при нагревании:
2KMnO4 –t°→ K2MnO4 + MnO2
Разложение этой соли идёт при нагревании её
выше 2000 С.
Нагрев 2KMnO4 Проверка собравшегося
кислорода
Слайд 9Применение кислорода:
Находит широкое применение в медицине и промышленности.
При высотных полётах лётчиков
При многих лёгочных и сердечных заболеваниях, а также при операциях дают вдыхать кислород из кислородных подушек.
Кислородом в баллонах снабжают подводные лодки.
Горение рыхлого горючего материала, пропитанного жидким кислородом, сопровождается взрывом, что даёт возможность применять кислород при взрывных работах.
Жидкий кислород применяют в реактивных двигателях, в автогенной сварке и резке металлов, даже под водой.
*