- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на темуКислоты как электролиты 8 класс
Содержание
- 1. Презентация по химии на темуКислоты как электролиты 8 класс
- 2. 2. Из приведенных формул веществ: HNO2, H2SO4,
- 3. а) HNO2- азотистая кислота, H2SO4 - серная
- 4. Слайд 4
- 5. Слайд 5
- 6. 1. Что общего в строении всех кислот?Катион
- 7. Опыт 1. Действие индикатора на кислоты +
- 8. Опыт 2. “Взаимодействие кислот с металлами”2HCl +
- 9. Опыт 3. « Взаимодействие кислот с основными
- 10. Опыт 5 « Взаимодействие кислот с солями»H2SO4 +
- 11. Слайд 11
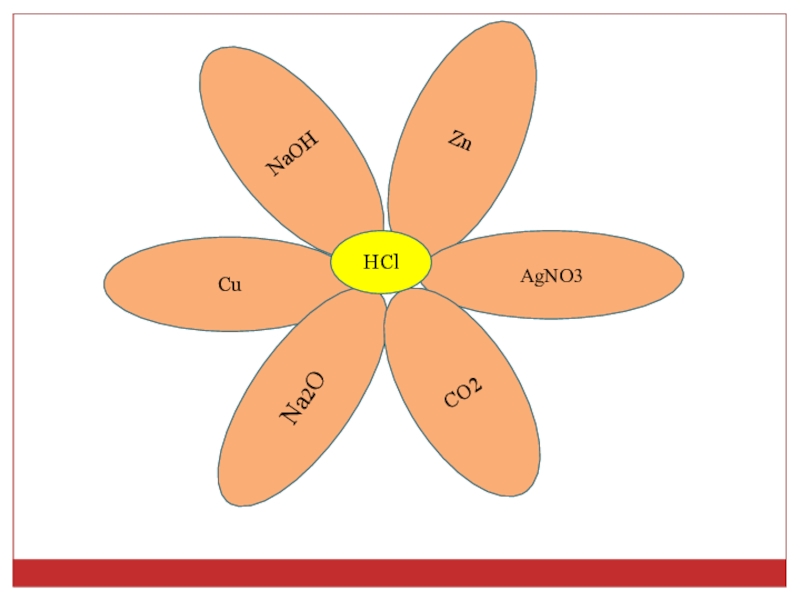
- 12. NaOHCuZnAgNO3Na2OCO2HCl
- 13. Рефлексия
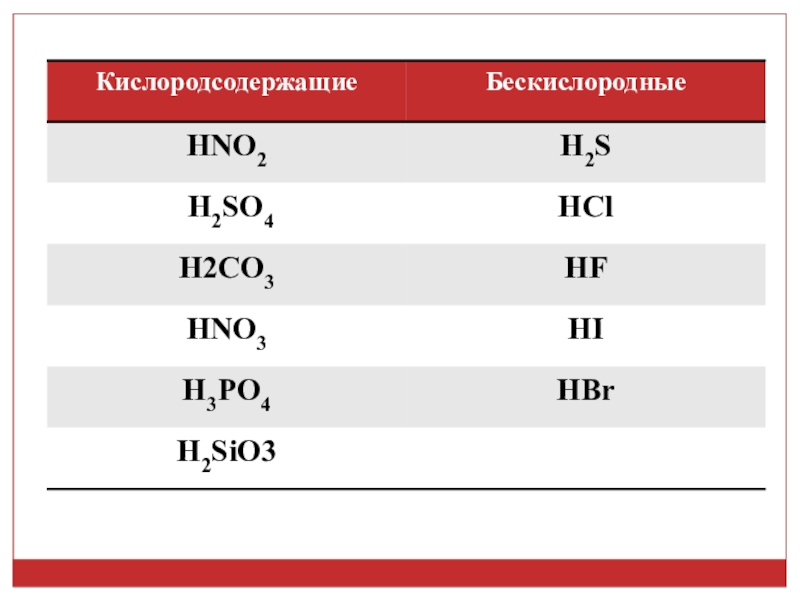
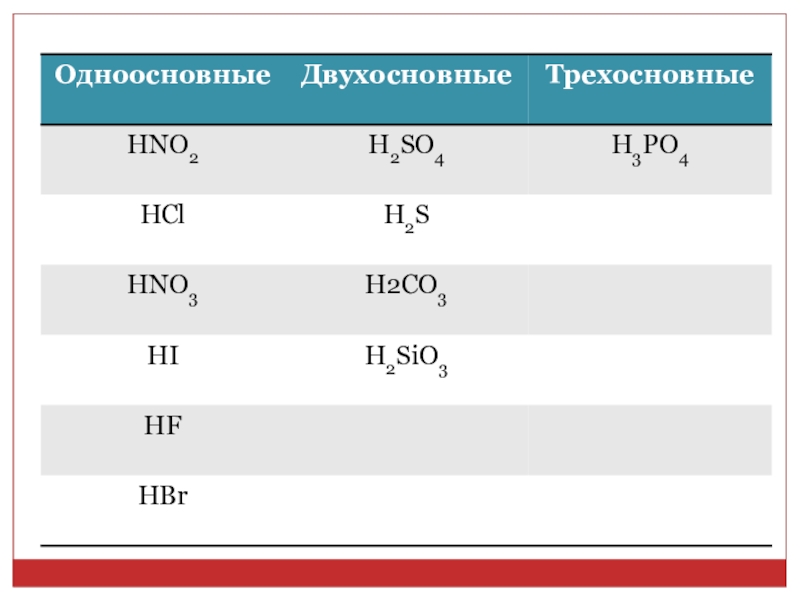
2. Из приведенных формул веществ: HNO2, H2SO4, HI, H2S, HCl, H2CO3, HNO3, HBr,H3PO4, H2SiO3, HF, выпишите формулы кислот в таком порядке: а) назовите кислоты. б) сначала в два столбика кислородсодержащие и бескислородные кислоты; в) затем в
Слайд 22. Из приведенных формул веществ: HNO2, H2SO4, HI, H2S, HCl, H2CO3,
HNO3, HBr,H3PO4, H2SiO3, HF, выпишите формулы кислот в таком порядке:
а) назовите кислоты.
б) сначала в два столбика кислородсодержащие и бескислородные кислоты;
в) затем в три столбика – одно-, двух-, трехосновные кислоты.
а) назовите кислоты.
б) сначала в два столбика кислородсодержащие и бескислородные кислоты;
в) затем в три столбика – одно-, двух-, трехосновные кислоты.
Слайд 3а) HNO2- азотистая кислота, H2SO4 - серная кислота, H2S - сероводородная
кислота, HCl - хлороводородная кислота, H2CO3 - угольная кислота, HNO3 - азотная кислота, H3PO4 - фосфосфорная кислота, H2SiO3 - кремниевая кислота, HF - фтороводородная кислота, HI –йодоводородная, HBr – бромоводородная кислота
Слайд 61. Что общего в строении всех кислот?
Катион водорода
Общая формула кислот
НnA.
2. Что происходит с кислотой в воде?
В воде кислоты диссоциируют на катион водорода и кислотный остаток.
НnA = Н+ + An-
Слайд 7Опыт 1. Действие индикатора на кислоты
+ лакмус – красный
+ метилоранж
–розовый
+ фенолфталеин - цвет не меняется
Вывод: лакмус и метилоранж можно использовать для определения кислоты.
+ фенолфталеин - цвет не меняется
Вывод: лакмус и метилоранж можно использовать для определения кислоты.
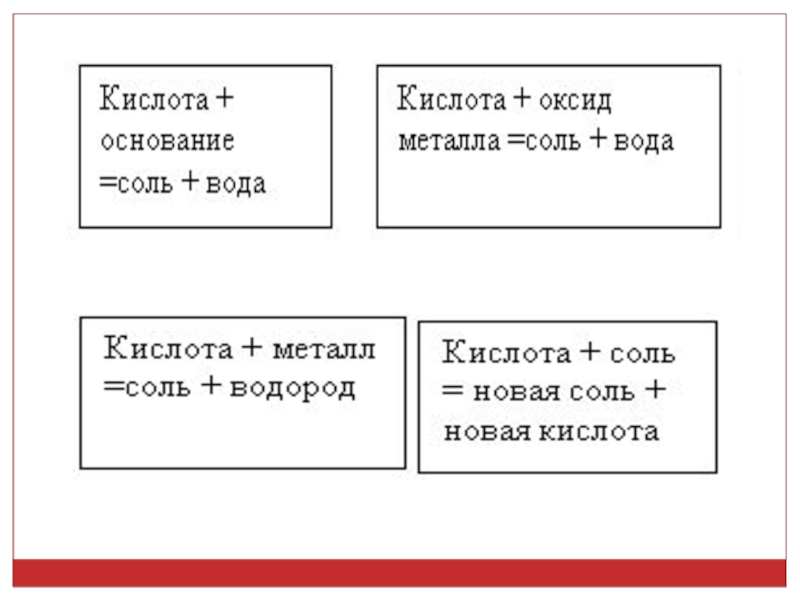
Слайд 8Опыт 2. “Взаимодействие кислот с металлами”
2HCl + Zn = ZnCl2 + H2
2H+ +
2Cl- + Zn0 = Zn2+ + 2Cl- + H20
2H+ + Zn0 = Zn2+ + H20
HCl + Cu = реакция не идёт
Правило: металлы расположенные в ряду активности металлов до Н способны вытеснять его из растворов кислот.
Правило: металлы расположенные в ряду активности металлов до Н способны вытеснять его из растворов кислот.
Слайд 9Опыт 3. « Взаимодействие кислот с основными оксидами»
H2SO4 + CuO = CuSO4 +
H2O
2H+ + SO42- + CuO = Cu2+ + SO4 2- + H2O
2H+ + CuO = Cu2++ H2O
Опыт 4 « Взаимодействие кислот с щелочами (основаниями)»
HCl + NaOH = NaCl + H2O
H+ + Cl- + Na+ + OH- = Na+ + Cl- + H2O
H+ + OH- = H2O;
Слайд 10Опыт 5 « Взаимодействие кислот с солями»
H2SO4 + К2СО3 = K2SO4 + H2O
+ CO2
2H+ + SO42- +2K+ +СО32- = 2K + +SO42- + H2O +CO2
2H+ + СО32- = H2O +CO2
Реакция протекает в случае образования газа или осадка.
Реакция протекает в случае образования газа или осадка.