- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на темуГалогены
Содержание
- 1. Презентация по химии на темуГалогены
- 2. От греч. Галоген Галс –
- 3. Элементы VII «А» группыFAtIBrCl
- 4. Общая характеристика галогеновГалогены – это естественная группа
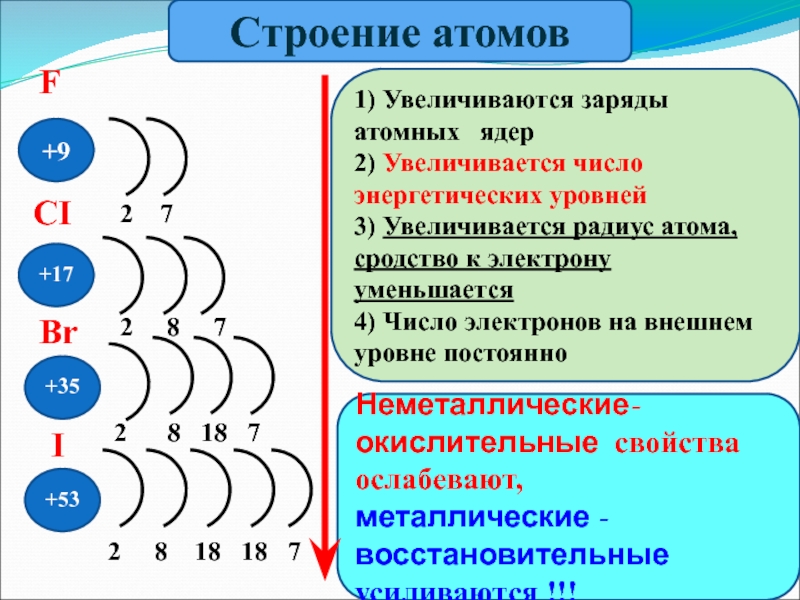
- 5. +9 +53+35+17Неметаллические-окислительные свойства ослабевают,металлические -восстановительные усиливаются
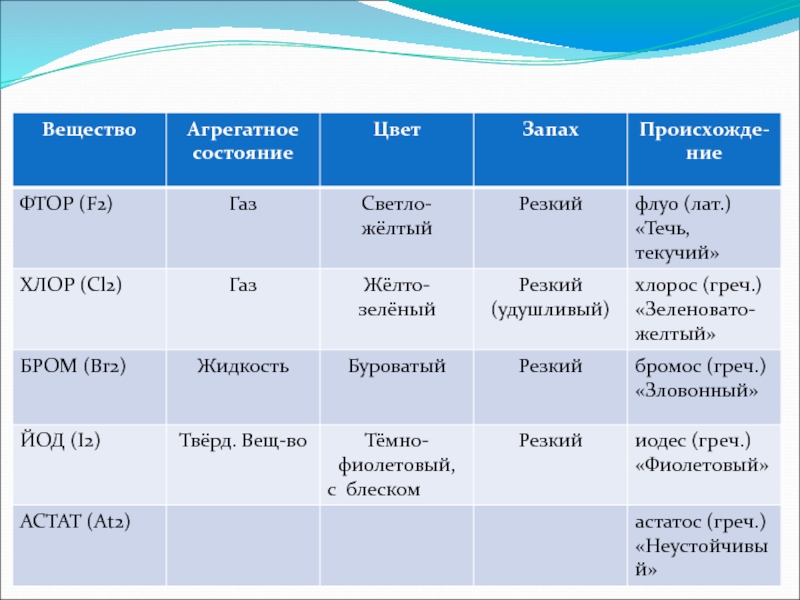
- 6. Общие свойства галогенов:Резкий запахВзаимодействуют с Н2Небольшая растворимость
- 7. :Г + Г: → :Г(:) Г:..................Химическая связьК НКристаллическая решеткамолекулярная?
- 8. CI2Br2I2F2Простые вещества
- 9. Слайд 9
- 10. CI2
- 11. -1+7-1+3-1+5-1+10 Определите степени окисления атомов галогенов в веществах :
- 12. ФТОРПовышает устойчивость зубов к кариесу, Стимулирует кроветворение,Репаративные
- 13. Потребность во фторе взрослого человека - 2-3
- 14. Хлор всегда добавляютв бассейны!
- 15. Жидкий хлор вызывает серьезные ожоги
- 16. Советуем: прежде, чем пить водуиз-под крана, обязательно пропуститееё через фильтры, а по возможностиПрокипятите!
- 17. БРОМNaBr и KBr – одни из лучших
- 18. Слайд 18
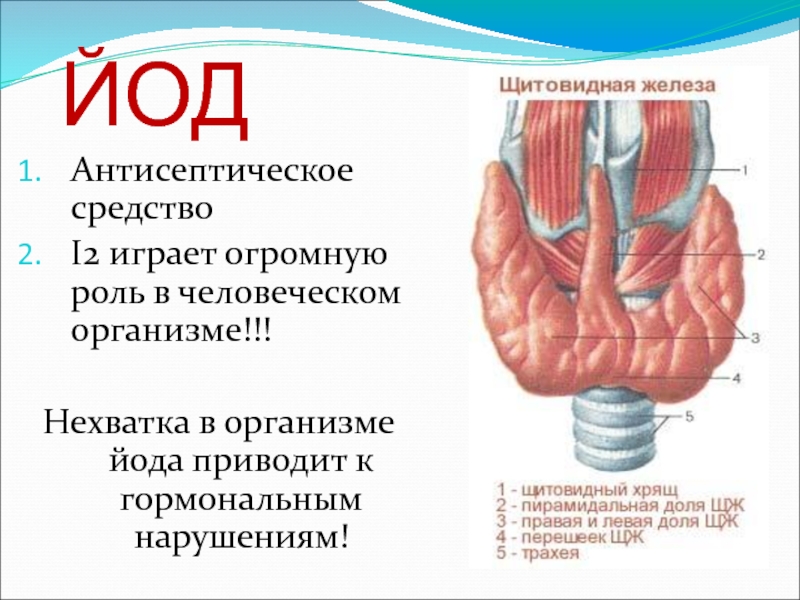
- 19. ЙОДАнтисептическое средствоI2 играет огромную роль в человеческом организме!!!Нехватка в организме йода приводит к гормональным нарушениям!
- 20. Советуем: каждый день употреблятьПрепараты, восстанавливающиеСодержание йода в организме!!!
- 21. Слайд 21
- 22. АСТАТОчень радиоактивен!!! Необходим человеческому организму в небольших количествах (щитовидная железа)
- 23. Слайд 23
- 24. Слайд 24
- 25. Слайд 25
- 26. 1.Взаимодействие с металламиХимические свойства галогенов2 Na0 +
- 27. Cu0 + I20 = Cu I22Fe0 +
- 28. 2.Взаимодействие с водородомН20 + Г20 = 2Н
- 29. 3.Взаимодействие с водойCI2 + H2O =
- 30. 4.Взаимодействие с растворами солейгалогенов:CI2F2Br2I2CI2 + 2NaBr =
- 31. Получение В лаборатории*МnO2 + 4HCI = MnCI2
- 32. В промышленностиПолучают электролизом расплавов или растворов их солей.2NaCl электролиз 2Na+Cl2 Расплав
- 33. Дезинфицирующие реагенты на основе хлора Применение галогенов
- 34. Применение галогенов
Слайд 4Общая характеристика галогенов
Галогены – это естественная группа элементов , расположенных в
Фтор (F), хлор(Cl), бром (Br), йод (I), астат (At)
Галогены имеют степень окисления +1,+3,+5,+7, -1
У фтора только -1
В природе наиболее распространён- хлор. Астат получен искусственным путём.
Слайд 5
+9
+53
+35
+17
Неметаллические-окислительные свойства ослабевают,
металлические -восстановительные усиливаются !!!
2 7
2
2 8 18 7
2 8 18 18 7
F
CI
Br
I
1) Увеличиваются заряды атомных ядер
2) Увеличивается число энергетических уровней
3) Увеличивается радиус атома,сродство к электрону уменьшается
4) Число электронов на внешнем уровне постоянно
Строение атомов
Слайд 6Общие свойства галогенов:
Резкий запах
Взаимодействуют с Н2
Небольшая растворимость в Н2О
Большая летучесть
Высокая электроотрицательность
Высокая
Все галогены – токсичные вещ-ва!!!
Слайд 12ФТОР
Повышает устойчивость зубов к кариесу,
Стимулирует кроветворение,
Репаративные процессы при переломах костей,
Реакции иммунитета,
Участвует в росте скелета,
Предупреждает развитие старческого остеопороза.
Слайд 13Потребность во фторе взрослого человека - 2-3 мг/сут. Накапливается в костной
!!!При недостатке фтора развивается кариес!!!
Слайд 15
Жидкий хлор вызывает серьезные ожоги кожи.
Газообразный хлор оказывает сильное
Слайд 16Советуем: прежде, чем пить воду
из-под крана, обязательно пропустите
её через фильтры, а
Прокипятите!
Слайд 17БРОМ
NaBr и KBr – одни из лучших средств против бессонницы и
LiBr - предотвращает коррозию в холодильных установках, обезвоживает минеральные масла, помогает кондиционировать воздух.
NaBr добавляют в дубильные растворы
Потребность в Br 2 у органов практически всех живых существ! В особенности, в этом вещ-ве нуждается человеческий мозг
Слайд 19ЙОД
Антисептическое средство
I2 играет огромную роль в человеческом организме!!!
Нехватка в организме йода
Слайд 22АСТАТ
Очень радиоактивен!!!
Необходим человеческому организму в небольших количествах (щитовидная железа)
Слайд 261.Взаимодействие с металлами
Химические свойства галогенов
2 Na0 + CI20 = 2 NaCI
+1
CI20 окислитель
Получаются соли: фториды,хлориды,бромиды,иодиды.
Слайд 282.Взаимодействие с водородом
Н20 + Г20 = 2Н Г
+1 -1
Н20 +
+1 -1
Н20 + F20 = 2Н F + Q
Н20 + Br20 = 2НBr
Н20 + I20 = 2Н I - Q
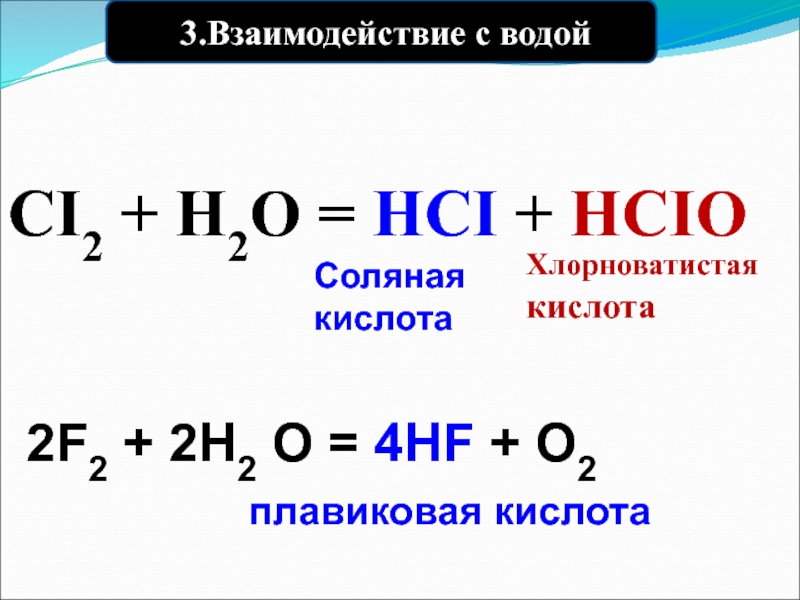
Слайд 29 3.Взаимодействие с водой
CI2 + H2O = HCI + HCIO
Хлорноватистая кислота
Соляная кислота
2F2 + 2Н2 О = 4НF + О2
плавиковая кислота
Слайд 304.Взаимодействие с растворами солей
галогенов:
CI2
F2
Br2
I2
CI2 + 2NaBr = 2 NaBr + Br2
CI2
Br2 + 2NaI = 2 NaBr + I2
Слайд 31Получение
В лаборатории*
МnO2 + 4HCI = MnCI2 + CI2 + 2H2O
Mn+4 + 2e → Mn+2 окислитель
восстанавливается
(О.В.)
2CI-1 – 2e → CI20 восстановитель,
окисляется
(В.О.)
Слайд 32 В промышленности
Получают электролизом расплавов или растворов их солей.
2NaCl
Расплав