нас природы, оно – основа культуры и промышленности, оно – орудие войны и мирного труда. И трудно во всей таблице Менделеева найти другой элемент, который был бы так связан с прошлым, настоящим и будущими судьбами человечества.
А. Е. Ферсман.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Железо (9 класс)
Содержание
- 1. Презентация по химии на тему Железо (9 класс)
- 2. Охарактеризуйте Fe как химический элемент Порядковый номер,
- 3. Слайд 3
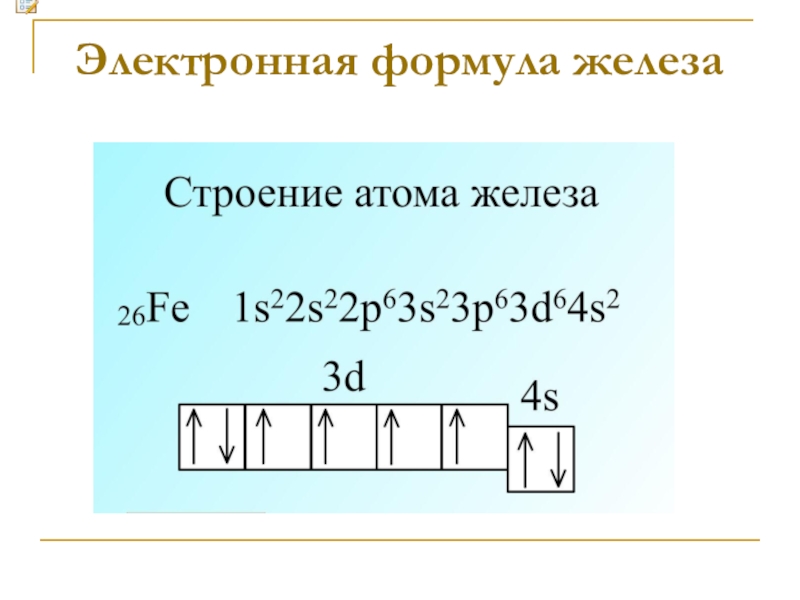
- 4. Электронная формула железа
- 5. Fe2O3 FeCl3FeCl2Fe(OH)2Fe(OH)3 K4[Fe(CN)6]K3[Fe(CN)6]FeOFe
- 6. Fe2O3 FeCl3FeCl2Fe(OH)2Fe(OH)3 K4[Fe(CN)6]K3[Fe(CN)6]FeOFe
- 7. Тема урока: Генетические ряды Fe2+ и Fе3+. Качественные реакции на Fе2+ и Fе3+
- 8. Цели: совершенствовать свои знания в умении
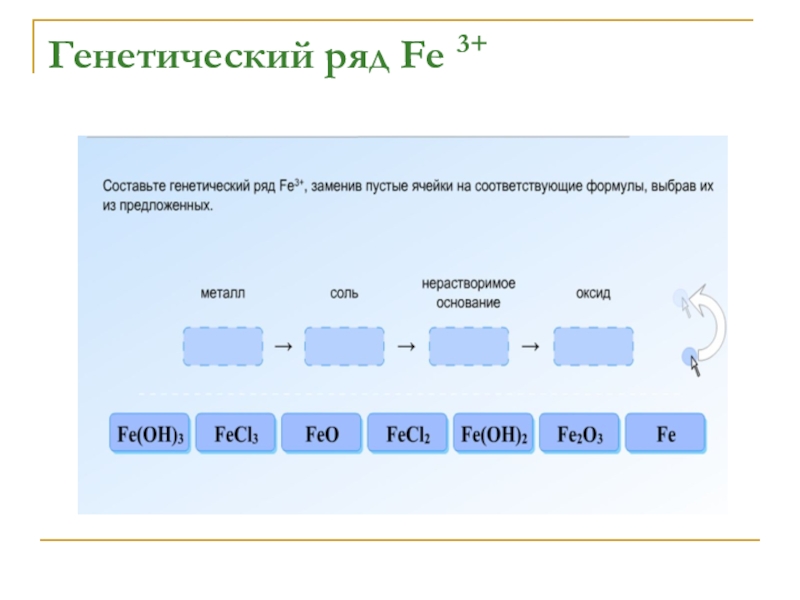
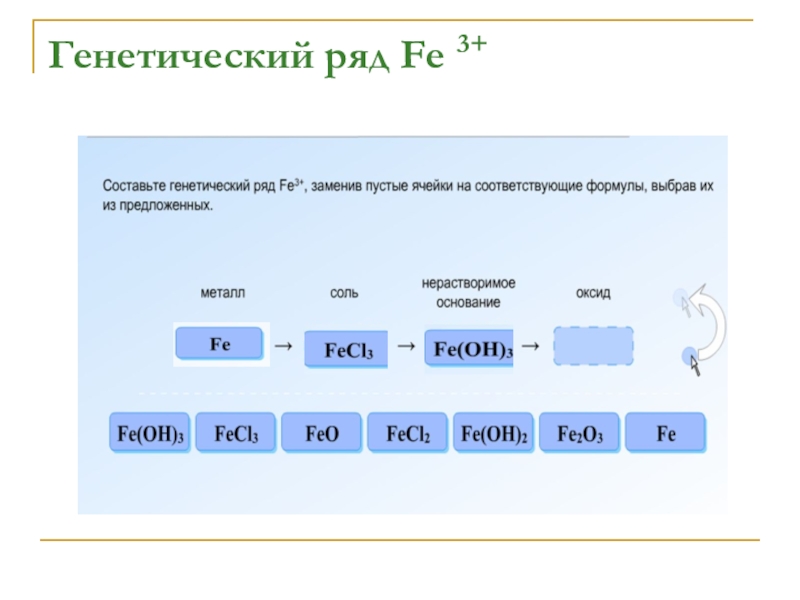
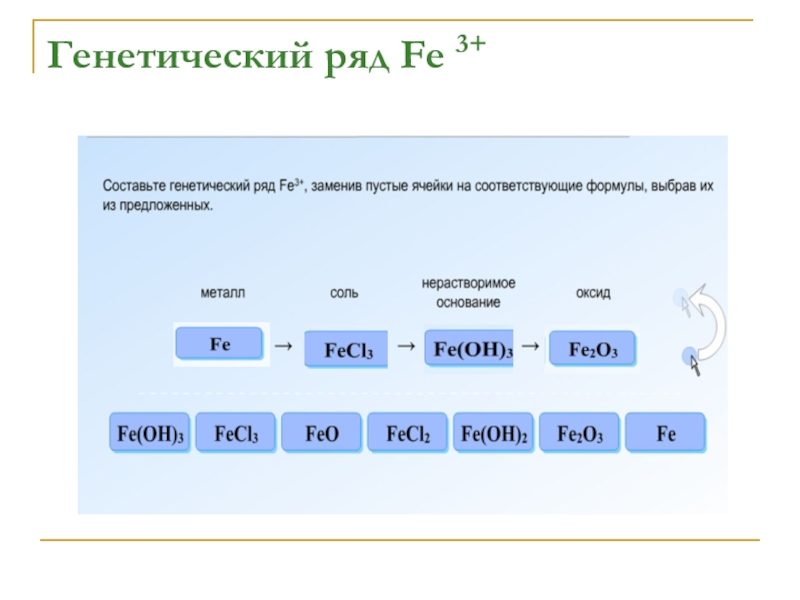
- 9. Генетический ряд Fe 3+
- 10. Генетический ряд Fe 3+
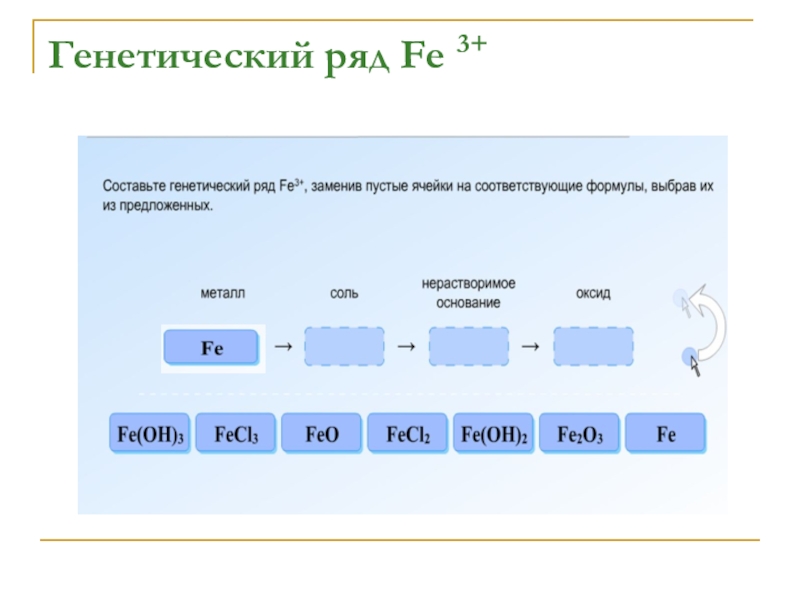
- 11. Генетический ряд Fe 3+
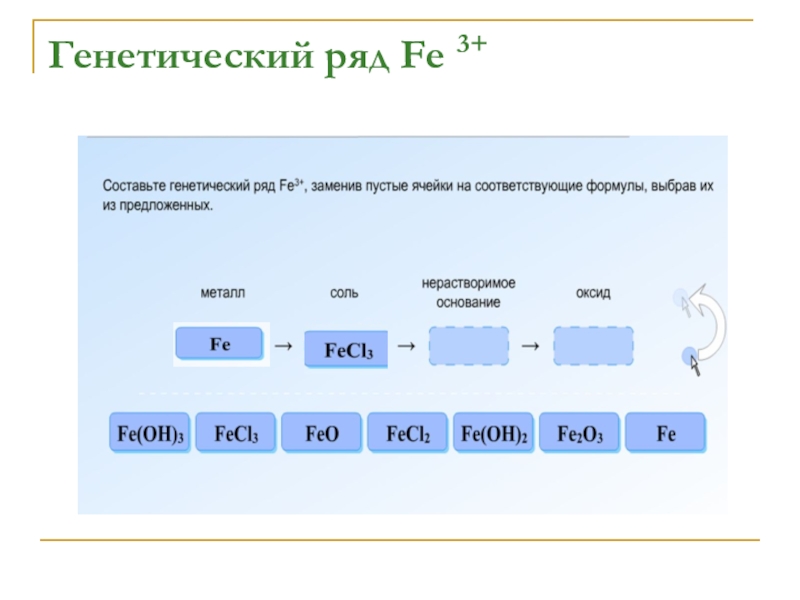
- 12. Генетический ряд Fe 3+
- 13. Генетический ряд Fe 3+
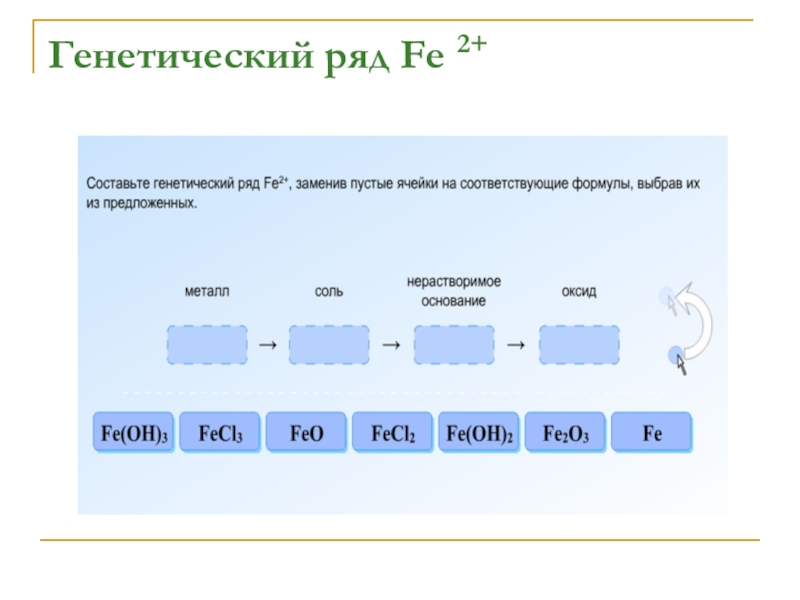
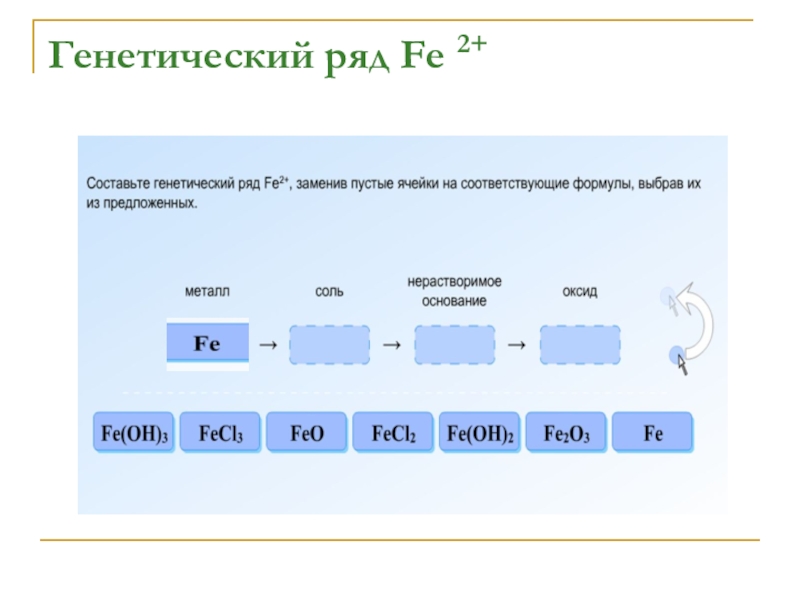
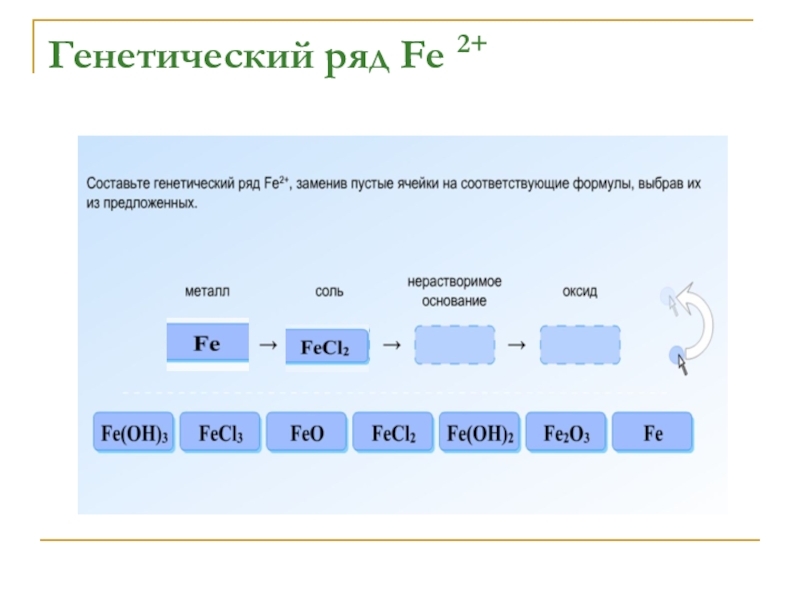
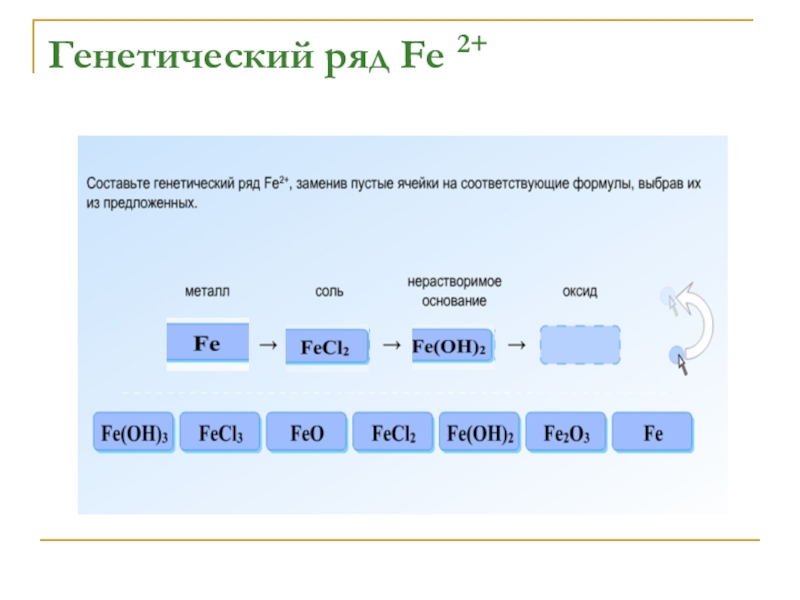
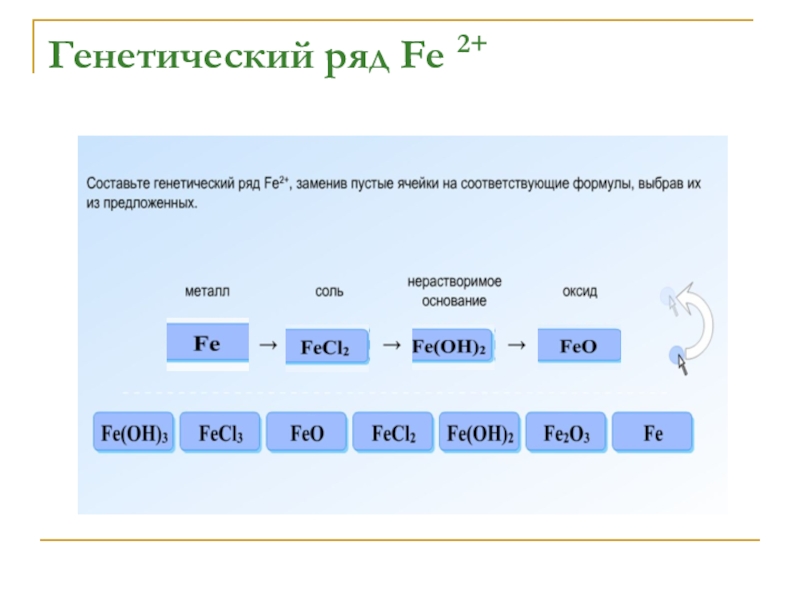
- 14. Генетический ряд Fe 2+
- 15. Генетический ряд Fe 2+
- 16. Генетический ряд Fe 2+
- 17. Генетический ряд Fe 2+
- 18. Генетический ряд Fe 2+
- 19. Осуществить превращения:Fe → FeCl2 → Fe(OH)2→ FeO
- 20. Осуществить превращения:Fe → FeCl3 → Fe(OH)3 → Fe2O3
- 21. Лабораторная работа I группа – I рядВ
- 22. Лабораторная работа II группа – II рядВ
- 23. Лабораторная работаIII группа – III рядЭкспериментально определить
- 24. K3[Fe(CN)6] Красная кровяная сольГексацианоферрат (III) калия -
- 25. K4[Fe(CN)6] Желтая кровяная сольГексацианоферрат (II) калия
- 26. Написать уравнения диссоциации а) желтой кровяной
- 27. Написать уравнения качественных реакций на ионы Fе2+ и Fе3+
- 28. Написать уравнения качественных реакций на ионы Fе2+ и Fе3+
- 29. FeCl2FeСl3Fe(OH)2Fe(OH)3Fe K4[Fe(CN)6]K3[Fe(CN)6]FeO Fe2O3
- 30. Домашнее заданиеПараграф 14, упражнение 6Подготовить сообщение-презентацию (на
Охарактеризуйте Fe как химический элемент Порядковый номер, номер периода , группа, подгруппа Порядковый № 26, 4 период , VIII группа, побочная подгруппаЗаряд ядра, распределение электронов по уровнямЗаряд ядра +26, распределение é: 2, 8, 14, 2Степени окисления+2,
Слайд 2Охарактеризуйте Fe как химический элемент
Порядковый номер, номер периода , группа,
подгруппа
Порядковый № 26, 4 период , VIII группа, побочная подгруппа
Заряд ядра, распределение электронов по уровням
Заряд ядра +26, распределение é: 2, 8, 14, 2
Степени окисления
+2, + 3
Порядковый № 26, 4 период , VIII группа, побочная подгруппа
Заряд ядра, распределение электронов по уровням
Заряд ядра +26, распределение é: 2, 8, 14, 2
Степени окисления
+2, + 3
Слайд 8Цели: совершенствовать свои знания в умении составлять уравнения реакций с участием
всех классов неорганических веществ;
экспериментально изучить качественные реакции на Fе2+ и Fе3+
Слайд 21Лабораторная работа
I группа – I ряд
В трех пронумерованных пробирках выданы растворы
солей:
NaCl
FeCl2
BaCl2
Определить, в какой пробирке находится соль железа (II), выбрав для этого подходящий реактив из предложенных
Заполнить таблицу
Сформулировать вывод. Как определить соли железа (II)?
NaCl
FeCl2
BaCl2
Определить, в какой пробирке находится соль железа (II), выбрав для этого подходящий реактив из предложенных
Заполнить таблицу
Сформулировать вывод. Как определить соли железа (II)?
Слайд 22Лабораторная работа
II группа – II ряд
В трех пронумерованных пробирках выданы растворы
солей:
NaCl
FeCl3
BaCl2
Определить, в какой пробирке находится соль железа (III), выбрав для этого подходящий реактив из предложенных
Заполнить таблицу
Сформулировать вывод. Как определить соли железа (III)?
NaCl
FeCl3
BaCl2
Определить, в какой пробирке находится соль железа (III), выбрав для этого подходящий реактив из предложенных
Заполнить таблицу
Сформулировать вывод. Как определить соли железа (III)?
Слайд 23Лабораторная работа
III группа – III ряд
Экспериментально определить реактивы для распознавания солей
железа (II) и железа (III)
Заполнить таблицу
Сформулировать выводы
Заполнить таблицу
Сформулировать выводы
Слайд 26Написать уравнения диссоциации
а) желтой кровяной соли:
K4[Fe(CN)6] =
Б) красной кровяной соли:
K3[Fe(CN)6] =
Слайд 27Написать уравнения качественных реакций на ионы Fе2+ и Fе3+
А) Fe SO4 +K3[Fe(CN)6]=
Б) FeCl3
+ K4[Fe(CN)6] =
Слайд 28Написать уравнения качественных реакций на ионы Fе2+ и Fе3+
К3[Fe(CN)6 ] + Fe SO4 = KFe[Fe(CN)6])↓
+
красная кровяная соль турнбуллева синь
+K2SO4
К4[Fe(CN)6 ] + FeCl3 = KFe[Fe(CN)6])↓ + 3KCl
берлинская лазурь
красная кровяная соль турнбуллева синь
+K2SO4
К4[Fe(CN)6 ] + FeCl3 = KFe[Fe(CN)6])↓ + 3KCl
берлинская лазурь
Слайд 30Домашнее задание
Параграф 14,
упражнение 6
Подготовить сообщение-презентацию (на выбор):
1. «Роль химического элемента
железа в современной технике»
2. «Роль химического элемента железа в жизнедеятельности живых организмов»



![Презентация по химии на тему Железо (9 класс) Fe2O3 FeCl3FeCl2Fe(OH)2Fe(OH)3 K4[Fe(CN)6]K3[Fe(CN)6]FeOFe Fe2O3 FeCl3FeCl2Fe(OH)2Fe(OH)3 K4[Fe(CN)6]K3[Fe(CN)6]FeOFe](/img/thumbs/36dfb7bb9ddac3d238f8d7b2475311b3-800x.jpg)
![Презентация по химии на тему Железо (9 класс) Fe2O3 FeCl3FeCl2Fe(OH)2Fe(OH)3 K4[Fe(CN)6]K3[Fe(CN)6]FeOFe Fe2O3 FeCl3FeCl2Fe(OH)2Fe(OH)3 K4[Fe(CN)6]K3[Fe(CN)6]FeOFe](/img/thumbs/079633a0c725ab5dcfae12e48f802afe-800x.jpg)







![Презентация по химии на тему Железо (9 класс) K3[Fe(CN)6] Красная кровяная сольГексацианоферрат (III) калия - K3[Fe(CN)6] Красная кровяная сольГексацианоферрат (III) калия -](/img/thumbs/d81baf21b4fa7cc6c15ba52f9a349031-800x.jpg)
![Презентация по химии на тему Железо (9 класс) K4[Fe(CN)6] Желтая кровяная сольГексацианоферрат (II) калия K4[Fe(CN)6] Желтая кровяная сольГексацианоферрат (II) калия](/img/thumbs/d8d4d0b95dcad570c7c2bd445dab5951-800x.jpg)
![Презентация по химии на тему Железо (9 класс) Написать уравнения диссоциации а) желтой кровяной соли:K4[Fe(CN)6] = Написать уравнения диссоциации а) желтой кровяной соли:K4[Fe(CN)6] =](/img/thumbs/ac4174f9aaa95376e29b32566ba40df4-800x.jpg)
![Презентация по химии на тему Железо (9 класс) Написать уравнения качественных реакций на ионы Fе2+ и Fе3+ А) Fe SO4 +K3[Fe(CN)6]=Б) Написать уравнения качественных реакций на ионы Fе2+ и Fе3+ А) Fe SO4 +K3[Fe(CN)6]=Б) FeCl3 + K4[Fe(CN)6] =](/img/thumbs/36d8a1259de9ea4a57e82ca51ab88ec9-800x.jpg)
![Презентация по химии на тему Железо (9 класс) Написать уравнения качественных реакций на ионы Fе2+ и Fе3+ К3[Fe(CN)6 ] + Fe Написать уравнения качественных реакций на ионы Fе2+ и Fе3+ К3[Fe(CN)6 ] + Fe SO4 = KFe[Fe(CN)6])↓ + красная кровяная](/img/thumbs/2b1d0ec5b435d4dccb9dcd5aad024925-800x.jpg)
![Презентация по химии на тему Железо (9 класс) FeCl2FeСl3Fe(OH)2Fe(OH)3Fe K4[Fe(CN)6]K3[Fe(CN)6]FeO Fe2O3 FeCl2FeСl3Fe(OH)2Fe(OH)3Fe K4[Fe(CN)6]K3[Fe(CN)6]FeO Fe2O3](/img/thumbs/a148c2dee131475a2b576ac9b9748adf-800x.jpg)






