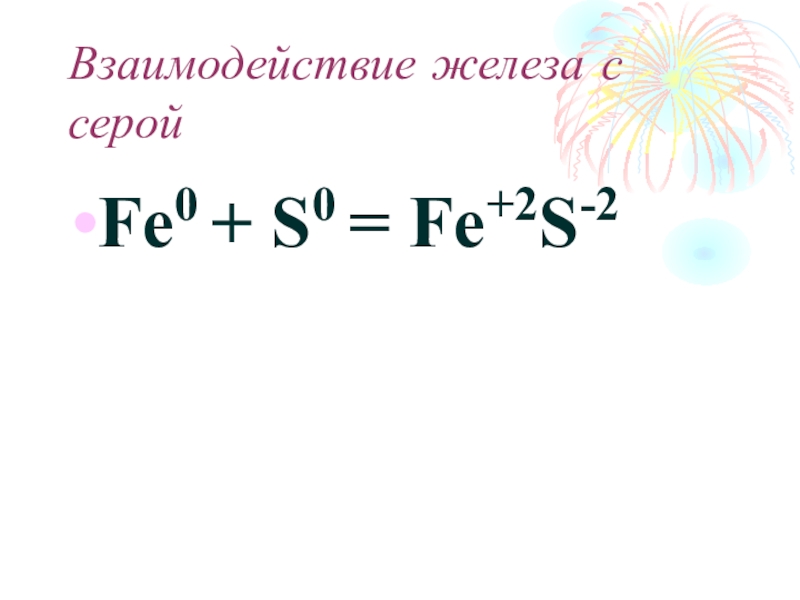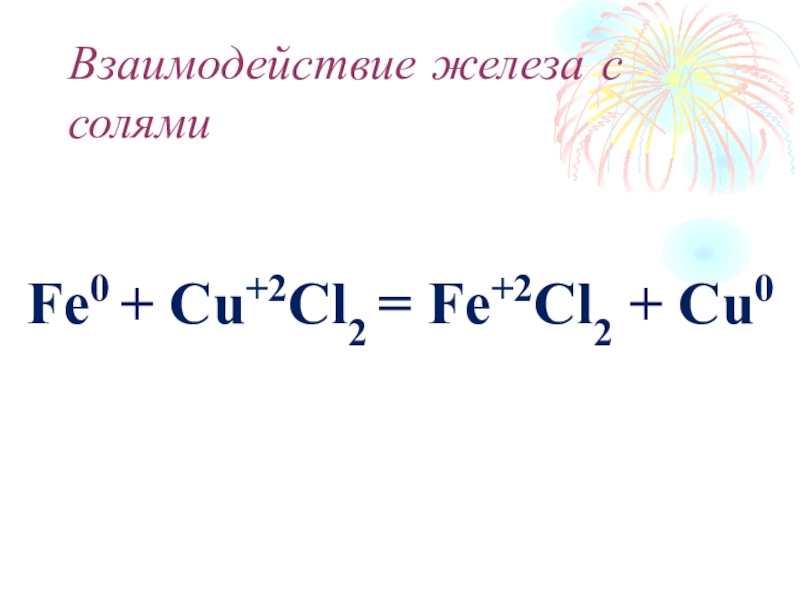Калтанского СУВУ Снежинская И.Р.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Железо, его физические и химические свойства
Содержание
- 1. Презентация по химии на тему Железо, его физические и химические свойства
- 2. «Чтобы познать, надо научиться наблюдать».Эпиграф к уроку:
- 3. Железо, его физические и химические свойстваУчите
- 4. Почему из такого количества металлов побочных подгрупп
- 5. Слайд 5
- 6. Слайд 6
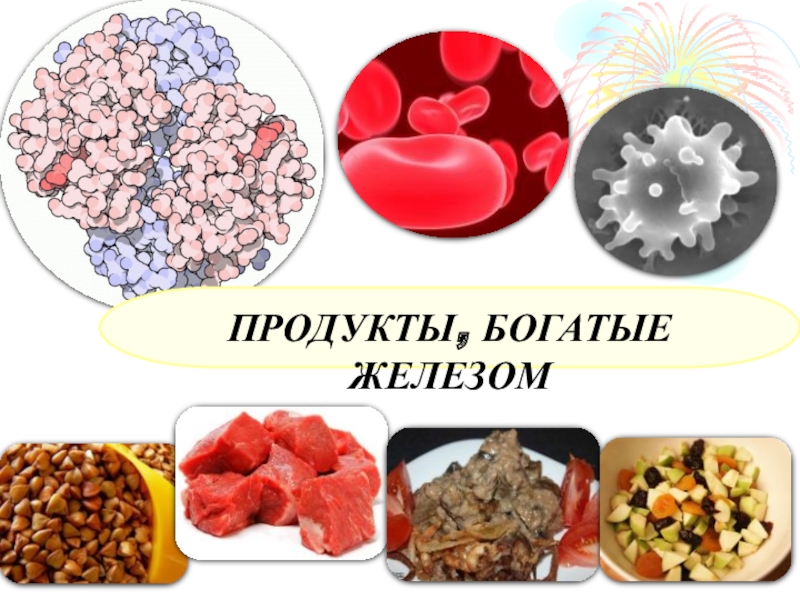
- 7. ПРОДУКТЫ, БОГАТЫЕ ЖЕЛЕЗОМ
- 8. История получения железа
- 9. Зависимость свойств от строенияСтроение атомаСтроениепростоговеществаСвойствавеществаКристаллическая решеткаХимическаясвязь
- 10. Положение элемента – железа в периодической системе Д.И. МенделееваПорядковый номерПериодГруппаПодгруппа26ЧетвертыйVIIIПобочная
- 11. 1. Выписать схему строения атома железа
- 12. Проверка № 26
- 13. 1S2 2S22P6 3S23P63D6 4S2Валентные
- 14. 2. Расставить степени окисления элементов: FeCl2, Fe2O3, FeCl3, FeS, FeO.
- 15. Проверка: Fe+2Cl2-1 , Fe2+3O3-2 , Fe+3Cl3-1 , Fe+2S-2 , Fe+2O-2
- 16. Физические свойстваСеребристо-серыйКовкийТяжелый (плотность=7,8 г\см3 )Тугоплавкий (Т пл.=15350C)Обладает магнитными свойствами
- 17. Химические свойства металлаМеталлОтношение к простымвеществамОтношение к сложнымвеществамК неметалламК водеК кислотамК растворамсолей
- 18. Взаимодействие железа с серой
- 19. Взаимодействие железа с серойFe0 + S0 = Fe+2S-2
- 20. Взаимодействие железа с кислородом
- 21. Взаимодействие железа с кислородом3Fe0 + 2O20= Fe+2O-2 + Fe2+3O3-2 (Fe3O4)
- 22. Взаимодействие железа со сложными веществамиВзаимодействие с водой3Fe0
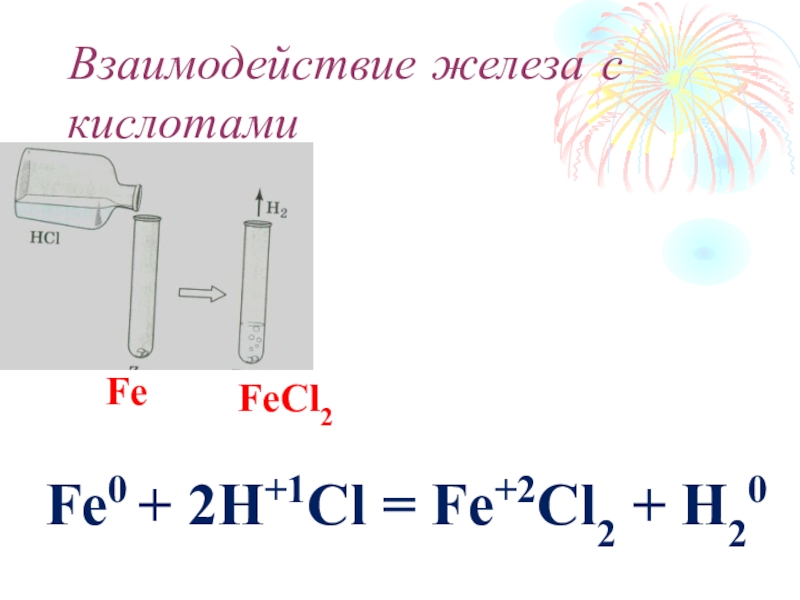
- 23. Взаимодействие железа с кислотамиFe0 + 2H+1Cl = Fe+2Cl2 + H20FeFeCl2
- 24. Взаимодействие железа с солямиFe0 + Cu+2Cl2 = Fe+2Cl2 + Cu0
- 25. Тест- тренажер1.У этого металла последние электроны заполняют
«Чтобы познать, надо научиться наблюдать».Эпиграф к уроку:
Слайд 4Почему из такого количества металлов побочных подгрупп для изучения выбрали один-
именно железо ?
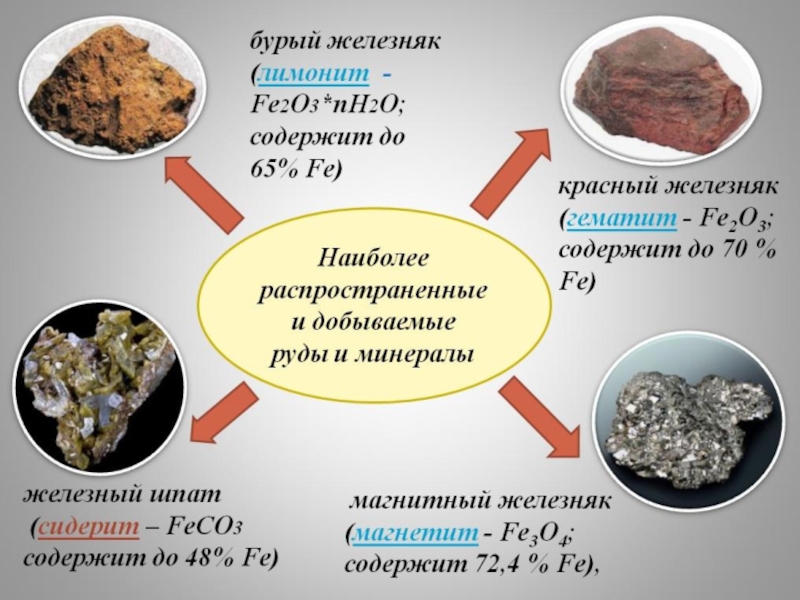
Наиболее широко используется в современной промышленности.
Велика его распространенность в природе.
Важен с биологической точки зрения.
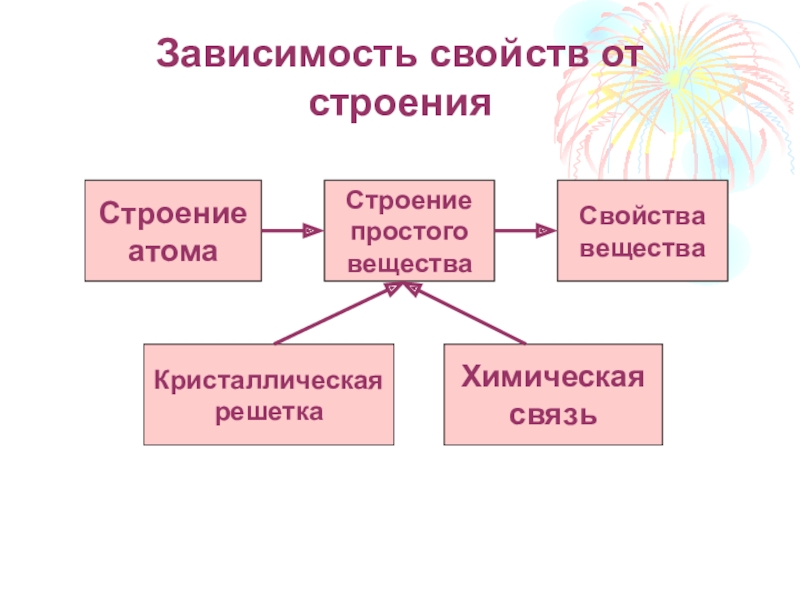
Слайд 9Зависимость свойств от строения
Строение
атома
Строение
простого
вещества
Свойства
вещества
Кристаллическая
решетка
Химическая
связь
Слайд 10Положение элемента – железа в периодической системе Д.И. Менделеева
Порядковый номер
Период
Группа
Подгруппа
26
Четвертый
VIII
Побочная
Слайд 131S2 2S22P6 3S23P63D6 4S2
Валентные
электроны
Запомни!
Особенностью электронного строения элементов
побочных подгрупп является заполнение электронами не последнего, а предпоследнего уровня.
Слайд 16Физические свойства
Серебристо-серый
Ковкий
Тяжелый (плотность=7,8 г\см3 )
Тугоплавкий (Т пл.=15350C)
Обладает магнитными свойствами
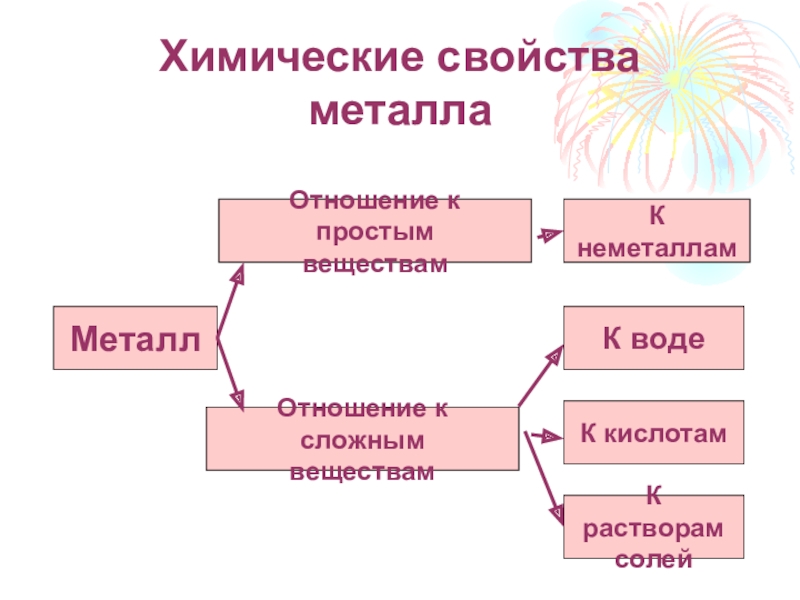
Слайд 17Химические свойства металла
Металл
Отношение к простым
веществам
Отношение к сложным
веществам
К неметаллам
К воде
К кислотам
К растворам
солей
Слайд 22Взаимодействие железа со сложными веществами
Взаимодействие с водой
3Fe0 + 4H2O = Fe3O4
+ H20
( Fe+2O-2 + Fe2+3O3-2 )
( Fe+2O-2 + Fe2+3O3-2 )
Слайд 25Тест- тренажер
1.У этого металла последние электроны заполняют не внешний, а предвнешний
энергетический уровень.
2.Этот металл относится к S-элементам.
3. На внешнем энергетическом уровне этого металла 2 электрона.
4. Для этого металла характерна постоянная степень окисления.
5. Это один из самых легких и мягких металлов.
6. Этот металл проявляет восстановительные свойства в реакциях.
7. Этот металл не взаимодействует с растворами солей.
8. При взаимодействии с серой этот металл приобретает степень окисления +2.
9. Этот металл вытесняет водород из соляной и разбавленной серной кислоты.
10. Этот металл относится к d-элементам.
11. Этот металл образует металлическую кристаллическую решетку и металлическую связь.
12. На внешнем энергетическом уровне у атома этого металла 3 электрона.
13. Для этого металла характерна переменная степень окисления.
14. Этот металл обладает сильными магнитными свойствами.
15. Этот металл при взаимодействии с кислородом образует смесь оксидов МеО и Ме2О3
16. При взаимодействии с хлором этот металл приобретает степень окисления +3
17. Этот металл не взаимодействует с концентрированной серной и азотной кислотами при нормальных условиях.
18. Это серебристо- серый металл, ковкий и пластичный, с температурой плавления 15390С.
.
2.Этот металл относится к S-элементам.
3. На внешнем энергетическом уровне этого металла 2 электрона.
4. Для этого металла характерна постоянная степень окисления.
5. Это один из самых легких и мягких металлов.
6. Этот металл проявляет восстановительные свойства в реакциях.
7. Этот металл не взаимодействует с растворами солей.
8. При взаимодействии с серой этот металл приобретает степень окисления +2.
9. Этот металл вытесняет водород из соляной и разбавленной серной кислоты.
10. Этот металл относится к d-элементам.
11. Этот металл образует металлическую кристаллическую решетку и металлическую связь.
12. На внешнем энергетическом уровне у атома этого металла 3 электрона.
13. Для этого металла характерна переменная степень окисления.
14. Этот металл обладает сильными магнитными свойствами.
15. Этот металл при взаимодействии с кислородом образует смесь оксидов МеО и Ме2О3
16. При взаимодействии с хлором этот металл приобретает степень окисления +3
17. Этот металл не взаимодействует с концентрированной серной и азотной кислотами при нормальных условиях.
18. Это серебристо- серый металл, ковкий и пластичный, с температурой плавления 15390С.
.