- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Железо и его соли
Содержание
- 1. Презентация по химии на тему Железо и его соли
- 2. Как химический элемент Химический элемент VIII гр.
- 3. Железо — активный металл. На воздухе образуется
- 4. 3. Взаимодействие с простыми веществами:3.1 Горит в
- 5. 4.Железо вытесняет из растворов солей металлы, находящиеся
- 6. 6. Окисление железаПри хранении водных растворов солей
- 7. Железо - сравнительно мягкий ковкий серебристо-серый металл.Температура
- 8. В земной коре железо распространено достаточно широко.
- 9. магнитный железняк (магнетит - Fe3O4; содержит
- 10. Соли железаРеагируют с щелочами:FeCl2 + 2NaOH →
- 11. КАЧЕСТВЕННАЯ РЕАКЦИЯ НА Соли железа (+2) и
Слайд 2Как химический элемент
Химический элемент VIII гр. Периодической системы Д.И. Менделеева.
Атомный номер 26,
Aтомная масса 55.847.
Слайд 3Железо — активный металл. На воздухе образуется защитная оксидная пленка, препятствующая ржавению
3Fe + 2O2 = Fe2O3 • FeO (Феррит железа)
2. Во влажном воздухе железо окисляется и покрывается ржавчиной, которая частично состоит из гидратированного оксида железа (III).
4Fe + 3О2 + 6Н2О = 4Fe(ОН)3
Химические свойства
Слайд 43. Взаимодействие с простыми веществами:
3.1 Горит в кислороде
3Fe +
3.2 Реагирует с хлором
2Fe + 3Cl2 = 2FeCl3
3.3 Взаимодействует с серой
Fe + S = FeS
Химические свойства
Слайд 54.Железо вытесняет из растворов солей металлы, находящиеся в электрохимическом ряду напряжений
5. При высокой температуре (700-900°С) железо реагирует с парами воды:
3Fe+4Н2O=Fe3O4+4Н2
Химические свойства
Слайд 66. Окисление железа
При хранении водных растворов солей железа(II) наблюдается окисление железа(II)
4FeCl2 + O2 + 2H2O = 4Fe(OH)Cl2
7.Соединения железа (III) в растворах восстанавливаются металлическим железом:
Fe + 2FeCl 3 = 3FeCl2
Химические свойства
Слайд 7Железо - сравнительно мягкий ковкий серебристо-серый металл.
Температура плавления – 1535 0С
Температура
При температуре ниже 7700С железо обладает ферромагнитными свойствами
(оно легко намагничивается, и из него можно изготовить магнит).
Выше этой температуры
ферромагнитные свойства
железа исчезают,
железо «размагничивается».
Физические свойства
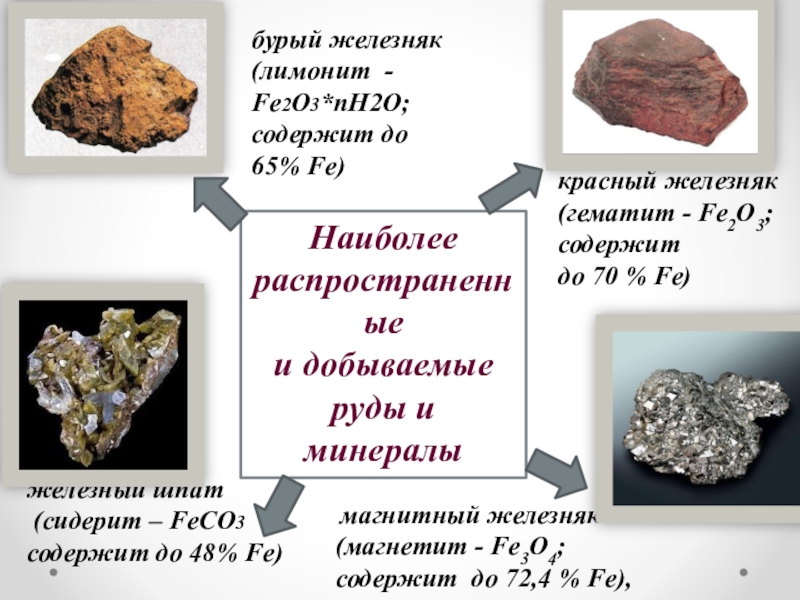
Слайд 8В земной коре железо распространено достаточно широко.
В морской воде 1·10–5
На его долю приходится: Около 4,1% массы земной коры (4-е место среди всех элементов, 2-е среди металлов). Известно большое число руд и минералов, содержащих железо. По запасам железных руд Россия занимает первое место в мире.
Нахождение в природе
Слайд 9
магнитный железняк
(магнетит - Fe3O4;
содержит до 72,4 % Fe),
бурый
Fe2О3*пН2О;
содержит до 65% Fe)
красный железняк (гематит - Fe2O3; содержит
до 70 % Fe)
железный шпат
(сидерит – FeCO3
содержит до 48% Fe)
Наиболее
распространенные
и добываемые
руды и минералы
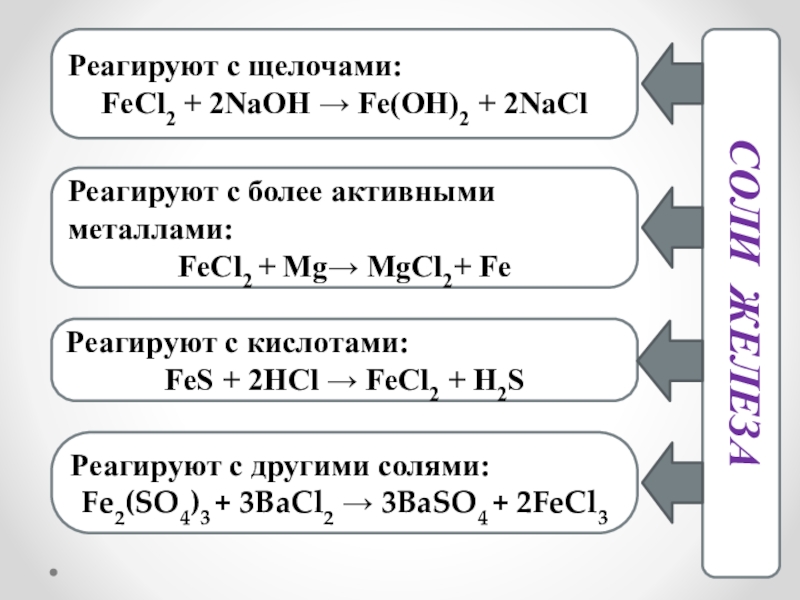
Слайд 10Соли железа
Реагируют с щелочами:
FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl
Реагируют с
FeCl2 + Mg→ MgCl2+ Fe
Реагируют с кислотами:
FeS + 2HCl → FeCl2 + H2S
Реагируют с другими солями:
Fe2(SO4)3 + 3BaCl2 → 3BaSO4 + 2FeCl3
Слайд 11КАЧЕСТВЕННАЯ РЕАКЦИЯ НА Соли железа (+2) и (+3)
Реакция со щелочью
FeCl2
Fe2++2Cl-+2Na++ 2OH-→Fe(OH)2+2Na++ 2OH-
Fe2+ + 2OH- →Fe(OH)2
FeCl3+3KOH→Fe(OH)3+3KCl
Fe3+ +3Cl- +3K+ +3OH-→Fe(OH)3 +3K+ +3OH-
Fe3+ +3OH- → Fe(OH)3