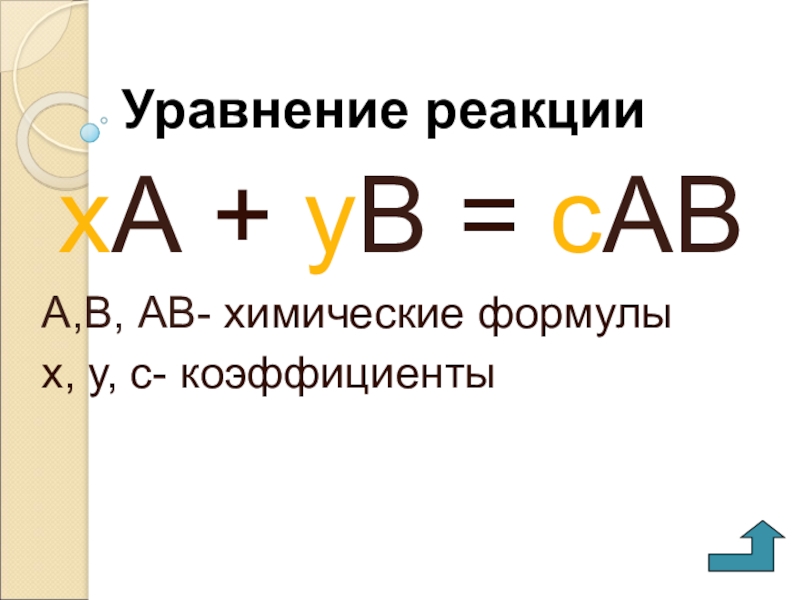- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Закон постоянства состава вещества. Закон сохранения массы веществ
Содержание
- 1. Презентация по химии на тему Закон постоянства состава вещества. Закон сохранения массы веществ
- 2. Закон постоянства состава
- 3. Например, вода может быть получена в
- 4. Ясно, что молекула полученной различными способами воды
- 5. Слайд 5
- 6. Ar (Fe) = 56Ar (S) = 32Ar
- 7. Задача №1Сколько граммов железа нужно взять, чтобы прореагировало 2 г серы?
- 8. Закон сохранения массы веществ
- 9. 1748 г. М.В. Ломоносов«Суть всех перемен в
- 10. Современная формулировкаМасса веществ, вступивших в реакцию, равна
- 11. Уравнение реакциихА + уВ = сАВА,В, АВ- химические формулых, у, с- коэффициенты
- 12. Составление уравнения реакции1. В левой части уравнения
- 13. Составление уравнения реакции2. Определить число атомов каждого элемента в левой и правой частях схемы реакции
- 14. Составление уравнения реакции3. Среди элементов с разным числом
- 15. Составление уравнения реакции4. Найти наименьшее общее кратное (НОК)
- 16. Составление уравнения реакции5. Разделить НОК на число атомов
- 17. Составление уравнения реакции6. Разделить НОК на число атомов
- 18. Составление уравнения реакции7. Необходимо подсчитать число атомов других
- 19. Самостоятельная работа1 . Найдите и исправьте ошибки.Al
- 20. Проверь себя 1.)
- 21. Домашнее задание§ 11, 14, 15Упр. 5, 6 стр. 48.
Закон постоянства состава Был открыт французским химиком Прустом: всякое чистое вещество (химическое соединение), каким бы путем оно ни было получено,
Слайд 2Закон постоянства состава
Был открыт французским
химиком Прустом:
всякое чистое вещество (химическое соединение), каким бы путем оно ни было получено, имеет строго определенный и постоянный состав (качественный и количественный).
всякое чистое вещество (химическое соединение), каким бы путем оно ни было получено, имеет строго определенный и постоянный состав (качественный и количественный).
Слайд 3
Например, вода может быть получена в результате следующих химических реакций:
Cu(OH)
2 = H2O + CuO
2Н2 + O2 = 2Н2O
Са(ОН)2 + H2SO4 = CaSO4 + 2Н2O
2Н2 + O2 = 2Н2O
Са(ОН)2 + H2SO4 = CaSO4 + 2Н2O
Слайд 4
Ясно, что молекула полученной различными способами воды всегда состоит из двух
атомов водорода и одного атома кислорода. Этот закон строго выполняется только для веществ молекулярного строения.
Слайд 5
Назовите это вещество.
Из каких атомов
состоит это вещество?
Найдите атомные
массы серы и железа.
Из каких атомов
состоит это вещество?
Найдите атомные
массы серы и железа.
FeS
На основе закона постоянства состава можно производить различные расчеты
Слайд 6Ar (Fe) = 56
Ar (S) = 32
Ar (Fe) : Ar(S)
= 56 : 32 = 7 : 4
Чтобы получить
сульфид железа
надо смешать
и серу в массовых соотношениях 7 : 4.
Если железа взять 10 г,а серы 4 г, химическая реакция произойдет, но 3 г железа в реакцию не вступят.
Чтобы получить
сульфид железа
надо смешать
и серу в массовых соотношениях 7 : 4.
Если железа взять 10 г,а серы 4 г, химическая реакция произойдет, но 3 г железа в реакцию не вступят.
Слайд 91748 г. М.В. Ломоносов
«Суть всех перемен в природе такова: сколько убавится
у одного тела, столько прибавится к другому, т.е.на сколько уменьшится материя в одном месте, на столько прибавится в другом месте»
Слайд 10Современная формулировка
Масса веществ, вступивших в реакцию, равна массе веществ, образующихся в
результате реакции
Данный закон позднее (1789 г.) подтвердил французский химик А. Лавуазье
Данный закон позднее (1789 г.) подтвердил французский химик А. Лавуазье
Слайд 12Составление уравнения реакции
1. В левой части уравнения записать исходные вещества, в
правой — продукты реакции (молекулы газов водорода, хлора, кислорода, азота состоят из двух атомов)
Слайд 13Составление уравнения реакции
2. Определить число атомов каждого элемента в левой и
правой частях схемы реакции
Слайд 14Составление уравнения реакции
3. Среди элементов с разным числом атомов до и после
реакции выбрать тот, число атомов которого больше
O — 2 атома слева O — 5 атомов справа
O — 2 атома слева O — 5 атомов справа
Слайд 15Составление уравнения реакции
4. Найти наименьшее общее кратное (НОК) числа атомов этого элемента
в левой части уравнения и числа атомов этого элемента в правой части уравнения
НОК — 10
НОК — 10
Слайд 16Составление уравнения реакции
5. Разделить НОК на число атомов этого элемента в левой
части уравнения, получив коэффициент для левой части уравнения
10 : 2 = 5 P + 5O2 P2O5
10 : 2 = 5 P + 5O2 P2O5
Слайд 17Составление уравнения реакции
6. Разделить НОК на число атомов этого элемента в правой
части уравнения, получив коэффициент для правой части уравнения
10 : 2 = 5 P + 5O2 2P2O5
10 : 2 = 5 P + 5O2 2P2O5
Слайд 18Составление уравнения реакции
7. Необходимо подсчитать число атомов других элементов в левой и
правой частях уравнения и с помощью коэффициентов уравнять их, т. е. число атомов каждого элемента в левой и правой частях уравнения должно быть одинаковым
4P + 5O2 = 2P2O5
4P + 5O2 = 2P2O5
Слайд 19Самостоятельная работа
1 . Найдите и исправьте ошибки.
Al + 3 H2SO4 ═
Al2(SO4)3 + H2↑
2. Расставьте коэффициенты в схеме химической реакции.
FeSO4 + KOH → Fe(OH)2 + K2SO4
2. Расставьте коэффициенты в схеме химической реакции.
FeSO4 + KOH → Fe(OH)2 + K2SO4
Слайд 20 Проверь себя
1.) М.В. Ломоносов открыл закон сохранения
массы веществ в:
А.1748 г. Б.1756 г. В.1673 г.
2).Установите правильную последовательность.
Закон сохранения массы веществ:
- массе веществ,
масса веществ
в результате ее
вступивших в реакцию,
получившихся
- равна
3). Условная запись химической реакции это -
А. химическая формула
Б. коэффициент
В. химическое уравнение
Г. индекс
А.1748 г. Б.1756 г. В.1673 г.
2).Установите правильную последовательность.
Закон сохранения массы веществ:
- массе веществ,
масса веществ
в результате ее
вступивших в реакцию,
получившихся
- равна
3). Условная запись химической реакции это -
А. химическая формула
Б. коэффициент
В. химическое уравнение
Г. индекс