- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Задачи по химии
Содержание
- 1. Презентация по химии на тему Задачи по химии
- 2. СодержаниеВведениеСправочный материалОсновные физические величины в химииОсновные уравнения
- 3. Введение При изучении химии вам необходимо научиться
- 4. 2. Буквенное обозначение3. Единицы измерения1. ОпределениеОтносительная молекулярная
- 5. 2. Буквенное обозначение3. Единицы измерения1. ОпределениеОтносительная молекулярная
- 6. 2. Буквенное обозначение3. Единицы измерения1. ОпределениеОтносительная молекулярная
- 7. 2. Буквенное обозначение3. Единицы измерения1. ОпределениеОтносительная молекулярная
- 8. 2. Буквенное обозначение3. Единицы измерения1. ОпределениеОтносительная молекулярная
- 9. 2. Буквенное обозначение3. Единицы измерения1. ОпределениеОтносительная молекулярная
- 10. 2. Буквенное обозначение3. Единицы измерения1. ОпределениеОбъемМассовая доля
- 11. 2. Буквенное обозначение3. Единицы измерения1. Определение- это
- 12. 2. Буквенное обозначение3. Единицы измерения1. Определение- это
- 13. 2. Буквенное обозначение3. Единицы измерения1. Определение- это
- 14. 2. Буквенное обозначение3. Единицы измерения1. Определение- это
- 15. 2. Буквенное обозначение3. Единицы измерения1. Определение- это
- 16. Величины расчетаУравнение связиМолярная массаМолярный объемОсновные уравнения связиКоличество в-ваМассовая доляМассовая доля эл-та
- 17. Величины расчетаУравнение связиОсновные уравнения связиn – количество
- 18. Величины расчетаУравнение связиОсновные уравнения связиM – молярная
- 19. Величины расчетаУравнение связиОсновные уравнения связиVm – молярный
- 20. Величины расчетаУравнение связиОсновные уравнения связиm(р-ра) = m(воды)
- 21. Величины расчетаУравнение связиОсновные уравнения связиω – массовая
- 22. Задания с выбором ответа (A15) Дано:Найти:Решение:Ответ:Определите массовую
- 23. Задания с выбором ответа(A15).Задача №1 Задача №2
- 24. Задача №1 Определите массовые доли элементов в
- 25. Задача №2 Массовая доля кислорода в сульфите
- 26. Задача №3 Массовая доля калия в сульфате
- 27. Задача №4 Массовая доля углерода в карбонате
- 28. Задача №5 Массовая доля азота в нитрате
- 29. Задача №6 Массовая доля водорода в гидроксиде
- 30. Задача №7 Массовая доля кислорода в аммиачной
- 31. Задача №8 Массовая доля воды в кристаллической
- 32. Задача №9 Массовая доля азота в аммофосе
- 33. Задача №10 Определите форму гипса, если известно,
- 34. Задания с развернутым ответом (С2). Тип 1.Дано:Найти:Решение:Ответ:SO3
- 35. Задания с развернутым ответом (С2). Тип 1.Задача
- 36. Задача №1 Список задачПри добавлении к раствору
- 37. Задача №2 Список задачК 100 г 5%-ного
- 38. Задача №3 Список задачПри пропускании 4,48 л.
- 39. Задача №4 Список задачПри добавлении к раствору
- 40. Задача №5 Список задачПри добавлении 6,3%-ного раствора
- 41. Задача №6 Список задачВычислите массу хлорида калия,
- 42. Задача №7 Список задачКакую массу раствора с
- 43. Задача №8 Список задачВычислите массу раствора серной
- 44. Задача №9 Список задачК 200 г раствора
- 45. Задания с развернутым ответом (С2). Тип 2.Дано:Найти:Решение:Ответ:BaCl2
- 46. Задания с развернутым ответом (С2). Тип 2.Задача
- 47. Задача №1 В 73 г. соляной кислоты
- 48. Задача №2 К раствору карбоната калия массой
- 49. Задача №3 Рассчитайте массу осадка, который выпадет
- 50. Задача №4 Определите объем (н.у.) углекислого газа,
- 51. Задача №5 В избытке соляной кислоты растворили
- 52. Задача №6Рассчитайте массу осадка, который выпадет при
- 53. Задача №7Вычислите массу хлорида калия, полученного при
- 54. Задача №8К 200 г. 12,25%-ного раствора серной
- 55. Задача №9Какой объем сероводорода (н.у) образуется при
- 56. Задача №10Какой объем (н.у.) оксида углерода (IV)
- 57. Задания с развернутым ответом (С2). Тип 3.Дано:Найти:Решение:Ответ:m(Fe2O3)
- 58. Задания с развернутым ответом (С2). Тип 3.Задача
- 59. Рассчитайте, сколько чистого оксида железа содержится в
- 60. При взаимодействии 10,79 г кальцинированной соды с
- 61. При растворении 226 г образца алюминия в
- 62. Из 30 г известняка под действием азотной
- 63. Рассчитайте объём кислорода, который потребуется для сжигания
- 64. Какой объем углекислого газа выделится (н.у.) при
- 65. Рассчитайте сколько чистого оксида железа содержится в
- 66. Вычислите объём аммиака, который можно получит при
- 67. Вычислите массу оксида магния, которая получается при
- 68. Справочный материалСелитры – это нитраты щелочных металлов,
- 69. Справочный материал Экви - значит «равное».
- 70. Справочный материал Кальцинированная сода (кристаллическая) -
- 71. Литература«ГИА-2013: Экзамен в новой форме. Химия. 9-й
Слайд 2Содержание
Введение
Справочный материал
Основные физические величины в химии
Основные уравнения связи
Задания с выбором ответа
Задания с развернутым ответом (С2)
1 тип: Если дано чистое вещество, надо найти концентрацию полученного раствора (при известной массе раствора) или массу раствора (при известной концентрации).
2 тип: Если известна масса раствора определенной концентрации, необходимо найти массу выпавшего осадка или выделившегося газа.
3 тип: Если известна масса смеси, в которой содержится определенный процент примесей, надо найти массу вещества, или массу выпавшего осадка, или объем выделившего газа.
Литература и интернет-ресурсы
Слайд 3Введение
При изучении химии вам необходимо научиться решать задачи. Решать задачи
Цель данного пособия – помочь вам выработать навыки решения разных химических задач. Этой цели и служит «помощник»: он подскажет нужные формулы и объяснит, как решать задачи. А подготовиться к успешной сдаче итоговой аттестации за курс основной школы вам помогут тестовые задания.
Сборник включается все типы расчетных задач, которые встречаются в материалах ГИА. В каждом разделе сборник вы найдете задачи разных типов. Также в пособии содержатся справочные материалы, необходимые для решения задач.
Надеемся, что сборник пригодится не только вам, но и вашим учителям, и даже вашим родителям.
Желаем удачи!
Слайд 42. Буквенное обозначение
3. Единицы измерения
1. Определение
Относительная молекулярная масса
Масса
Количество вещества
Молярная масса
Величина
Характеристика
Основные
Относительная атомная масса
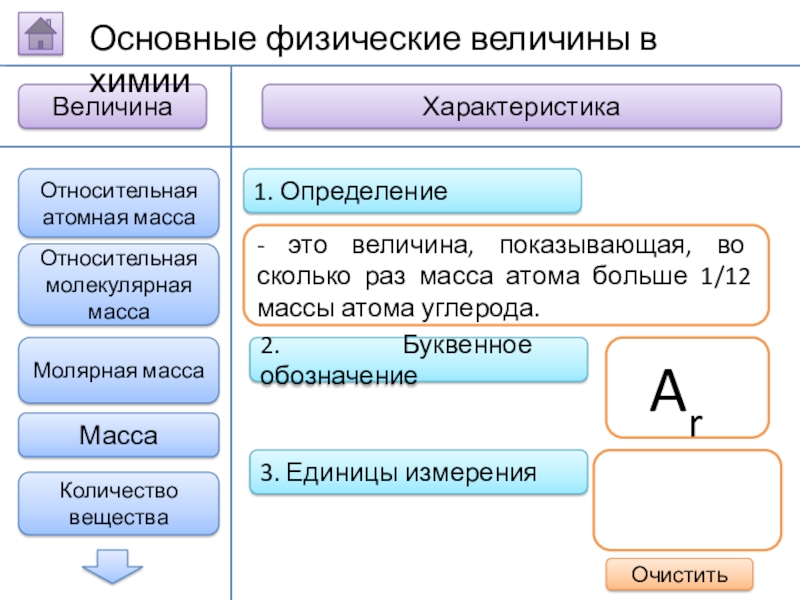
Слайд 52. Буквенное обозначение
3. Единицы измерения
1. Определение
Относительная молекулярная масса
Масса
Количество вещества
- это величина,
Ar
Молярная масса
Величина
Характеристика
Основные физические величины в химии
Относительная атомная масса
Очистить
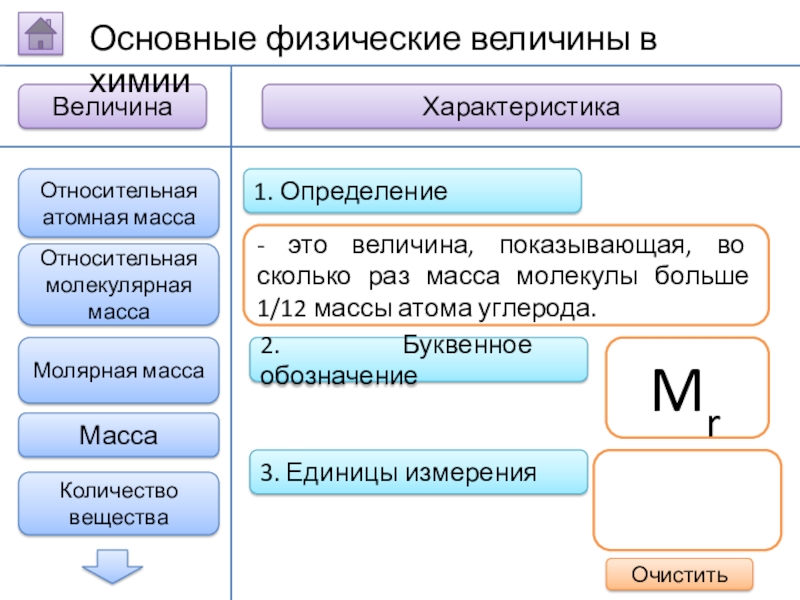
Слайд 62. Буквенное обозначение
3. Единицы измерения
1. Определение
Относительная молекулярная масса
Масса
Количество вещества
- это величина,
Mr
Молярная масса
Величина
Характеристика
Основные физические величины в химии
Относительная атомная масса
Очистить
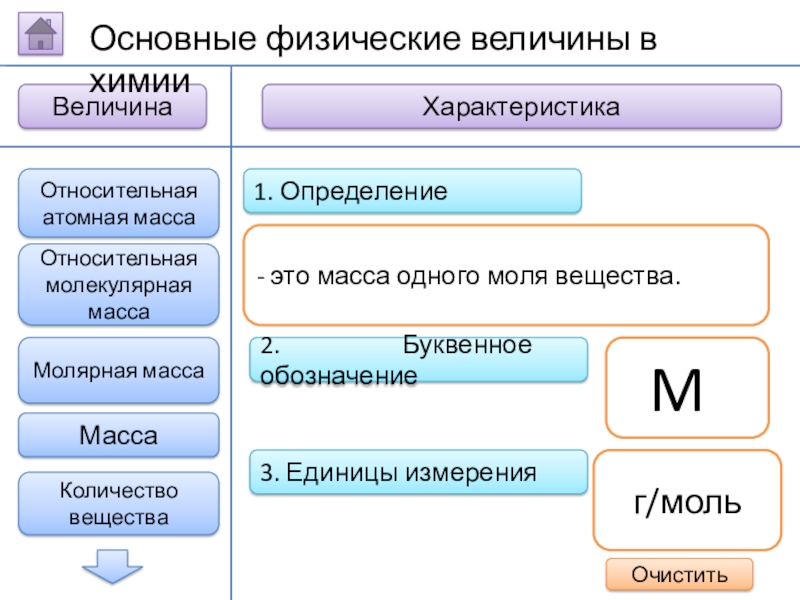
Слайд 72. Буквенное обозначение
3. Единицы измерения
1. Определение
Относительная молекулярная масса
Масса
Количество вещества
- это масса
M
г/моль
Молярная масса
Величина
Характеристика
Основные физические величины в химии
Относительная атомная масса
Очистить
Слайд 82. Буквенное обозначение
3. Единицы измерения
1. Определение
Относительная молекулярная масса
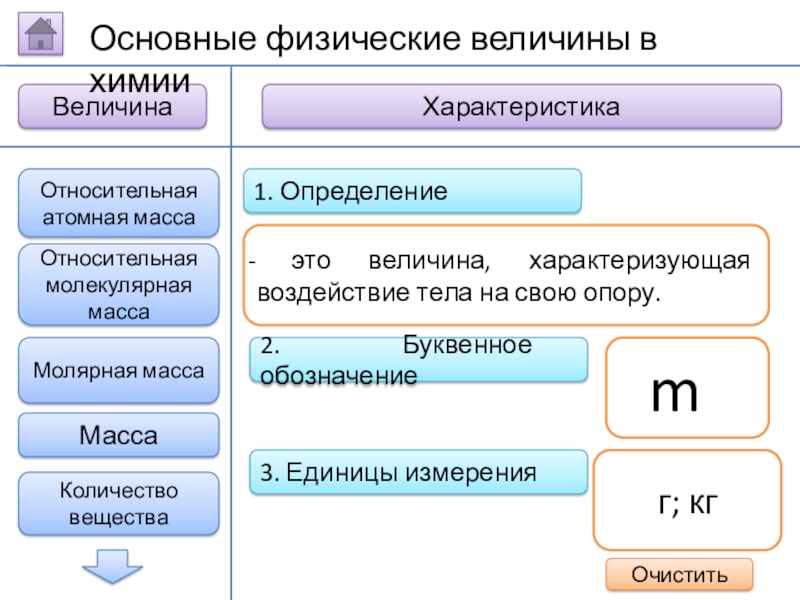
Масса
Количество вещества
это величина,
m
г; кг
Молярная масса
Величина
Характеристика
Основные физические величины в химии
Относительная атомная масса
Очистить
Слайд 92. Буквенное обозначение
3. Единицы измерения
1. Определение
Относительная молекулярная масса
Масса
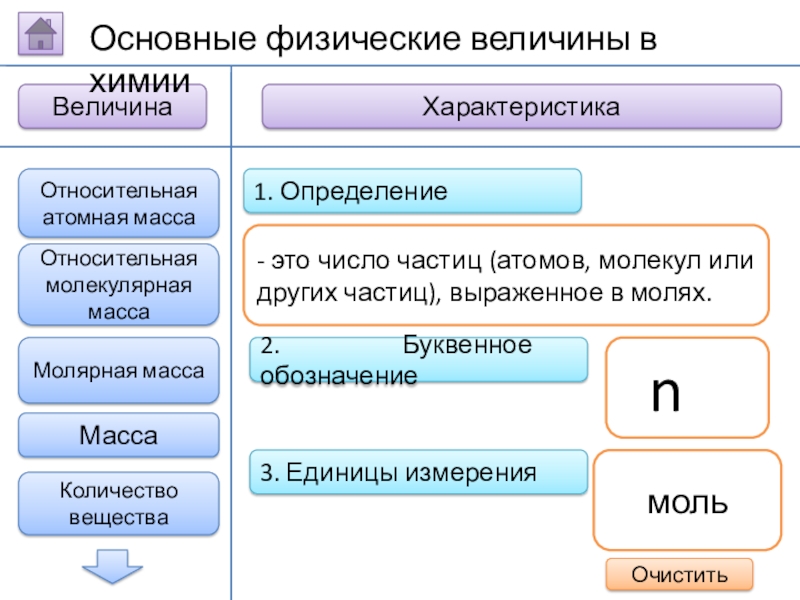
Количество вещества
- это число
n
моль
Молярная масса
Величина
Характеристика
Основные физические величины в химии
Относительная атомная масса
Очистить
Слайд 102. Буквенное обозначение
3. Единицы измерения
1. Определение
Объем
Массовая доля элемента в сложном вещ-ве
Массовая
Величина
Характеристика
Основные физические величины в химии
Молярный объем
Моль
Слайд 112. Буквенное обозначение
3. Единицы измерения
1. Определение
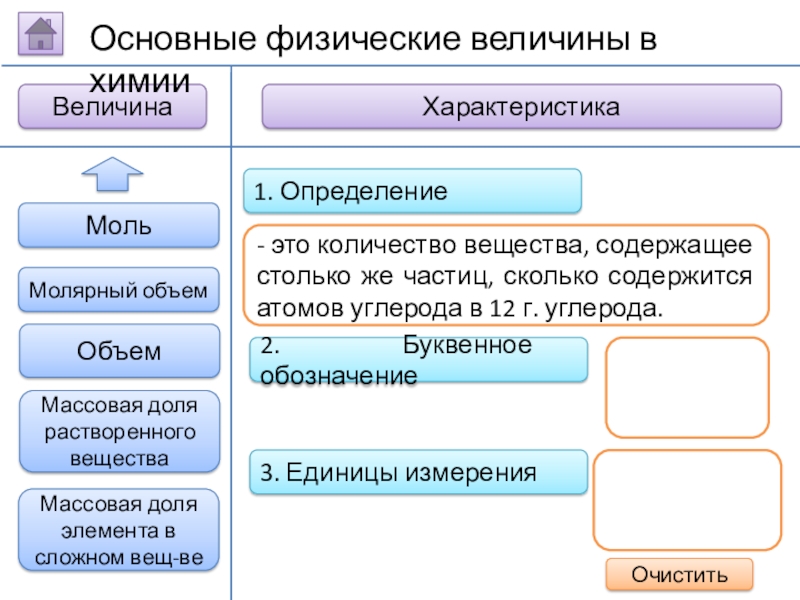
- это количество вещества, содержащее столько
Величина
Характеристика
Основные физические величины в химии
Очистить
Объем
Массовая доля элемента в сложном вещ-ве
Массовая доля растворенного вещества
Молярный объем
Моль
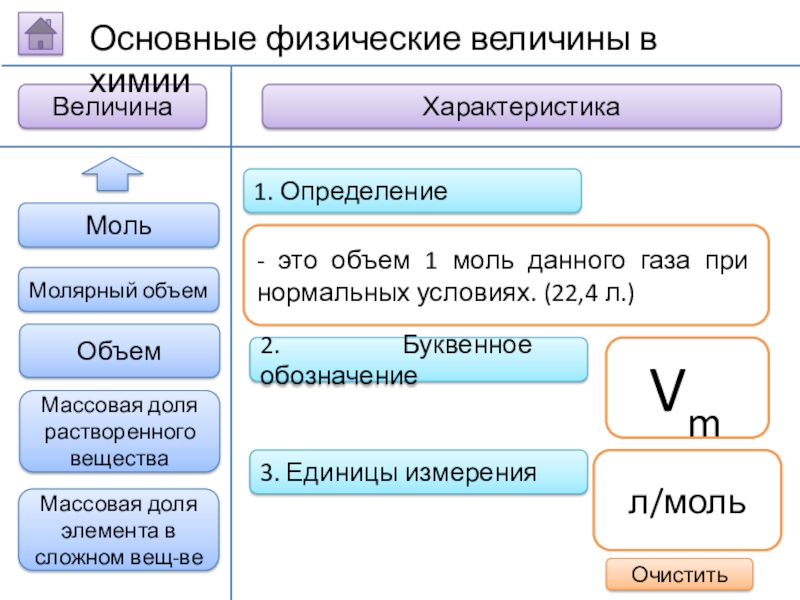
Слайд 122. Буквенное обозначение
3. Единицы измерения
1. Определение
- это объем 1 моль данного
Vm
л/моль
Величина
Характеристика
Основные физические величины в химии
Очистить
Объем
Массовая доля элемента в сложном вещ-ве
Массовая доля растворенного вещества
Молярный объем
Моль
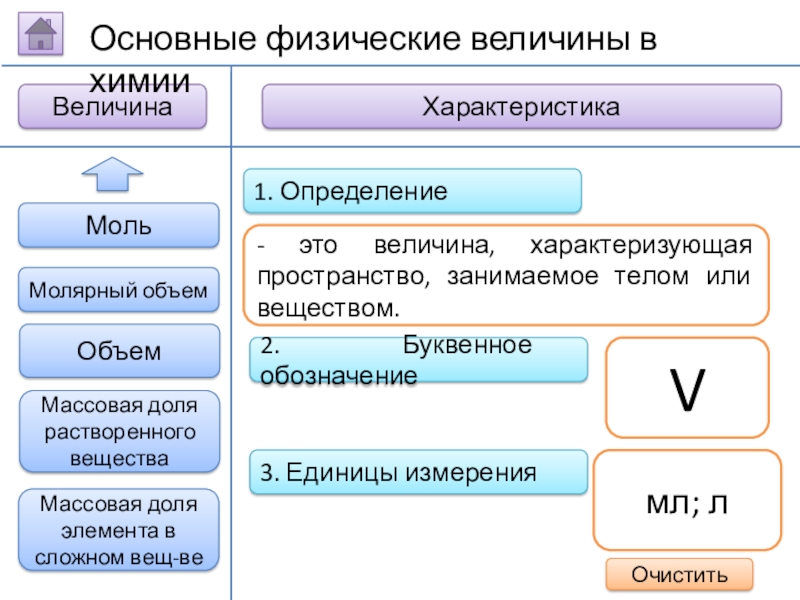
Слайд 132. Буквенное обозначение
3. Единицы измерения
1. Определение
- это величина, характеризующая пространство, занимаемое
V
мл; л
Величина
Характеристика
Основные физические величины в химии
Очистить
Объем
Массовая доля элемента в сложном вещ-ве
Массовая доля растворенного вещества
Молярный объем
Моль
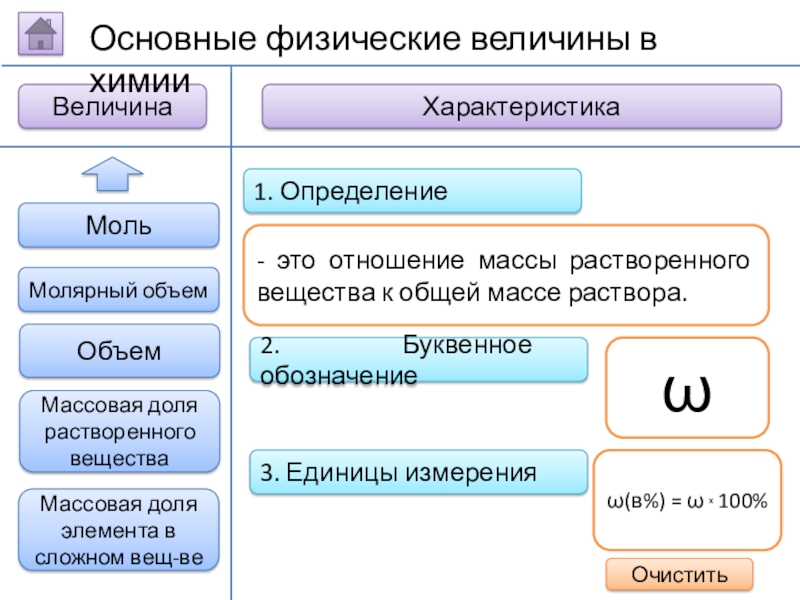
Слайд 142. Буквенное обозначение
3. Единицы измерения
1. Определение
- это отношение массы растворенного вещества
ω
ω(в%) = ω х 100%
Величина
Характеристика
Основные физические величины в химии
Очистить
Объем
Массовая доля элемента в сложном вещ-ве
Массовая доля растворенного вещества
Молярный объем
Моль
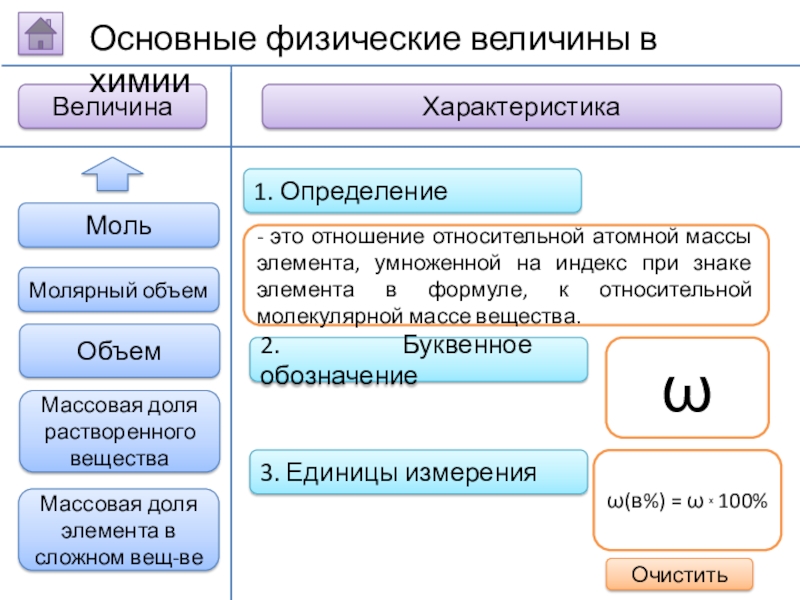
Слайд 152. Буквенное обозначение
3. Единицы измерения
1. Определение
- это отношение относительной атомной массы
ω
ω(в%) = ω х 100%
Величина
Характеристика
Основные физические величины в химии
Очистить
Объем
Массовая доля элемента в сложном вещ-ве
Массовая доля растворенного вещества
Молярный объем
Моль
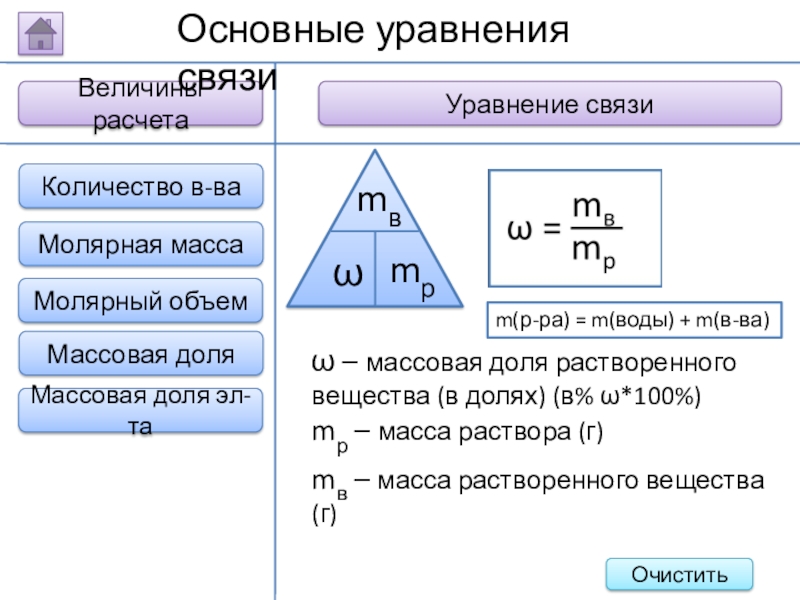
Слайд 16Величины расчета
Уравнение связи
Молярная масса
Молярный объем
Основные уравнения связи
Количество в-ва
Массовая доля
Массовая доля эл-та
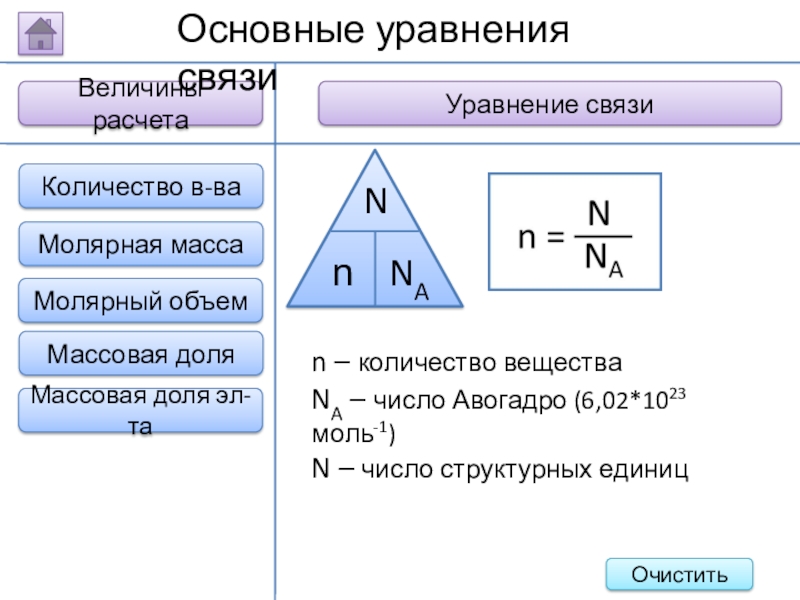
Слайд 17Величины расчета
Уравнение связи
Основные уравнения связи
n – количество вещества
NA – число Авогадро
N – число структурных единиц
Молярная масса
Молярный объем
Количество в-ва
Массовая доля
Массовая доля эл-та
Очистить
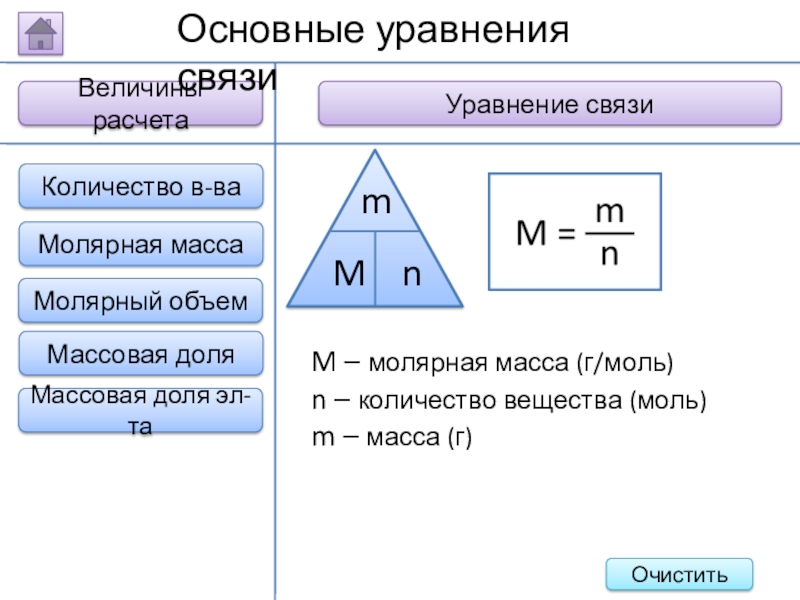
Слайд 18Величины расчета
Уравнение связи
Основные уравнения связи
M – молярная масса (г/моль)
n – количество
m – масса (г)
Молярная масса
Молярный объем
Количество в-ва
Массовая доля
Массовая доля эл-та
Очистить
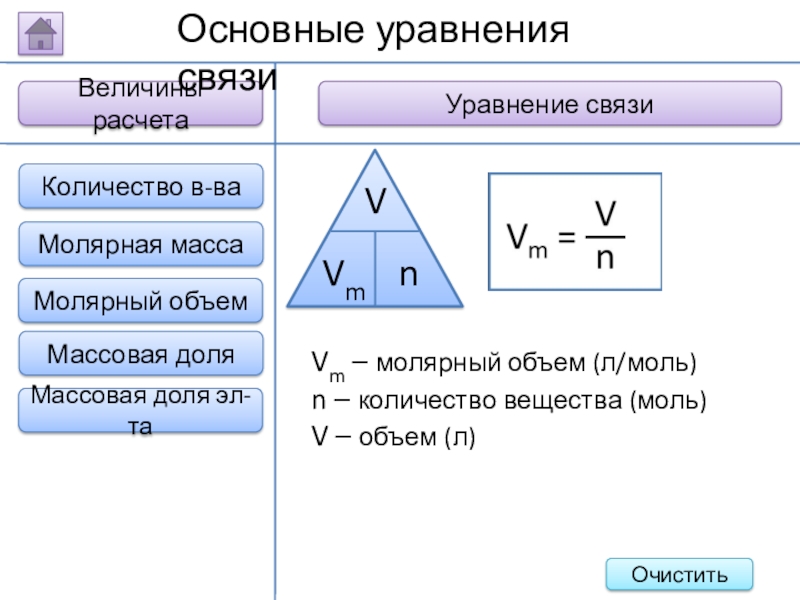
Слайд 19Величины расчета
Уравнение связи
Основные уравнения связи
Vm – молярный объем (л/моль)
n – количество
V – объем (л)
Молярная масса
Молярный объем
Количество в-ва
Массовая доля
Массовая доля эл-та
Очистить
Слайд 20Величины расчета
Уравнение связи
Основные уравнения связи
m(р-ра) = m(воды) + m(в-ва)
ω –
mр – масса раствора (г)
mв – масса растворенного вещества (г)
Молярная масса
Молярный объем
Количество в-ва
Массовая доля
Массовая доля эл-та
Очистить
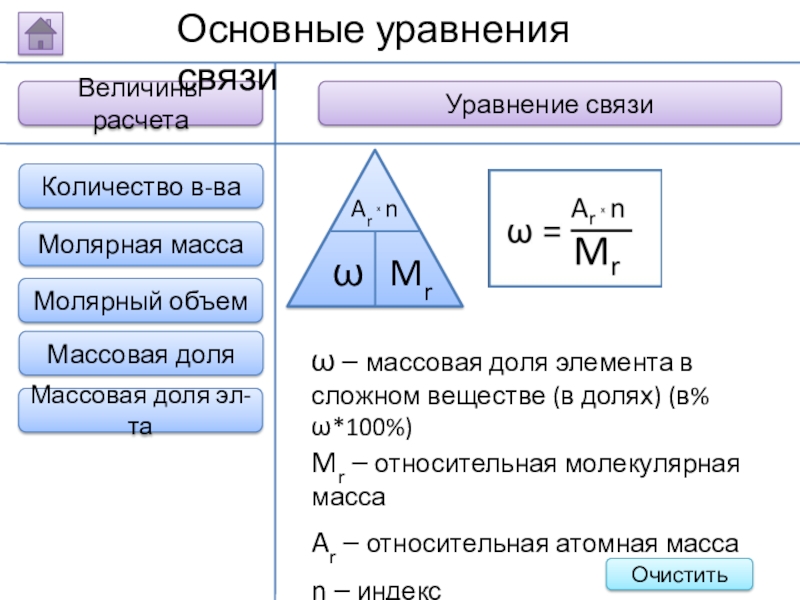
Слайд 21Величины расчета
Уравнение связи
Основные уравнения связи
ω – массовая доля элемента в сложном
Mr – относительная молекулярная масса
Ar – относительная атомная масса
n – индекс
Молярная масса
Молярный объем
Количество в-ва
Массовая доля
Массовая доля эл-та
Очистить
Слайд 22Задания с выбором ответа (A15)
Дано:
Найти:
Решение:
Ответ:
Определите массовую долю углерода в карбонате
w(C) - ?
CaCO3
) Найдем относительную молекулярную массу CaCO3:
Mr(CaCO3) = 40+12+3*16 = 100
) Найдем массовую долю углерода:
w(C) = 12/100 = 0,12, или 12%
0,12, или 12%
0,12, или 12%
Список задач
Слайд 23Задания с выбором ответа(A15).
Задача №1
Задача №2
Задача №3
Задача №4
Задача №5
Задача №6
Задача №7
Задача №8
Задача №9
Задача №10
Слайд 24Задача №1
Определите массовые доли элементов в оксиде меди (II).
w(Cu)
w(Cu) = 70%, w(O) = 30%
w(Cu) = 55%, w(O) = 45%
w(Cu) = 63%, w(O) = 37%.
Список задач
Слайд 25Задача №2
Массовая доля кислорода в сульфите магния равна:
w(O) = 13,3%
w(O)
w(O) = 40,0%
w(O) = 46,2%.
Список задач
Слайд 26Задача №3
Массовая доля калия в сульфате калия равна:
w(K) = 22,4%
w(K)
w(K) = 44,8%
w(K) = 49,4%.
Список задач
Слайд 27Задача №4
Массовая доля углерода в карбонате аммония равна:
w(С) = 12,5%
w(C)
w(C) = 41,8%
w(C) = 46,4%.
Список задач
Слайд 28Задача №5
Массовая доля азота в нитрате кальция равна:
w(N) = 9,3%
w(N)
w(N) = 34,2%
w(N) = 39,4%.
Список задач
Слайд 29Задача №6
Массовая доля водорода в гидроксиде алюминия равна:
w(H) = 3,8%
w(H)
w(H) = 28,0%
w(H) = 4,5%.
Список задач
Слайд 30Задача №7
Массовая доля кислорода в аммиачной селитре равна:
w(H) = 30%
w(H)
w(H) = 43,75%
w(H) = 50%.
Список задач
Слайд 31Задача №8
Массовая доля воды в кристаллической соде (декагидрат карбоната натрия)
w(H2O) = 6,4%
w(H2O) = 62,9%
w(H2O) = 21,4%
w(H2O) = 68,4%.
Список задач
Слайд 32Задача №9
Массовая доля азота в аммофосе (эквимолекулярная смесь гидрофосфата и
w(H) = 17,0%
w(H) = 21,13%
w(H) = 28,19%
w(H) = 12,17%.
Список задач
Слайд 33Задача №10
Определите форму гипса, если известно, что в его состав
CaSO4 * 5H2O
CaSO4 * H2O
CaSO4 * 2H2O
2CaSO4 * H2O
Список задач
Слайд 34Задания с развернутым ответом (С2). Тип 1.
Дано:
Найти:
Решение:
Ответ:
SO3 + 2KOH = K2SO4
M(SO3) = 32+48 = 80 г/моль
n(SO3) = 8 г : 80 г/моль = 0,1 моль
=> n(K2SO4) = 0,1 моль
M(K2SO4) = 78+32+64 = 174 г/моль
m(K2SO4) = 174 г/моль * 0,1 моль = 17,4 г
w(K2SO4) = 17,4 г : 174 г = 0,1 = 10%
w(K2SO4) - ?
При взаимодействии 8,0 г. оксида серы (VI) с избытком раствора гидроксида калия получили
174 г. раствора средней соли. Вычислите массовую долю соли в полученном растворе.
w(K2SO4) = 0,1 = 10%
Список задач
m(SO3) = 8 г
mр-ра(K2SO4) = = 174 г
Слайд 35Задания с развернутым ответом (С2). Тип 1.
Задача №1
Задача №2
Задача
Задача №4
Задача №5
Задача №6
Задача №7
Задача №8
Задача №9
Слайд 36Задача №1
Список задач
При добавлении к раствору серной кислоты с массовой
Ответ: m(H2SO4) = 49 г.
Слайд 37Задача №2
Список задач
К 100 г 5%-ного раствора серной кислоты прилили
Ответ: m(BaSO4) = 11, 65 г.
Слайд 38Задача №3
Список задач
При пропускании 4,48 л. углекислого газа (н.у.) через
Ответ: m(Ba(OH)2) = 285 г.
Слайд 39Задача №4
Список задач
При добавлении к раствору гидроксида натрия с массовой
Ответ: m(NaOH) = 20 г.
Слайд 40Задача №5
Список задач
При добавлении 6,3%-ного раствора азотной кислоты к оксиду
Ответ: m(HNO3) = 400 г.
Слайд 41Задача №6
Список задач
Вычислите массу хлорида калия, полученного при взаимодействии соляной
Ответ: m(KCl) = 13,4 г.
Слайд 42Задача №7
Список задач
Какую массу раствора с массовой долей гидроксида натрия
Ответ: m(NaOH) = 138 г.
Слайд 43Задача №8
Список задач
Вычислите массу раствора серной кислоты (массовая доля кислоты
Ответ: m(H2SO4) = 980 г.
Слайд 44Задача №9
Список задач
К 200 г раствора с массовой долей серной
Ответ: m(BaSO4) = 116,5 г.
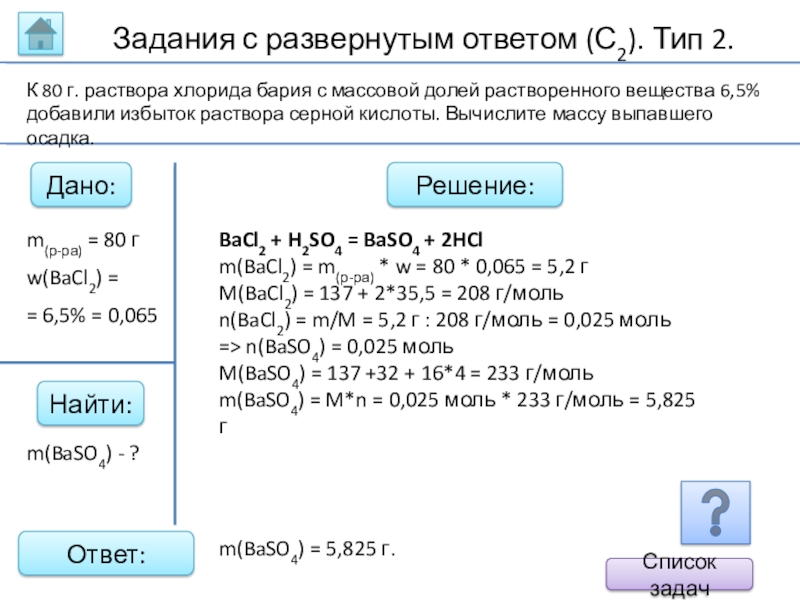
Слайд 45Задания с развернутым ответом (С2). Тип 2.
Дано:
Найти:
Решение:
Ответ:
BaCl2 + H2SO4 = BaSO4
m(BaCl2) = m(р-ра) * w = 80 * 0,065 = 5,2 г
M(BaCl2) = 137 + 2*35,5 = 208 г/моль
n(BaCl2) = m/M = 5,2 г : 208 г/моль = 0,025 моль
=> n(BaSO4) = 0,025 моль
M(BaSO4) = 137 +32 + 16*4 = 233 г/моль
m(BaSO4) = M*n = 0,025 моль * 233 г/моль = 5,825 г
m(BaSO4) - ?
К 80 г. раствора хлорида бария с массовой долей растворенного вещества 6,5% добавили избыток раствора серной кислоты. Вычислите массу выпавшего осадка.
m(BaSO4) = 5,825 г.
Список задач
m(р-ра) = 80 г
w(BaCl2) =
= 6,5% = 0,065
Слайд 46Задания с развернутым ответом (С2). Тип 2.
Задача №1
Задача №2
Задача
Задача №4
Задача №5
Задача №6
Задача №7
Задача №8
Задача №9
Задача №10
Слайд 47Задача №1
В 73 г. соляной кислоты с массовой долей HCl
Ответ: V(H2) = 1,12 л.
Список задач
Слайд 48Задача №2
К раствору карбоната калия массой 27,6 г. и массовой
Ответ: V(CaCO3) = 4 г.
Список задач
Слайд 49Задача №3
Рассчитайте массу осадка, который выпадет при взаимодействии избытка карбоната
Ответ: m(BaCO3) = 1,97 г.
Список задач
Слайд 50Задача №4
Определите объем (н.у.) углекислого газа, выделяющегося при растворении 110
Ответ: m(CO2) =22,67 г.
Список задач
Слайд 51Задача №5
В избытке соляной кислоты растворили 1,506 г руды, содержащей
Ответ: V(CO2) = 0,224 л.
Список задач
Слайд 52Задача №6
Рассчитайте массу осадка, который выпадет при сливании 500 г. 2%-ного
Ответ: m(PbI2) = 13,9 г.
Список задач
Слайд 53Задача №7
Вычислите массу хлорида калия, полученного при взаимодействии соляной кислоты со
Ответ: m(KCl) = 13,34 г.
Список задач
Слайд 54Задача №8
К 200 г. 12,25%-ного раствора серной кислоты прилили избыток раствора
Ответ: m(BaSO4) = 58,25 г.
Список задач
Слайд 55Задача №9
Какой объем сероводорода (н.у) образуется при взаимодействии сульфида железа (II)
Ответ: V(H2S) 19,2 л.
Список задач
Слайд 56Задача №10
Какой объем (н.у.) оксида углерода (IV) выделится при взаимодействии 25
Ответ: V(CO2) = 5,0 л.
Список задач
Слайд 57Задания с развернутым ответом (С2). Тип 3.
Дано:
Найти:
Решение:
Ответ:
m(Fe2O3) =
= 640 кг
w(примесей) =
= 25 %
Fe2O3 + 3H2 = 2Fe + 3H2O
w(Fe2O3) = 100 % (смеси) – 25 % (примесей) = = 75% = 0,75
m(чистого) = m(смеси) * w(Fe2O3)
m(Fe2O3) = 640 кг * 0,75 = 480 кг
M(Fe2O3) = 160 кг/кмоль
n(Fe2O3) = 480 кг : 160 кг/кмоль = 3 кмоль,
n(H2) = 9 кмоль.
V(H2) = 22,4 м3/кмоль * 9 кмоль = 201,6 м3
V(H2) = ?
Какой объём водорода потребуется для взаимодействия с оксидом железа (III) массой 640 кг, содержащего 25 % примесей?
V(H2) = 201,6 м3.
Список задач
Слайд 58Задания с развернутым ответом (С2). Тип 3.
Задача №1
Задача №2
Задача
Задача №4
Задача №5
Задача №6
Задача №7
Задача №8
Задача №9
Слайд 59Рассчитайте, сколько чистого оксида железа содержится в железой руде, если масса
Ответ: m(Fe2O3) = 220 г.
Задача №1
Список задач
Слайд 60При взаимодействии 10,79 г кальцинированной соды с избытком соляной кислоты получили
Ответ: w(примесей) = 1,8 %
Задача №2
Список задач
Слайд 61При растворении 226 г образца алюминия в соляной кислоте выделилось 268,8
Ответ: w(примесей) = 4,42 %
Задача №3
Список задач
Слайд 62Из 30 г известняка под действием азотной кислоты выделилось 5,6 л
Ответ: m(CaCO3) = 25 г; w(примесей) = 16,7 %
Задача №4
Список задач
Слайд 63Рассчитайте объём кислорода, который потребуется для сжигания 550 г сероводорода, содержащего
Ответ: V(O2) = 516 л.
Задача №5
Список задач
Слайд 64Какой объем углекислого газа выделится (н.у.) при обжиге известняка массой 250
Ответ: V(CO2) = 44,8 м3
Задача №6
Список задач
Слайд 65Рассчитайте сколько чистого оксида железа содержится в железой руде, если масса
Ответ: m(Fe2O3) = 220 г.
Задача №7
Список задач
Слайд 66Вычислите объём аммиака, который можно получит при синтезе из водорода и
Ответ: V(NH3) = 47 л; n(H2) = 3,15 моль.
Задача №8
Список задач
Слайд 67Вычислите массу оксида магния, которая получается при обжиге карбоната магния массой
Ответ: m(MgO) = 116,4 кг
Задача №9
Список задач
Слайд 68Справочный материал
Селитры – это нитраты щелочных металлов, кальция и аммония. Нитрат
Слайд 69Справочный материал
Экви - значит «равное». Это значит два или
Слайд 70Справочный материал
Кальцинированная сода (кристаллическая) - Na2CO3·10H2O (декагидрат карбоната натрия,
M(Na2CO3·10H2O) = 46+12+48+10*(2+16) = 286 г/моль.
Слайд 71Литература
«ГИА-2013: Экзамен в новой форме. Химия. 9-й класс» Д.Ю. Добротин, А.А.
«Химия. 9-й класс. Подготовка к ГИА-2011» В.Н. Доронькин.
«Химия. 9-й класс. Готовимся к экзаменам» М.Г, Снастина.
Интернет-ресурсы
Фон для презентации - http://pedsovet.su/load/321-4-2
Картинки - http://arthimik.ru/osuschestvlenie-chimicheskich-protsessov/chimicheskie-protsessi;
http://lesnopak.com/khimicheskie-reaktivy;
http://uroki-shkola.ru/osnovnye-ximicheskie-ponyatiya-urok-ximii-v-8-klasse.html;
http://photobank.3vx.ru/13886-himicheskie_kolbyi_s_reagentami_3d_vizualizatsii_stokovoe_foto_.html