и сажа.
Химические свойства.
Круговорот углерода в природе.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Углерод.
Содержание
- 1. Презентация по химии на тему Углерод.
- 2. Характеристика химического элемента углерода по положению в
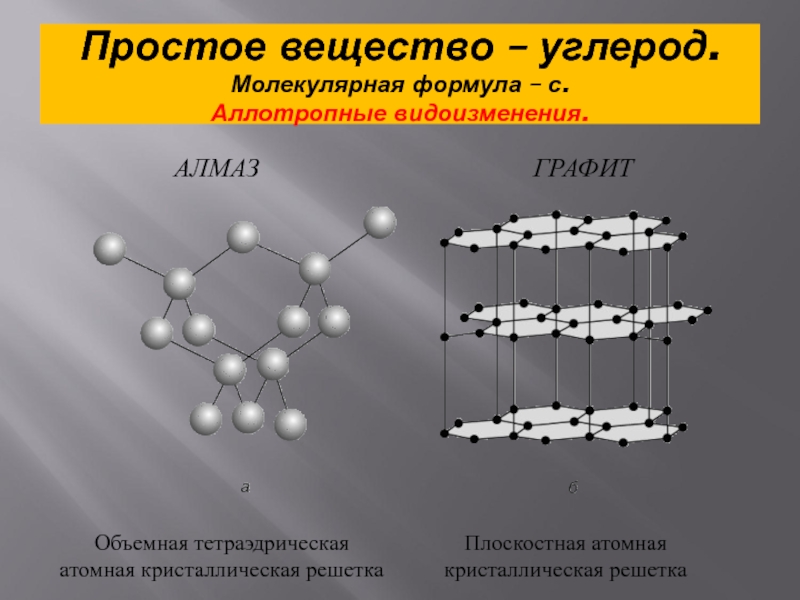
- 3. Простое вещество – углерод. Молекулярная формула – с. Аллотропные видоизменения.АЛМАЗГРАФИТ
- 4. АлмазПрозрачное кристаллическое вещество. Кристаллы алмаза обычно бесцветные,
- 5. Алмазы – камни ювелировОграненные прозрачные алмазы называются бриллиантами.Звезда ордена Святого Андрея Первозванного.
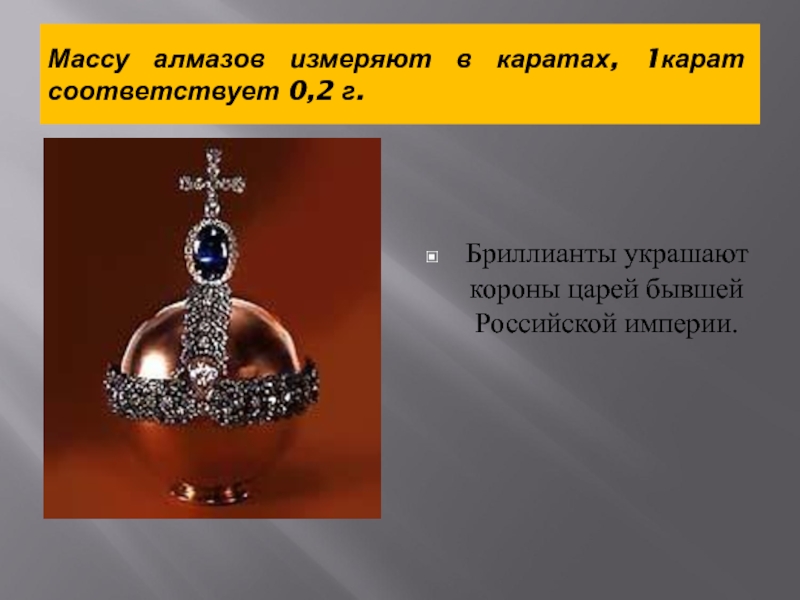
- 6. Массу алмазов измеряют в каратах, 1карат соответствует 0,2 г.Бриллианты украшают короны царей бывшей Российской империи.
- 7. Кристаллы алмаза отличаются особо прочной структурой, благодаря
- 8. ГрафитТемно-серое, жирное на ощупь кристаллическое вещество с металлическим блеском.
- 9. В отличии от алмаза графит мягкий (оставляет
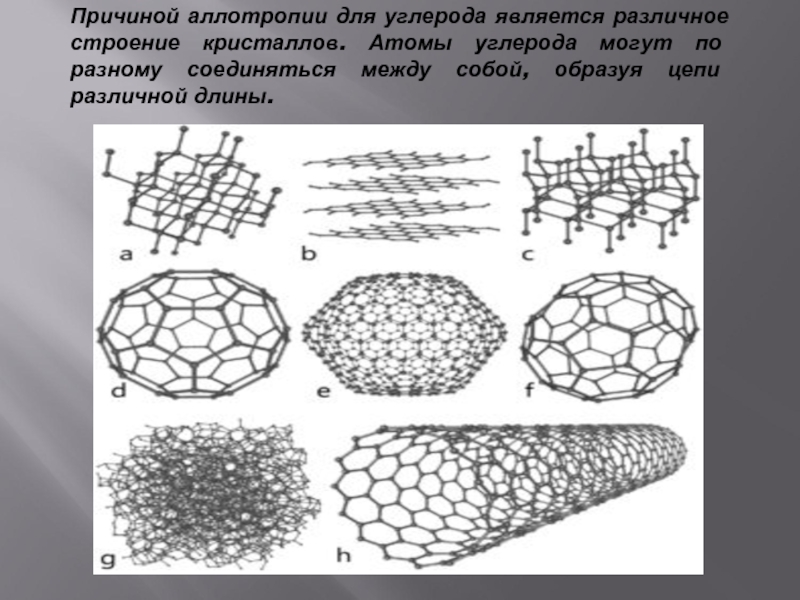
- 10. Причиной аллотропии для углерода является различное строение
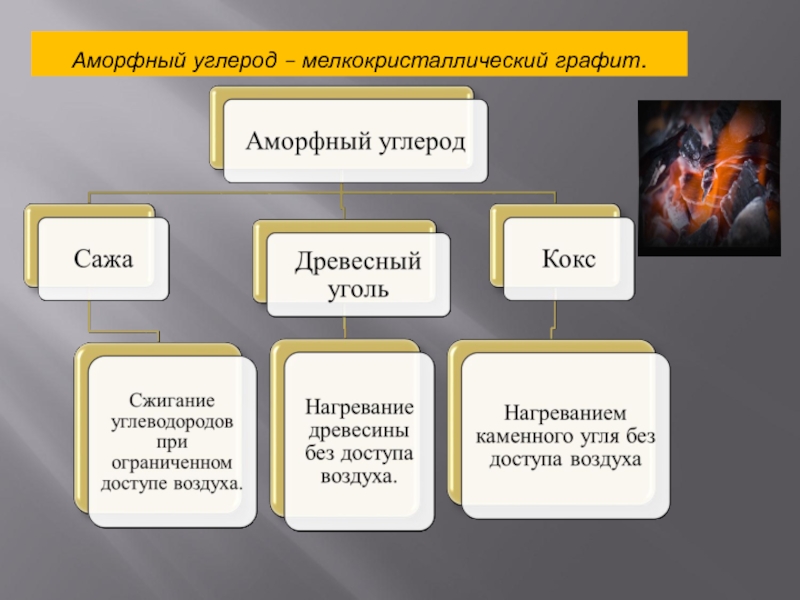
- 11. Аморфный углерод – мелкокристаллический графит.
- 12. Адсорбция.Адсорбция – поглощение газов и растворенных веществ
- 13. Демонстрация поглотительной способности активированного угля.Поглощение оксида азота(IV) активированным углем.Обесцвечивание раствора перманганата калия.
- 14. Применение активированного угля.
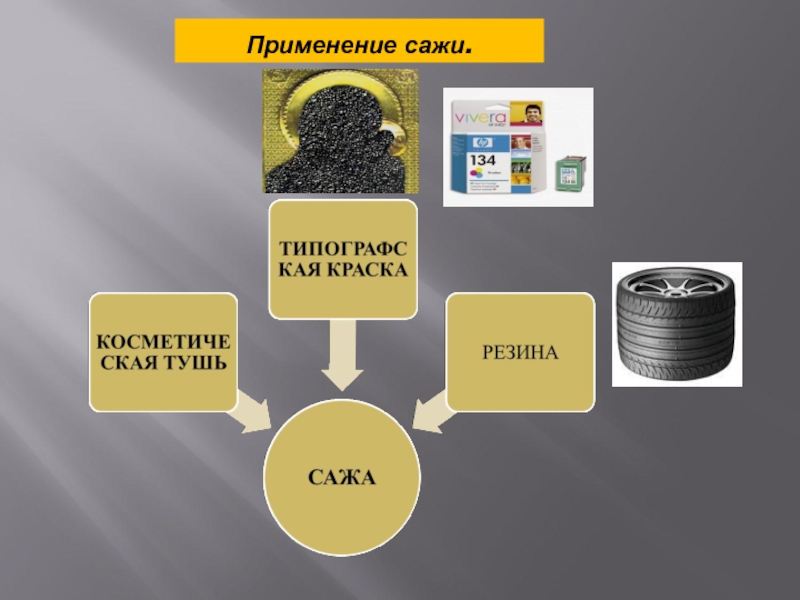
- 15. Применение сажи.
- 16. Химические свойства углерода.ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВАОКИСЛИТЕЛЬНЫЕ СВОЙСТВАС более электроотрицательными
- 17. Взаимодействие карбидов с водой. Если на карбид
- 18. Круговорот углерода в природе.Из атмосферы и природных
- 19. Слайд 19
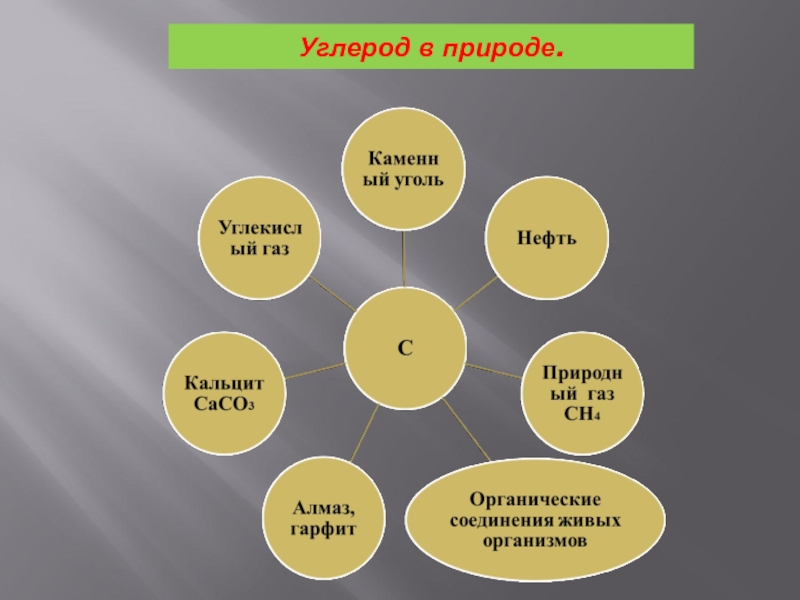
- 20. Углерод в природе.
Характеристика химического элемента углерода по положению в ПСХЭ.1. Углерод С главная подгруппа IV группа, второй период, порядковый номер 6. 2. На внешнем энергетическом уровне 4 электрона, поэтому он может принимать 4 электрона, проявляя окислительные свойства по
Слайд 1УГЛЕРОД.
Химический элемент:
Характеристика по положению в ПСХЭ
Простое вещество:
Аллотропные видоизменения: алмаз,графит.
Древесный уголь (адсорбция)
Слайд 2Характеристика химического элемента углерода по положению в ПСХЭ.
1. Углерод С главная
подгруппа IV группа, второй период, порядковый номер 6.
2. На внешнем энергетическом уровне 4 электрона, поэтому он может принимать 4 электрона, проявляя окислительные свойства по отношению к водороду, металлам и менее электроотрицательным неметаллам, и приобретать при этом степень окисления -4, но может и отдавать электроны более электроотрицательным элементам, т.е. проявлять восстановительные свойства, приобретая при этом степень окисления +4.
3. Высший оксид CO2 проявляет кислотный характер. Высший гидроксид Н2СО3 – угольная кислота является слабой и непрочной. Летучее водородное соединение – СН4 называется метан.
4.Окислительные(неметаллические) свойства углерода слабее выражены, чем у находящегося с ним в одном периоде азота, т.к. он имеет больший атомный радиус, чем азот, меньший заряд ядра и меньшее число валентных электронов. По сравнению с кремнием, находящимся с углеродом в одной подгруппе, углерод проявляет более ярко выраженные неметаллические свойства, т.к. имеет меньший атомный радиус.
2. На внешнем энергетическом уровне 4 электрона, поэтому он может принимать 4 электрона, проявляя окислительные свойства по отношению к водороду, металлам и менее электроотрицательным неметаллам, и приобретать при этом степень окисления -4, но может и отдавать электроны более электроотрицательным элементам, т.е. проявлять восстановительные свойства, приобретая при этом степень окисления +4.
3. Высший оксид CO2 проявляет кислотный характер. Высший гидроксид Н2СО3 – угольная кислота является слабой и непрочной. Летучее водородное соединение – СН4 называется метан.
4.Окислительные(неметаллические) свойства углерода слабее выражены, чем у находящегося с ним в одном периоде азота, т.к. он имеет больший атомный радиус, чем азот, меньший заряд ядра и меньшее число валентных электронов. По сравнению с кремнием, находящимся с углеродом в одной подгруппе, углерод проявляет более ярко выраженные неметаллические свойства, т.к. имеет меньший атомный радиус.
Слайд 4Алмаз
Прозрачное кристаллическое вещество. Кристаллы алмаза обычно бесцветные, но бывают синего, голубого,
красного и черного цветов. Они имеют очень сильный блеск благодаря высокой светопреломляющей и светоотражающей способности.
Слайд 5Алмазы – камни ювелиров
Ограненные прозрачные
алмазы называются
бриллиантами.
Звезда ордена Святого Андрея
Первозванного.
Слайд 6Массу алмазов измеряют в каратах, 1карат соответствует 0,2 г.
Бриллианты украшают короны
царей бывшей Российской империи.
Слайд 7Кристаллы алмаза отличаются особо прочной структурой, благодаря чему он обладает твердостью,
превосходящей твердость всех известных в природе веществ.(В 1000 раз > кварца и в 150 корунда)
Слайд 9В отличии от алмаза графит мягкий (оставляет след на бумаге) и
непрозрачный, тугоплавок, хорошо проводит теплоту и электрический ток, при измельчении образует очень прочные чешуйки. Благодаря этим свойствам он и находит применение в промышленности.
Слайд 10Причиной аллотропии для углерода является различное строение кристаллов. Атомы углерода могут
по разному соединяться между собой, образуя цепи различной длины.
Слайд 12Адсорбция.
Адсорбция – поглощение газов и растворенных веществ поверхностью твердого вещества.
Таким свойством
обладает древесный уголь благодаря своему пористому строению.
При обработке древесного угля горячим водяным паром получают активированный уголь, который обладает большей поглотительной способностью.
При обработке древесного угля горячим водяным паром получают активированный уголь, который обладает большей поглотительной способностью.
Слайд 13Демонстрация поглотительной способности активированного угля.
Поглощение оксида азота(IV) активированным углем.
Обесцвечивание раствора перманганата
калия.
Слайд 16Химические свойства углерода.
ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА
ОКИСЛИТЕЛЬНЫЕ СВОЙСТВА
С более электроотрицательными неметаллами (F, O, N,
Cl, S)
Неполное сгорание в кислороде
2C + O2 = 2CO + Q
оксид углерода(II)
Полное сгорание
С + О2 =СО2 + Q
оксид углерода (IV)
С оксидами металлов
C + 2CuO = CO2 + 2Cu
Неполное сгорание в кислороде
2C + O2 = 2CO + Q
оксид углерода(II)
Полное сгорание
С + О2 =СО2 + Q
оксид углерода (IV)
С оксидами металлов
C + 2CuO = CO2 + 2Cu
С металлами:
4Al + 3C = Al4 C3
карбид алюминия
С водородом
C + 2H2 = 2CH4
метан
Слайд 17Взаимодействие карбидов с водой.
Если на карбид кальция подействовать водой, то выделяется
ацетилен, который применяют газосварщики для резки и сварки металлов, сжигая его с помощью кислорода в специальных горелках
CaC2 + 2H2O = Ca(OH)2 + C2H2
Если водой подействовать на карбид алюминия, то получится метан
Al 4C3 + 12H2O= 4Al(OH)3 + 3CH4
CaC2 + 2H2O = Ca(OH)2 + C2H2
Если водой подействовать на карбид алюминия, то получится метан
Al 4C3 + 12H2O= 4Al(OH)3 + 3CH4
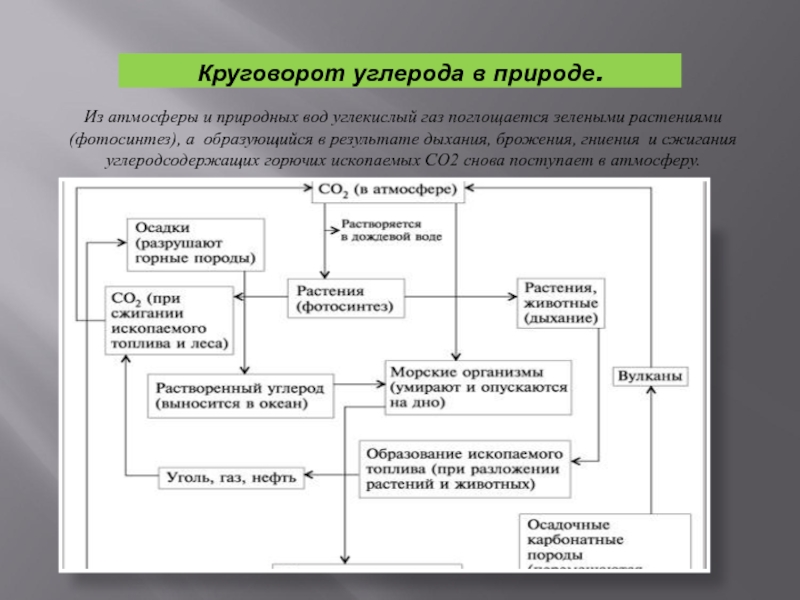
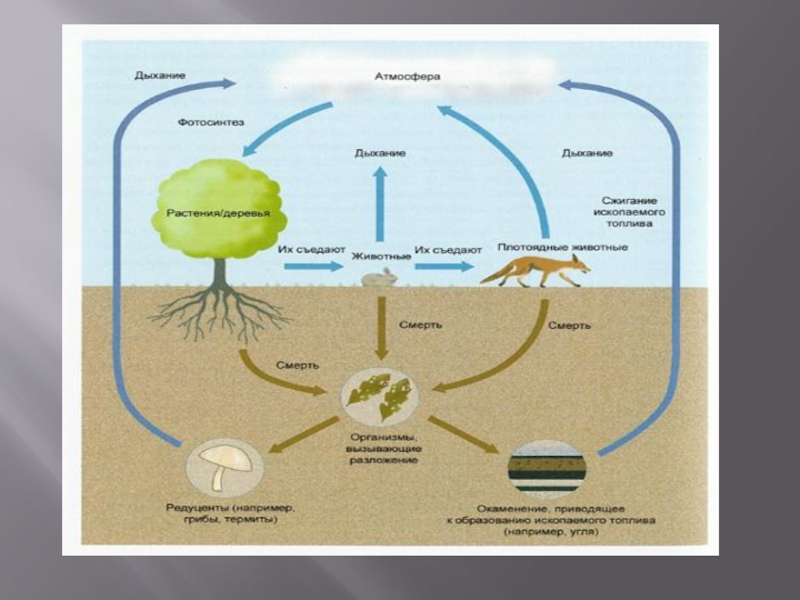
Слайд 18Круговорот углерода в природе.
Из атмосферы и природных вод углекислый газ поглощается
зелеными растениями(фотосинтез), а образующийся в результате дыхания, брожения, гниения и сжигания углеродсодержащих горючих ископаемых СО2 снова поступает в атмосферу.