- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Углерод
Содержание
- 1. Презентация по химии на тему Углерод
- 2. С незапапятных времён человек
- 3. ИсторияВпервые «чистый уголь» был признан Антуаном Лавуазье, исследовавшим
- 4. То, что алмаз при сильном нагревании
- 5. Второй аллотроп углерода — графит — в
- 6. Происхождение названияВ начале XIX века в русской
- 7. Строение атома В периодической таблице химических элементов углерод
- 8. Углерод — химический элемент с атомным номером
- 9. Физические свойства аллотропных модификаций углерода
- 10. Карбин имеет кристаллическую структуру, в которой атомы
- 11. П О Ч Е М УА Л
- 12. А Л М А ЗАлмаз имеет атомную
- 13. Г Р А Ф И ТГрафит имеет
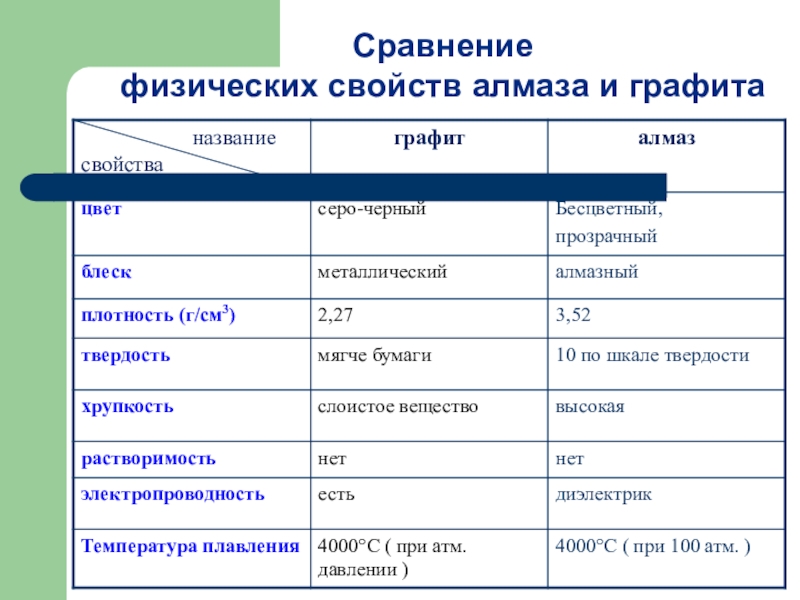
- 14. Сравнение физических свойств алмаза и графита
- 15. Взаимопревращение алмаза и графитаАлмазt°=2000°C без доступа воздухаt°=3000°C,Р=50
- 16. Сходное с графитом строение имеют:СажаДревесный угольКокстипографская краска,
- 17. Аморфный углеродАктивированный угольДревесный угольИскопаемый уголь: антрацит и др.Кокс каменноугольный, нефтяной и др.СтеклоуглеродТехуглеродСажаУглеродная нанопенаНа практике,
- 18. Изотопы углерода Природный углерод состоит
- 19. Углерод в живой и неживой природе
- 20. Нахождение в природе Свободный
- 21. КРУГОВОРОТ УГЛЕРОДА
- 22. Углерод — основа жизни.
- 23. А Л М А З
- 24. Алмаз, благодаря исключительной твёрдости, незаменимый абразивный материал. Алмазным напылением
- 25. Звезда орденаСв. Андрея Первозванного Алмаз «Шах» Скипетр императорский
- 26. Большая императорская корона Малая императорская корона
- 27. Г Р А Ф И ТПрименение графита:
- 28. В фармакологии
- 29. Применение активированного угляОчисткапитьевой воды(фильтры)Карболен-таблетки длявыведения токсинов из организмаОчистка воздуха(противогаз)
- 30. Угольные фильтрыВ бытовых фильтрах, в промышленном производстве,
- 31. ЗЕЛИНСКИЙ Николай Дмитриевич (1861-1953)Изобретатель противогаза
- 32. Ответьте на вопросы:Что такое аллотропные видоизменения?Какие аллотропные
Слайд 2 С незапапятных времён человек использовал уголь и сажу.
Углерод является одним из первых химических элементов, который известен человеку.
Слайд 3История
Впервые «чистый уголь» был признан Антуаном Лавуазье, исследовавшим процесс сжигания в воздухе
В книге Гитона де Морво, Лавуазье и др. «Метод химической номенклатуры» (1787) появилось название «углерод» (carbone) вместо французского «чистый уголь» (charbone pur).
Под этим же названием углерод фигурирует в «Таблице простых тел» в «Элементарном учебнике химии» Лавуазье.
Слайд 4 То, что алмаз при сильном нагревании сгорает без остатка, было
История
В 1791 году английский химик Теннант первым получил свободный углерод; он пропускал пары фосфора над прокалённым мелом, в результате чего образовывались фосфат кальция и углерод.
Слайд 5Второй аллотроп углерода — графит — в алхимическом периоде считался видоизменённым
Шееле исследовал графит (1779) и счёл его сернистым телом особого рода, особым минеральным углём, содержащим связанную «воздушную кислоту» (СО2) и большое количество флогистона.
Двадцать лет спустя Гитон де Морво путем осторожного нагревания превратил алмаз в графит, а затем в угольную кислоту.
История
Слайд 6Происхождение названия
В начале XIX века в русской химической литературе иногда применялся
(Шерер, 1807; Севергин, 1815);
с 1824 года Соловьёв ввёл название «углерод». Соединения углерода имеют в названии часть карб(он)- от лат. carbō (род. п. carbōnis) «уголь».
Слайд 7Строение атома
В периодической таблице химических элементов углерод (С) расположен во втором
Углерод (С) — неметалл.
Возможные степени окисления: -4; 0; +2; +4.
Формулы высшего оксида и гидроксида: СО2 и Н2СО3. Оба соединения проявляют кислотные свойства.
Слайд 8Углерод — химический элемент с атомным номером 6 в периодической системе,
Схемы строения различных модификаций углерода
a: алмаз,
b: графен,
c: графит
d: фуллерен — букибол C60,
e: фуллерены C540,
F: карбин,
g: технический углерод,
h: углеродные нанотрубки
Слайд 9Физические свойства
аллотропных модификаций углерода
Алмаз – бесцветное, прозрачное,
Графит – устойчивая при нормальных условиях аллотропная модификация углерода, имеет серо-черный цвет и металлический блеск, кажется жирным на ощупь, очень мягок и оставляет черные следы на бумаге.
Слайд 10Карбин имеет кристаллическую структуру, в которой атомы углерода соединены чередующимися одинарными
Фуллерены – класс химических соединений, молекулы которых состоят только из углерода, число атомов которого четно, от 32 и более 500, они представляют по структуре выпуклые многогранники, построенные из правильных пяти- и шестиугольников.
Молекула наиболее устойчивого фуллерена C60 или футболена, имеет форму футбольного мяча, причем каждый атом углерода занимает позицию в вершине усеченного икосаэдра.
Физические свойства
аллотропных модификаций углерода
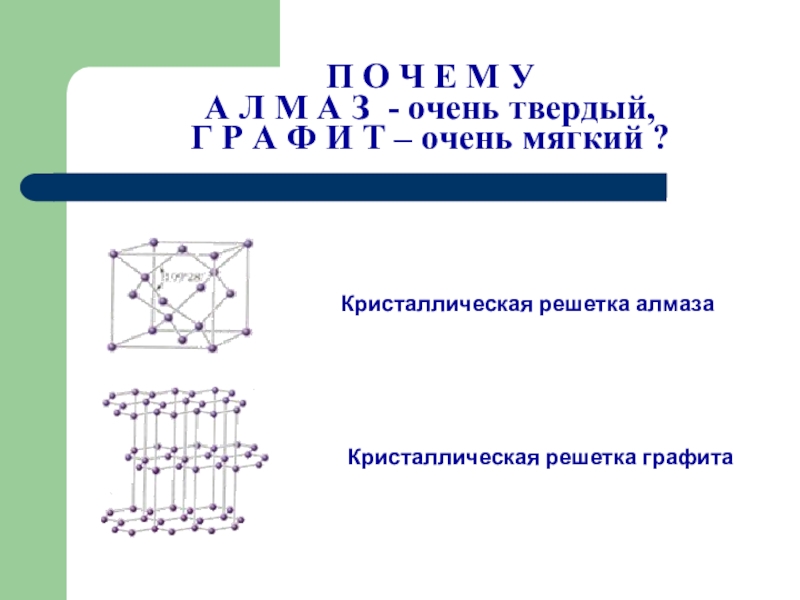
Слайд 11П О Ч Е М У
А Л М А З -
Г Р А Ф И Т – очень мягкий ?
Кристаллическая решетка алмаза
Кристаллическая решетка графита
Слайд 12А Л М А З
Алмаз имеет атомную кристаллическую решетку, в которой
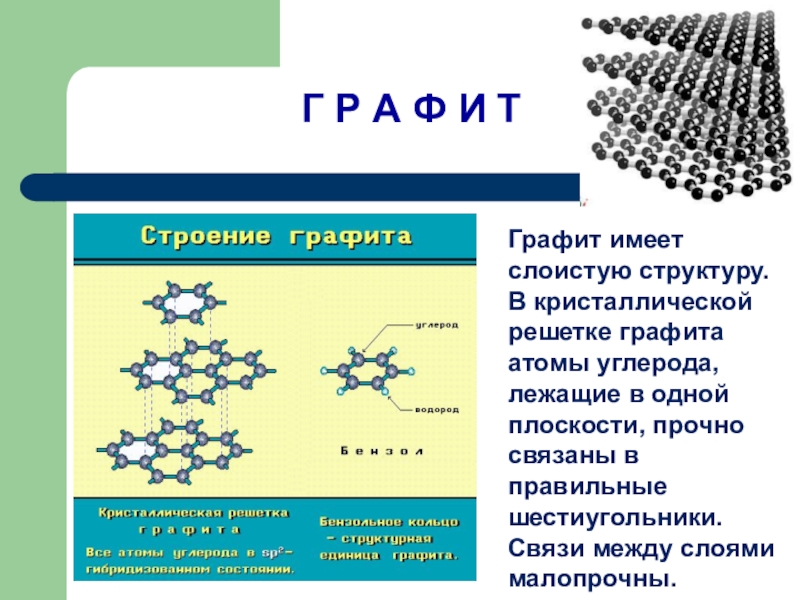
Слайд 13Г Р А Ф И Т
Графит имеет слоистую структуру.
В
Слайд 15Взаимопревращение алмаза и графита
Алмаз
t°=2000°C без доступа воздуха
t°=3000°C,Р=50 тыс. атм.,
катализатор Ni
Графит
Алмазы, полученные
мелкие, невысокого качества. Их используют
в основном для технических целей, а под названием фианиты – для ювелирных украшений.
Слайд 16Сходное с графитом строение
имеют:
Сажа
Древесный уголь
Кокс
типографская краска, картриджи, резина, косметическая тушь
восстановитель
твердое топливо, адсорбент для очистки газов и жидкостей
Слайд 17Аморфный углерод
Активированный уголь
Древесный уголь
Ископаемый уголь: антрацит и др.
Кокс каменноугольный, нефтяной и др.
Стеклоуглерод
Техуглерод
Сажа
Углеродная нанопена
На практике, как правило, перечисленные аморфные
В основе строения аморфного углерода лежит разупорядоченная структура монокристаллического (всегда содержит примеси) графита.
Слайд 18Изотопы углерода
Природный углерод состоит из двух стабильных изотопов
На образовании и распаде 14С основан метод радиоуглеродного датирования, широко применяющийся в геологии и археологии.
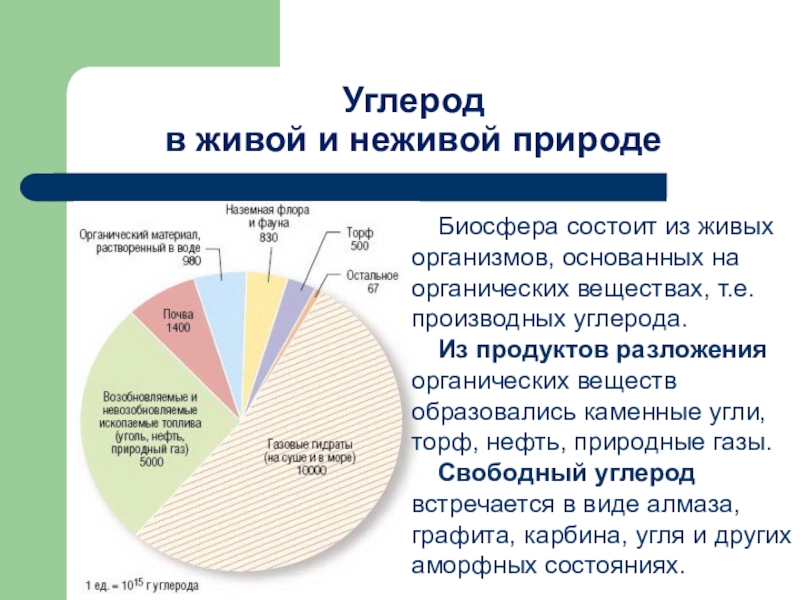
Слайд 19Углерод
в живой и неживой природе
Биосфера состоит
Из продуктов разложения органических веществ образовались каменные угли, торф, нефть, природные газы.
Свободный углерод встречается в виде алмаза, графита, карбина, угля и других аморфных состояниях.
Слайд 20Нахождение в природе
Свободный углерод находится в природе
бурые угли (64—80 % С), каменные угли (76—95 %), горючие сланцы (56—78 % С), нефть (82—87 % С), горючих природных газов (до 99 % метана), торф (53—56 % С), а также битумы и др.
В атмосфере и гидросфере находится в виде диоксида углерода СО2, в воздухе 0,046 % СО2 по массе, в водах рек, морей и океанов в ~60 раз больше. Углерод входит в состав растений и животных (~18 %).
Содержание углерода в земной коре 0,1 % по массе.
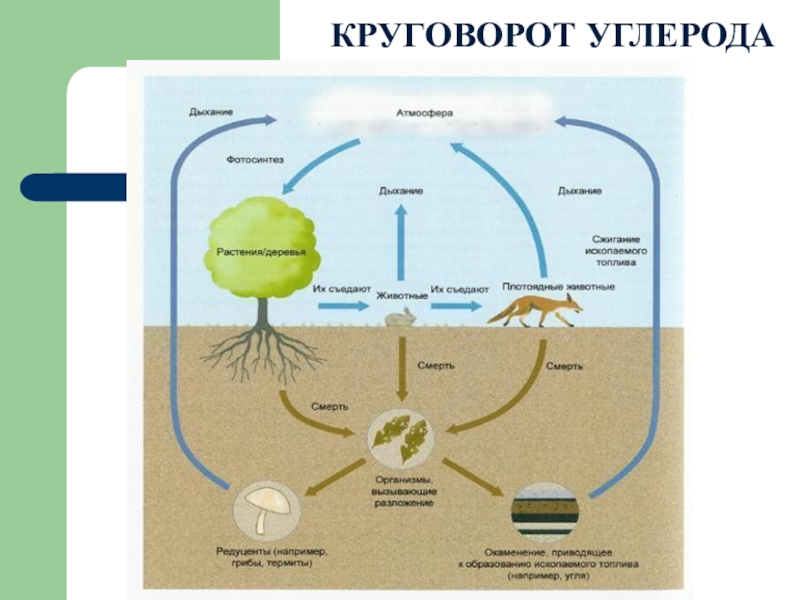
Слайд 22Углерод — основа жизни.
Углерод является основой
Источником углерода для живых организмов обычно является СО2 из атмосферы или воды. В результате фотосинтеза он попадает в биологические пищевые цепи, в которых живые существа поедают друг друга или останки друг друга и тем самым добывают углерод для строительства собственного тела. Биологический цикл углерода заканчивается либо окислением и возвращением в атмосферу, либо захоронением в виде угля или нефти.
Слайд 24Алмаз, благодаря исключительной твёрдости, незаменимый абразивный материал. Алмазным напылением обладают шлифовальные насадки бормашин.
Применение алмазов
Слайд 27Г Р А Ф И Т
Применение графита:
Электроды для электролиза
Облицовка
Смазка для трущихся поверхностей, работающих при очень высоких и очень низких температурах
Стержни для карандашей
Замедлители нейтронов в ядерных реакторах
Слайд 28 В фармакологии и медицине широко используются
Углерод играет огромную роль в жизни человека. Его применения столь же разнообразны, как сам этот многоликий элемент. В частности углерод является неотъемлемой составляющей стали (до 2,14 % масс.) и чугуна (более 2,14 % масс.)
Углерод в жизни человека:
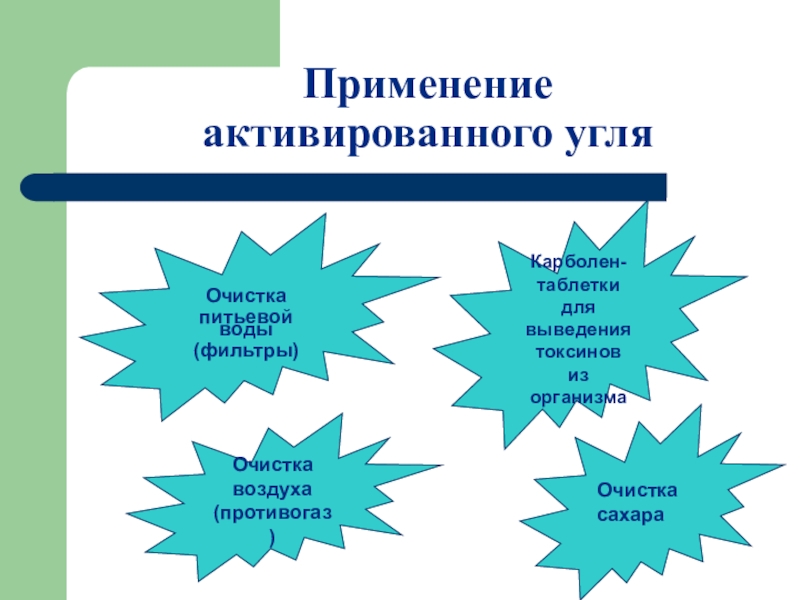
Слайд 29Применение
активированного угля
Очистка
питьевой воды
(фильтры)
Карболен-
таблетки для
выведения
токсинов
из организма
Очистка
воздуха
(противогаз)
Слайд 30Угольные фильтры
В бытовых фильтрах, в промышленном производстве, на очистных сооружениях –
Слайд 32Ответьте на вопросы:
Что такое аллотропные видоизменения?
Какие аллотропные видоизменения углерода вы знаете?
Чем
Как доказать, что алмаз и графит являются модификациями одного химического элемента?
Где находят применение алмаз и графит?
Перечислите аморфные углероды. В чем их отличие от аллотропных модификаций углерода?
Объясните фразу «Углерод – основа жизни».
В виде каких соединений в природе встречается углерод?
Где используют активированный уголь?