- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Строение атома
Содержание
- 1. Презентация по химии на тему Строение атома
- 2. АТОМ (греч: atomos – неделимый) –
- 3. Протон p⁺ - частица в составе ядра,
- 4. Слайд 4
- 5. Так как атом - электронейтральная частица,
- 6. Слайд 6
- 7. Химический элемент – вид атомов с
- 8. Слайд 8
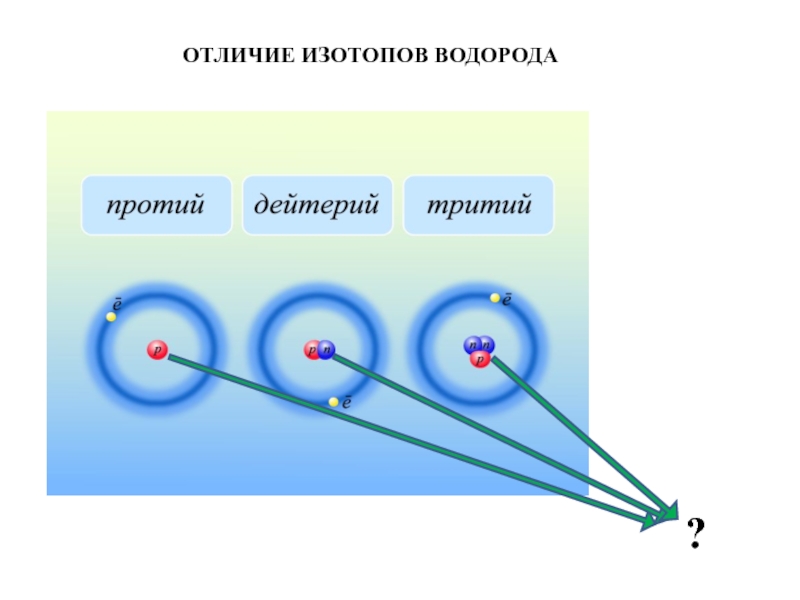
- 9. ОТЛИЧИЕ ИЗОТОПОВ ВОДОРОДА?
- 10. ЭЛЕКТРОННОЕ СТРОЕНИЕЭлектрон — уникальная элементарная частица: обладая свойствами,
- 11. Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона называется электронной орбиталью.
- 12. КВАНТОВЫЕ ЧИСЛАСостояние электрона в атоме описывается 4
- 13. ГЛАВНОЕ КВАНТОВОЕ ЧИСЛО - n.Главное квантовое число -
- 14. ОРБИТАЛЬНОЕ КВАНТОВОЕ ЧИСЛО lОпределяет геометрическую форму атомной
- 15. МАГНИТНОЕ КВАНТОВОЕ ЧИСЛО определяет ориентацию орбитали в
- 16. Для s-орбитали:l=0, ml= 1(0) - одна равноценная
- 17. СПИНОВОЕ КВАНТОВОЕ ЧИСЛО – MSНа каждой орбитали
- 18. Следовательно, электроны в электронной оболочке занимают определенные
- 19. Подуровни состоят из одной или нескольких одинаковых
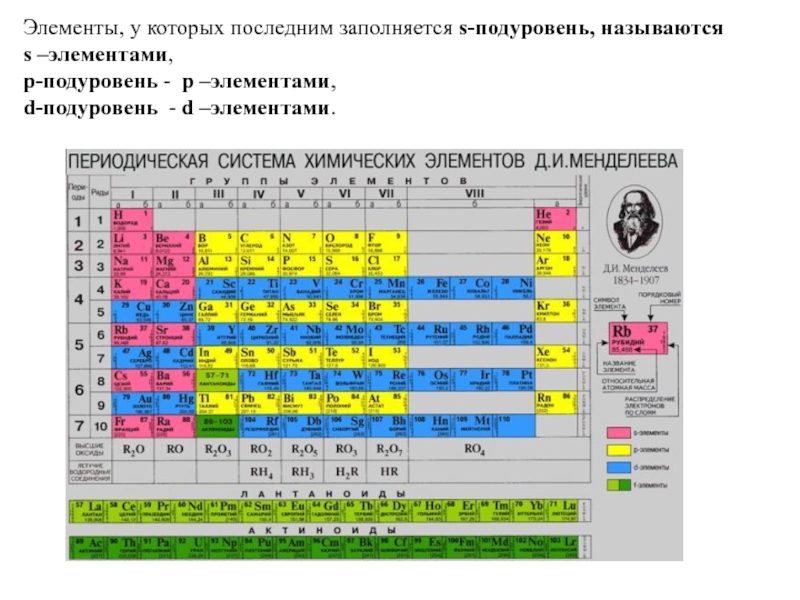
- 20. Элементы, у которых последним заполняется s-подуровень, называются
- 21. ПРИНЦИПЫ ПОСТРОЕНИЯ ЭЛЕКТРОННОЙ КОНФИГУРАЦИИ ЭЛЕМЕНТАКоличество электронов в
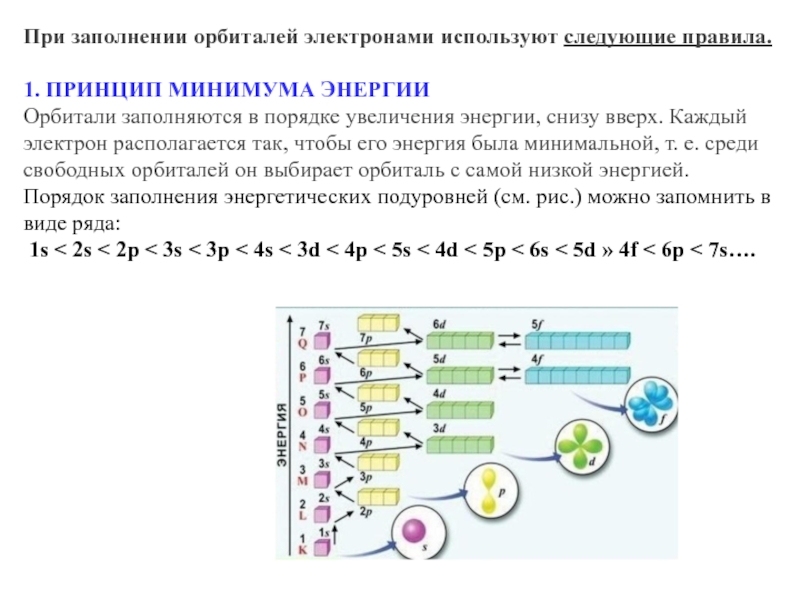
- 22. При заполнении орбиталей электронами используют следующие правила.1.
- 23. 2. ПРИНЦИП ПАУЛИНа каждой орбитали может находиться
- 24. ПРАВИЛО ХУНДА (ГУНДА)Атом в основном состоянии должен
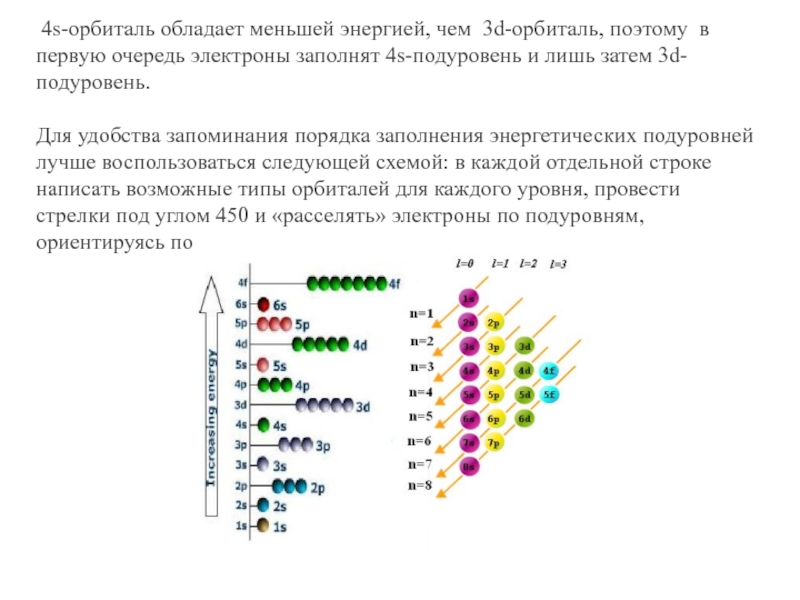
- 25. 4s-орбиталь обладает меньшей энергией, чем 3d-орбиталь,
- 26. ЗАПИСЬ ЭЛЕКТРОННОЙ КОНФИГУРАЦИИ АТОМАПодробные электронные конфигурации атомов
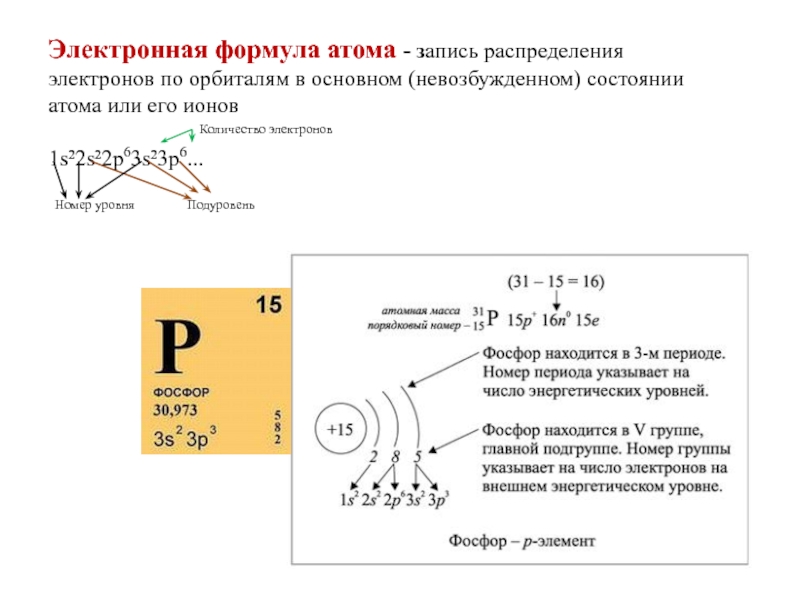
- 27. Электронная формула атома - запись распределения электронов
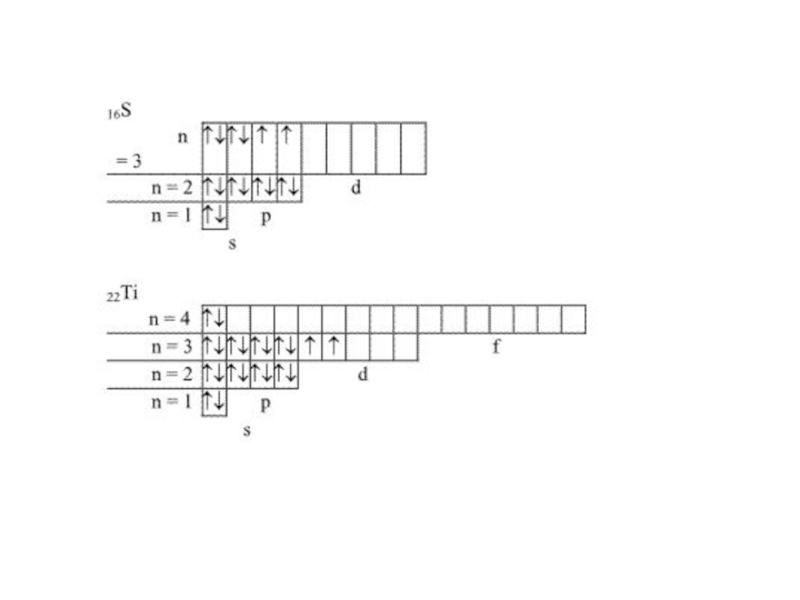
- 28. На схеме орбитали обозначают в виде ячеек:
- 29. Слайд 29
- 30. Последовательность заполнения орбиталей и максимальное число электронов на каждом подуровне:1s22s22p63s23p64s23d104p65s24d105p66s24f145d104p65p67s25f146d107p6
- 31. Слайд 31
- 32. «ПРОСКОК» ИЛИ «ПРОВАЛ» ЭЛЕКТРОНАУ атомов Cr, Cu,
- 33. ВОЗБУЖДЕННОЕ СОСТОЯНИЕ АТОМАВсе электронные конфигурации, о которых
- 34. Слайд 34
- 35. ВАЛЕНТНЫЕ ВОЗМОЖНОСТИВалентность атома определяется числом неспаренных электронов.
- 36. Алюминий в 3 группе – валентность IIIКислород
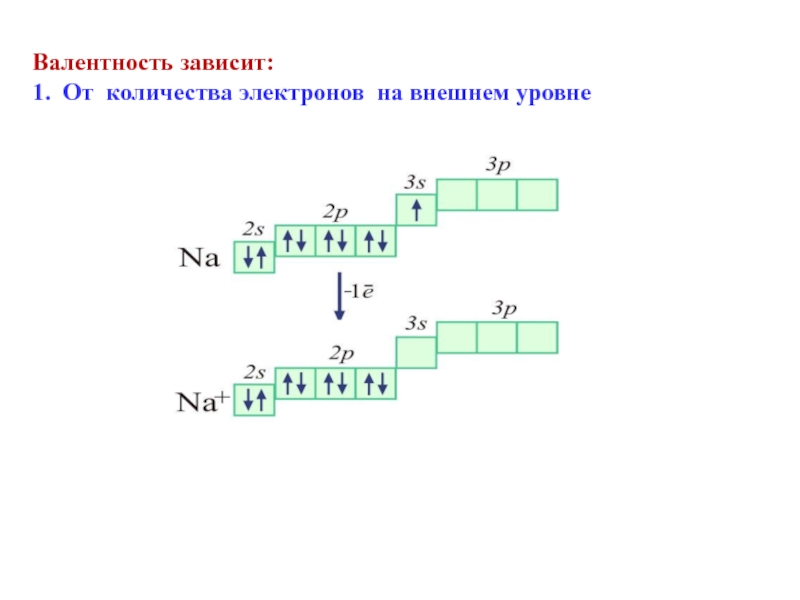
- 37. Валентность зависит:1. От количества электронов на внешнем уровне
- 38. ?????2. От количества свободных неспаренных электронов
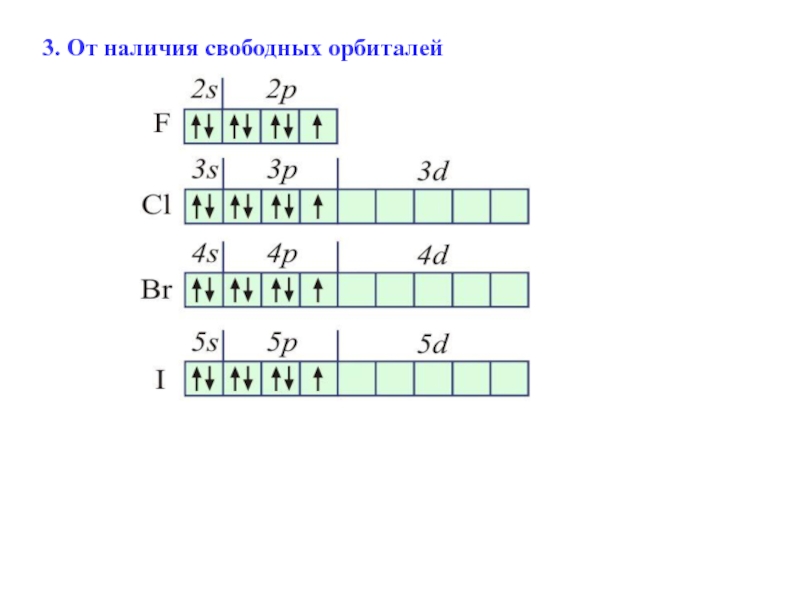
- 39. 3. От наличия свободных орбиталей
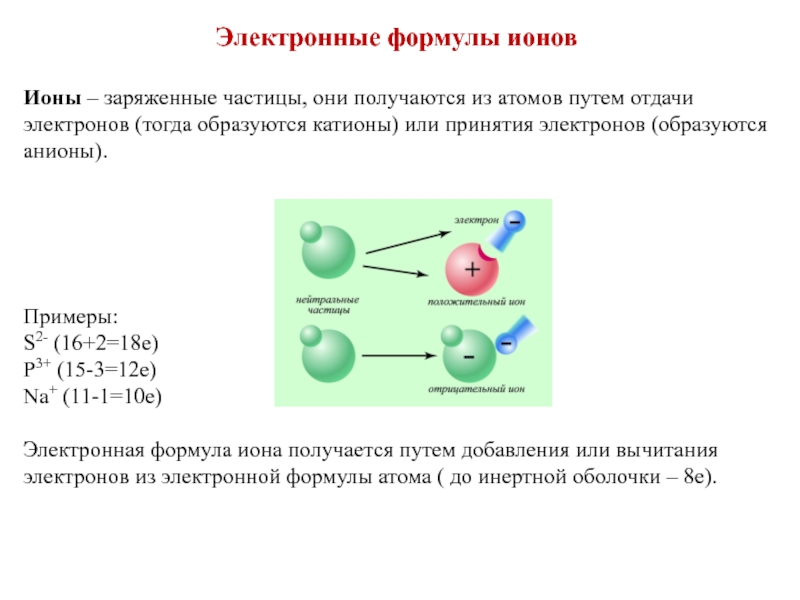
- 40. Электронные формулы ионов Ионы – заряженные частицы,
- 41. Пример: составить электронные формулы ионов: Ca²⁺.1) Ca0
Слайд 11
Строение электронных оболочек атомов элементов первых четырех периодов:
s-,p-и d-элементы.
Электронная конфигурация атома.
Основное и возбужденное состояние атомов
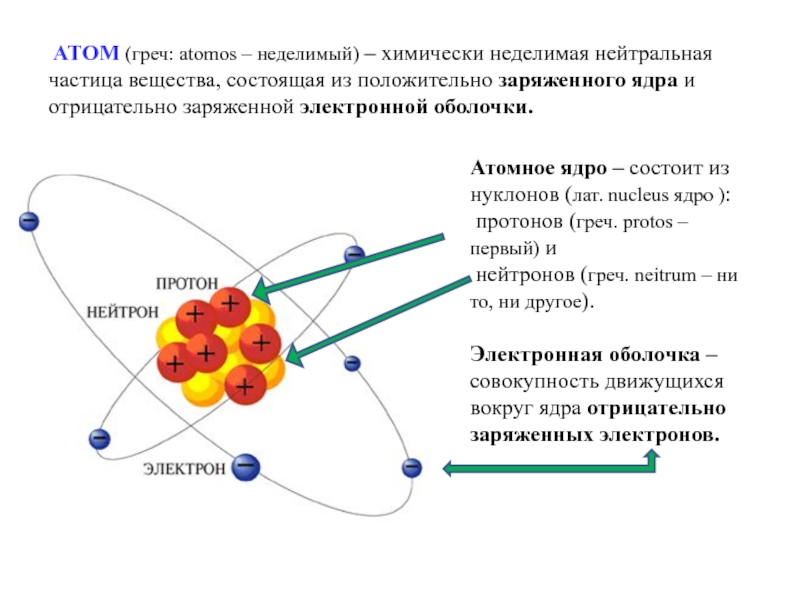
Слайд 2 АТОМ (греч: atomos – неделимый) – химически неделимая нейтральная частица
Атомное ядро – состоит из нуклонов (лат. nucleus ядро ):
протонов (греч. protos – первый) и
нейтронов (греч. neitrum – ни то, ни другое).
Электронная оболочка – совокупность движущихся вокруг ядра отрицательно заряженных электронов.
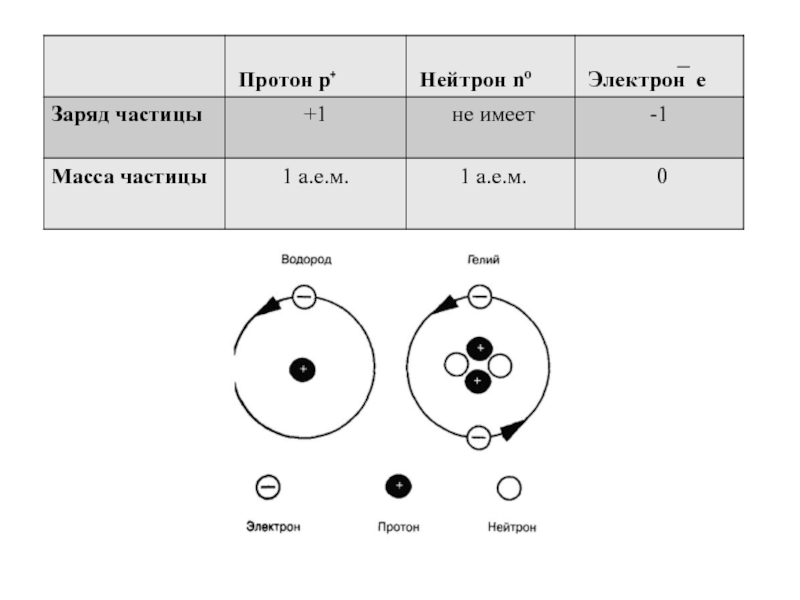
Слайд 3Протон p⁺ - частица в составе ядра, имеет положительный заряд,
относительную
Число протонов равно порядковому номеру и обозначается Z – заряд ядра.
Нейтрон n⁰– частица в составе ядра. Не имеет заряда.
Относительная масса 1,0087.
Число нейтронов обозначается буквой N.
Может меняться в атомах одного и того же элемента.
Электрон е – частица в составе электронной оболочки. Имеет отрицательный заряд, равный по величине, но противоположный по знаку заряду протона. Масса электрона примерно в 2000 раз меньше массы протона и практически не влияет на массу атома.
Слайд 5
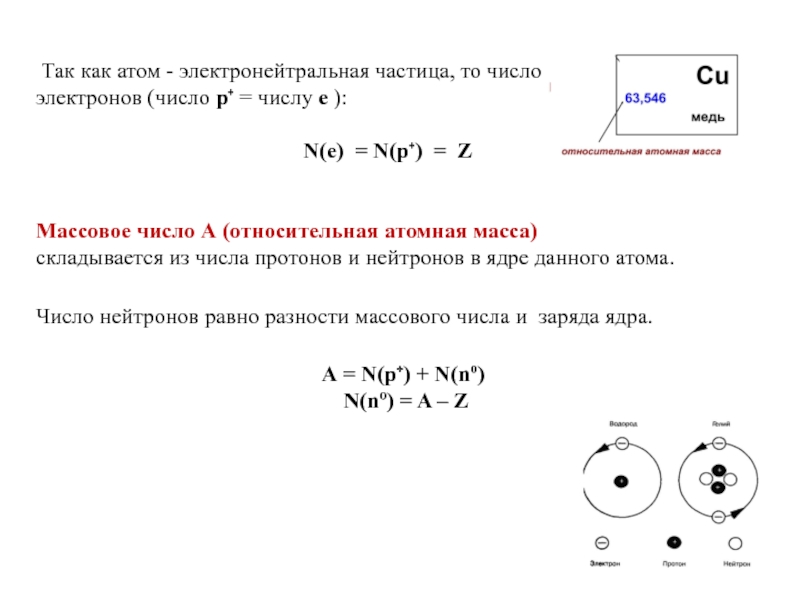
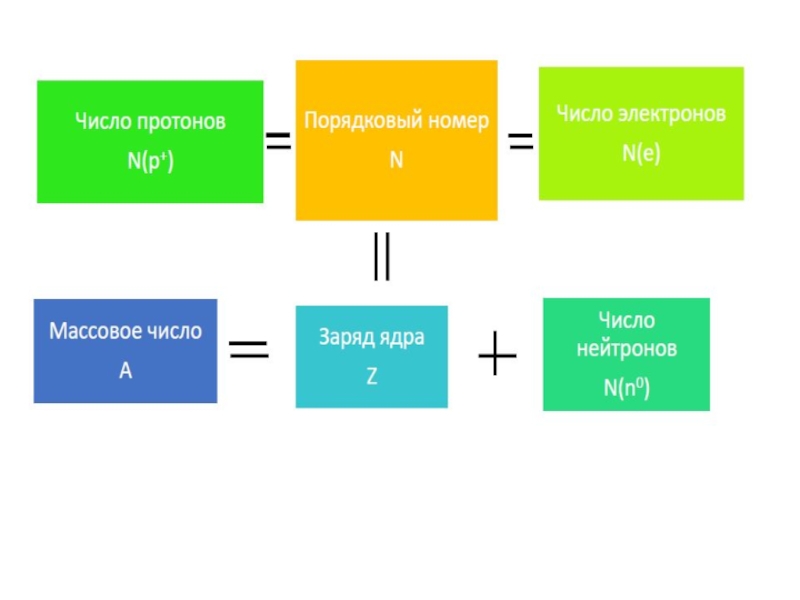
Так как атом - электронейтральная частица, то число протонов равно
N(e) = N(p⁺) = Z
Массовое число А (относительная атомная масса)
складывается из числа протонов и нейтронов в ядре данного атома.
Число нейтронов равно разности массового числа и заряда ядра.
А = N(p⁺) + N(nº)
N(nº) = A – Z
Слайд 7 Химический элемент – вид атомов с определѐнным зарядом ядра (количеством
Количество протонов неизменно, количество нейтронов может меняться.
Атомы с одинаковым зарядом ядра (количеством протонов), но разным числом нейтронов в ядре, т.е. разной массой, называются изотопами (нуклидами).
Один и тот же элемент может существовать в виде двух или нескольких изотопов. Все изотопы одного и того же элемента химически неотличимы.
Слайд 10ЭЛЕКТРОННОЕ СТРОЕНИЕ
Электрон — уникальная элементарная частица: обладая свойствами, отличающими его от всех
С одной стороны, обладая малой массой, электрон проявляет свойства частицы.
С другой стороны, электрон движется с такой высокой скоростью, что фактически «размазан» по атому, он находится не в одной конкретной точке, а образует «электронное облако».
Слайд 11Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона называется электронной
Слайд 12КВАНТОВЫЕ ЧИСЛА
Состояние электрона в атоме описывается 4 квантовыми числами:
Главное квантовое число
Побочное (орбитальное) квантовое число l;
Магнитное квантовое число ml;
Спиновое квантовое число ms.
Слайд 13ГЛАВНОЕ КВАНТОВОЕ ЧИСЛО - n.
Главное квантовое число - n - определяет энергетический
Главное квантовое число принимает любые целочисленные значения, начиная с n=1 (n=1,2,3,…) и соответствует номеру периода.
Слайд 14ОРБИТАЛЬНОЕ КВАНТОВОЕ ЧИСЛО l
Определяет геометрическую форму атомной орбитали.
Принимает любые целочисленные значения
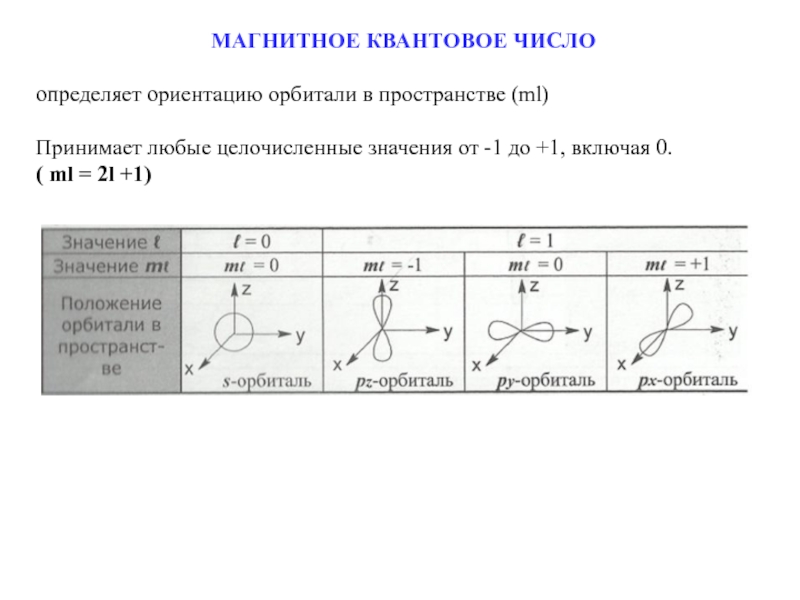
Слайд 15МАГНИТНОЕ КВАНТОВОЕ ЧИСЛО
определяет ориентацию орбитали в пространстве (ml)
Принимает любые целочисленные
( ml = 2l +1)
Слайд 16Для s-орбитали:
l=0, ml= 1(0) - одна равноценная ориентация в пространстве (одна
Для p-орбитали:
l=1, ml= 3 (-1,0,+1) - три равноценные ориентации в пространстве (три орбитали).
Для d-орбитали:
l=2, ml= 5 (-2,-1,0,1,2) - пять равноценных ориентаций в пространстве (пять орбиталей).
Для f-орбитали:
l=3, ml= 7 (-3,-2,-1,0,1,2,3) - семь равноценных ориентаций в пространстве (семь орбиталей).
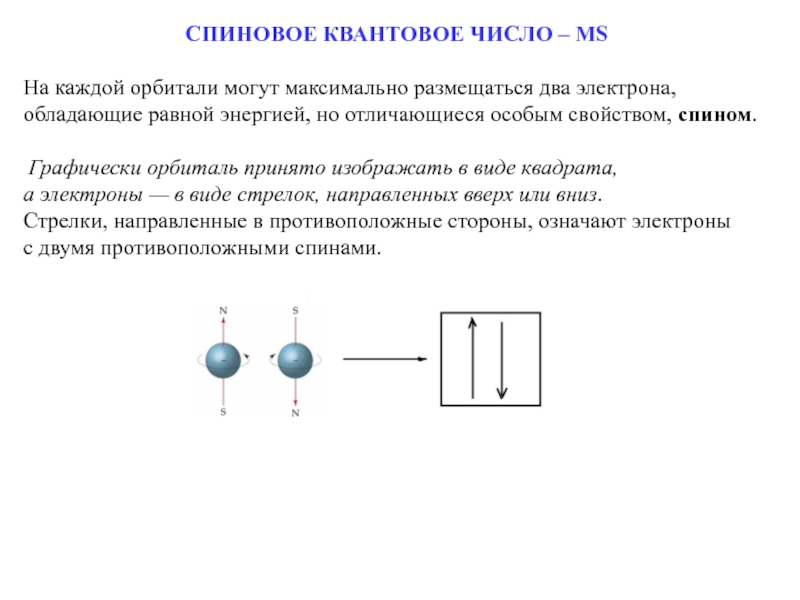
Слайд 17СПИНОВОЕ КВАНТОВОЕ ЧИСЛО – MS
На каждой орбитали могут максимально размещаться два электрона,
обладающие равной энергией, но отличающиеся особым свойством, спином.
Графически орбиталь принято изображать в виде квадрата,
а электроны — в виде стрелок, направленных вверх или вниз.
Стрелки, направленные в противоположные стороны, означают электроны
с двумя противоположными спинами.
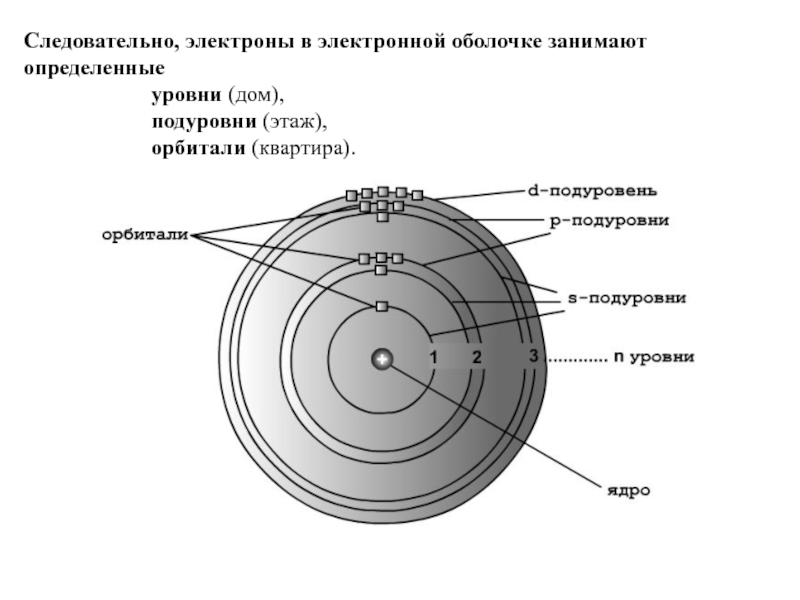
Слайд 18Следовательно, электроны в электронной оболочке занимают определенные
подуровни (этаж),
орбитали (квартира).
Слайд 19
Подуровни состоят из одной или нескольких одинаковых по энергии орбиталей.
На
На
s-подуровне (одна орбиталь) могут находиться два электрона,
p-подуровне (три орбитали) - шесть электронов ,
d-подуровне (пять орбиталей) - десять электронов.
Слайд 20Элементы, у которых последним заполняется s-подуровень, называются
p-подуровень - p –элементами,
d-подуровень - d –элементами.
Слайд 21ПРИНЦИПЫ ПОСТРОЕНИЯ ЭЛЕКТРОННОЙ КОНФИГУРАЦИИ ЭЛЕМЕНТА
Количество электронов в атоме элемента равно его
Количество энергетических уровней атома равно номеру периода, в котором расположен элемент.
Количество электронов на внешнем (валентном) уровне равно номеру группы, в которой расположен элемент.
При более подробном описании электронной конфигурации рассматривают не только количество электронов на данном энергетическом уровне, но и их распределение по подуровням. Каждая незаполненная орбиталь обозначается пустым квадратиком.
Слайд 22При заполнении орбиталей электронами используют следующие правила.
1. ПРИНЦИП МИНИМУМА ЭНЕРГИИ
Орбитали заполняются
Порядок заполнения энергетических подуровней (см. рис.) можно запомнить в виде ряда: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d » 4f < 6p < 7s….
Слайд 232. ПРИНЦИП ПАУЛИ
На каждой орбитали может находиться не более двух электронов.
Слайд 24ПРАВИЛО ХУНДА (ГУНДА)
Атом в основном состоянии должен иметь максимально возможное число
Слайд 25 4s-орбиталь обладает меньшей энергией, чем 3d-орбиталь, поэтому в первую очередь
Для удобства запоминания порядка заполнения энергетических подуровней лучше воспользоваться следующей схемой: в каждой отдельной строке написать возможные типы орбиталей для каждого уровня, провести стрелки под углом 450 и «расселять» электроны по подуровням, ориентируясь по стрелкам сверху вниз.
Слайд 26ЗАПИСЬ ЭЛЕКТРОННОЙ КОНФИГУРАЦИИ АТОМА
Подробные электронные конфигурации атомов изображают двумя способами:
графически, с
в строчку, когда перечисляются все занятые энергетические подуровни с указанием общего числа электронов на каждом из них.
Слайд 27Электронная формула атома - запись распределения электронов по орбиталям в основном
1s²2s²2p63s²3p6...
Количество электронов
Номер уровня
Подуровень
Слайд 28
На схеме орбитали обозначают в виде ячеек: ,
а электроны -
Электронно –графическая схема
Слайд 30Последовательность заполнения орбиталей и максимальное число электронов на каждом подуровне:
1s22s22p63s23p64s23d104p65s24d105p66s24f145d104p65p67s25f146d107p6
Слайд 32«ПРОСКОК» ИЛИ «ПРОВАЛ» ЭЛЕКТРОНА
У атомов Cr, Cu, Nb, Mo, Ru, Rh,
Особо следует отметить палладий, у которого «проваливаются» два электрона: Pd 1s22s22p63s23p64s23d104p65s04d10
.
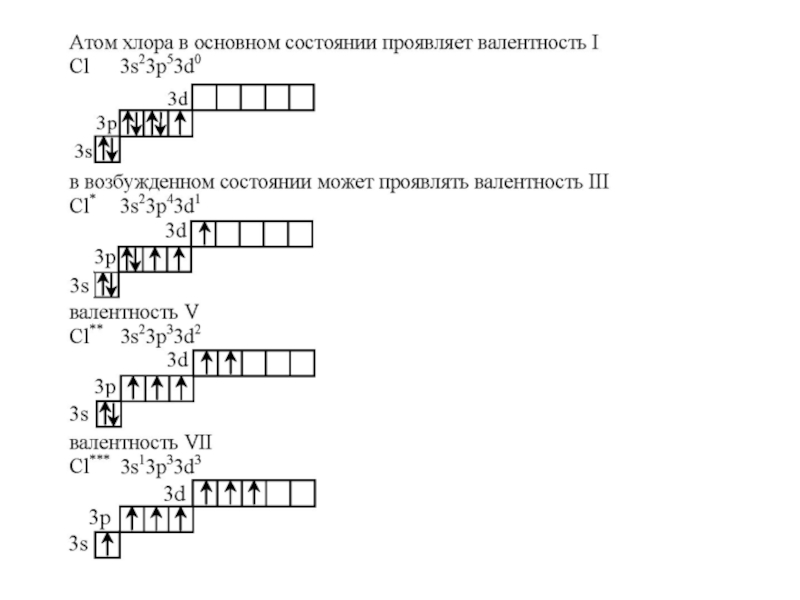
Слайд 33ВОЗБУЖДЕННОЕ СОСТОЯНИЕ АТОМА
Все электронные конфигурации, о которых мы говорили выше, являются
Получив энергию извне (облучение или нагревание системы), один либо несколько электронов могут переходить на более высокий энергетический подуровень.
Состояние атома, при котором электрон из электронной пары с предыдущего подуровня «распаривается» и переходит на следующий подуровень, называется возбужденным состоянием атома.
Слайд 35ВАЛЕНТНЫЕ ВОЗМОЖНОСТИ
Валентность атома определяется числом неспаренных электронов.
При наличии свободных орбиталей
Высшая валентность всегда равна номеру группы.
Для определения низшей переменной валентности (количества свободных электронов) , которой чаще всего обладают неметаллы, необходимо из 8 вычесть номер группы.
Слайд 36Алюминий в 3 группе – валентность III
Кислород в 6 группе –
В кислородсодержащих бинарных соединениях проявляется высшая или
промежуточная валентность,
в водородных соединениях неметаллов – низшая валентность.
Слайд 40Электронные формулы ионов
Ионы – заряженные частицы, они получаются из атомов
Примеры:
S2- (16+2=18е)
P3+ (15-3=12е)
Na+ (11-1=10е)
Электронная формула иона получается путем добавления или вычитания электронов из электронной формулы атома ( до инертной оболочки – 8е).
Слайд 41Пример: составить электронные формулы ионов: Ca²⁺.
1) Ca0 1s22s22p63s23p64s2 (20е)
(ушли 2 внешних электрона – 18е,
конфигурация инертного газа аргона)
Изоэлектронные частицы – это атомы и ионы, имеющие одинаковое строение электронной оболочки.
Например, ион Ca2+ и атом аргона – имеют одинаковую 18- электронную оболочку.