г.Семенов
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Строение электронной оболочки
Содержание
- 1. Презентация по химии на тему Строение электронной оболочки
- 2. ЯдроЭлектронные слои (энергетические уровни - n) –
- 3. Энергетические уровни состоят из подуровней: S, p,
- 4. Энергетические уровни, содержащие максимальное число электронов, называются
- 5. Запомните!Электроны, расположенные на последней электронной оболочке, называются
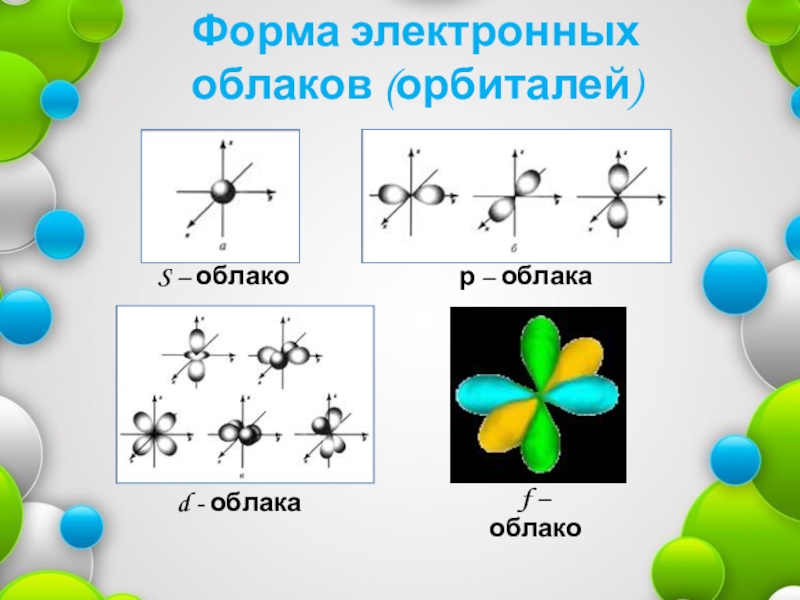
- 6. Форма электронных облаков (орбиталей)S – облакор – облакаd - облакаf – облако
- 7. Упрощенная схема строения электронных оболочекОбщее число электронов
- 8. Домашнее задание§ 6, стр 23 упр.2Изобразите схемы строения атома с атомным номером 19,37,56
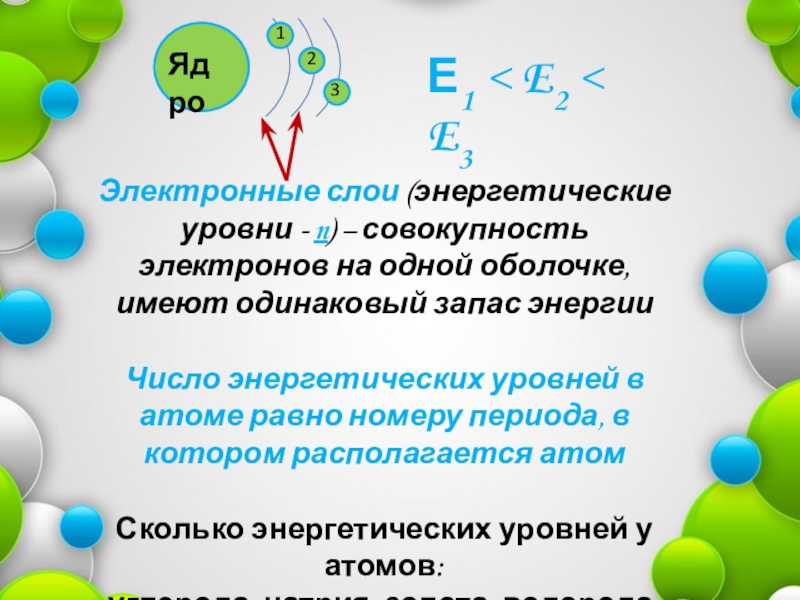
ЯдроЭлектронные слои (энергетические уровни - n) – совокупность электронов на одной оболочке, имеют одинаковый запас энергииЧисло энергетических уровней в атоме равно номеру периода, в котором располагается атомСколько энергетических уровней у атомов:углерода, натрия, золота, водорода, железа?Е1 <
Слайд 1Строение электронной оболочки атома
Выполнил учитель химии
Бербер Мария Леонидовна
МБОУ «Школа №3»
Слайд 2Ядро
Электронные слои (энергетические уровни - n) – совокупность электронов на одной
оболочке, имеют одинаковый запас энергии
Число энергетических уровней в атоме равно номеру периода, в котором располагается атом
Сколько энергетических уровней у атомов:
углерода, натрия, золота, водорода, железа?
Число энергетических уровней в атоме равно номеру периода, в котором располагается атом
Сколько энергетических уровней у атомов:
углерода, натрия, золота, водорода, железа?
Е1 < E2 < E3
Слайд 3Энергетические уровни состоят из подуровней: S, p, d, f
Число подуровней на
уровне равно номеру уровня
Подуровни состоят из орбиталей. Число орбиталей на уровне - n2
Максимальное число электронов на энергетическом уровне определяется по формуле N= 2n2
Подуровни состоят из орбиталей. Число орбиталей на уровне - n2
Максимальное число электронов на энергетическом уровне определяется по формуле N= 2n2
n=1
n=2
n=3
n=4
n=5
n=6
n=7
S
p
d
f
S
S
S
p
p
d
Слайд 4Энергетические уровни, содержащие максимальное число электронов, называются завершенными. Они обладают повышенной
устойчивостью и стабильностью
Энергетические уровни, содержащие меньшее число электронов, называются незавершенными
n=1 – 1 подуровень (S), 2 электрона
n=2 – 2 подуровня (S, р), 8 электронов
n=3 – 3 подуровня (S, р, d), 18 электронов
n=4 – 4 подуровня (S, р, d, f), 32 электрона
Энергетические уровни, содержащие меньшее число электронов, называются незавершенными
n=1 – 1 подуровень (S), 2 электрона
n=2 – 2 подуровня (S, р), 8 электронов
n=3 – 3 подуровня (S, р, d), 18 электронов
n=4 – 4 подуровня (S, р, d, f), 32 электрона
Слайд 5Запомните!
Электроны, расположенные на последней электронной оболочке, называются внешними.
Число внешних электронов для
химических элементов главных подгрупп равно номеру группы, в которой находится элемент
Слайд 7Упрощенная схема строения электронных оболочек
Общее число электронов в атоме равно заряду
атома, т.е. атомному номеру элемента
Максимальное число электронов на каждом энергетическом уровне равно
На внешнем энергетическом уровне может находиться не более восьми электронов, а на первом – не более двух электронов
Схему расположения электронов по электронным слоям, или энергетическим уровням, называют электронной схемой(электронной конфигурацией) атома.
Максимальное число электронов на каждом энергетическом уровне равно
На внешнем энергетическом уровне может находиться не более восьми электронов, а на первом – не более двух электронов
Схему расположения электронов по электронным слоям, или энергетическим уровням, называют электронной схемой(электронной конфигурацией) атома.