- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Строение электронных оболочек атомов
Содержание
- 1. Презентация по химии на тему Строение электронных оболочек атомов
- 2. Цель урока: Формирование умения составлять схемы
- 3. Э -1. Л/О «Моделирование принципа сканирующего микроскопа» стр.48Домашний
- 4. Этап -I. Проверка домашнего задания 1.Упр.3,4 после §
- 5. Этап -2. Строение электронных оболочек атомов. Электроны, вращаясь
- 6. Записи в тетради. Схемы строения электронных оболочек
- 7. Записи в тетради. Схемы строения электронных оболочек
- 8. Электронное облако, или орбиталь – пространство вокруг
- 9. 2 ē6 ēs-орбиталь— сферическая формаНа каждой орбитали
- 10. Максимальное число электронов на энергетическом уровне2 n2n
- 11. Для составления схемы строения электронных оболочек
- 12. Составить электронные схемы строения атомов (стр.55):
- 13. Строение электронных оболочек атомов.
- 14. Строение электронных оболочек атомов.
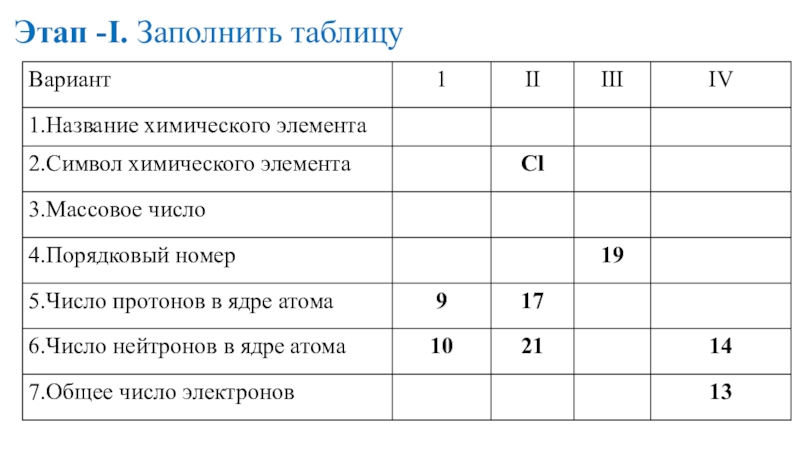
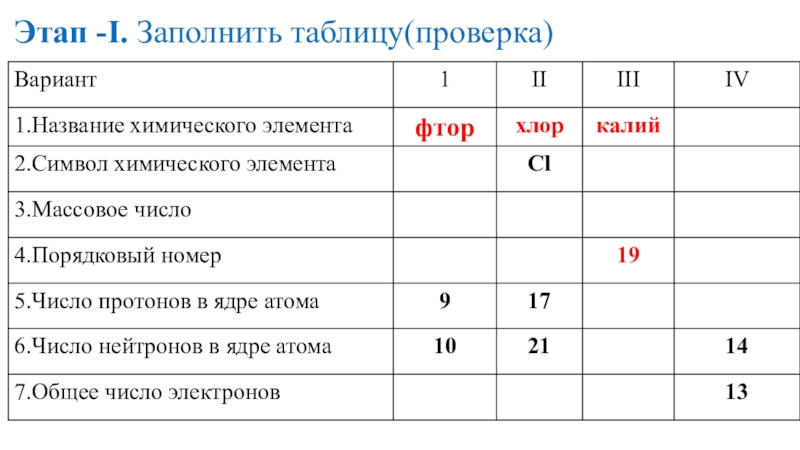
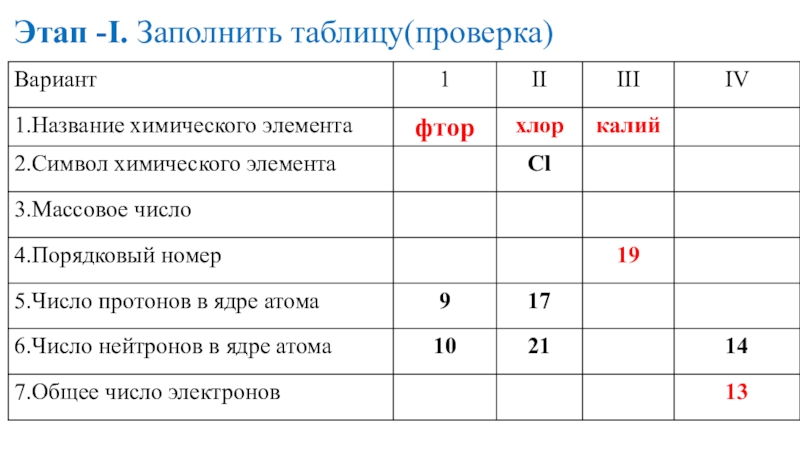
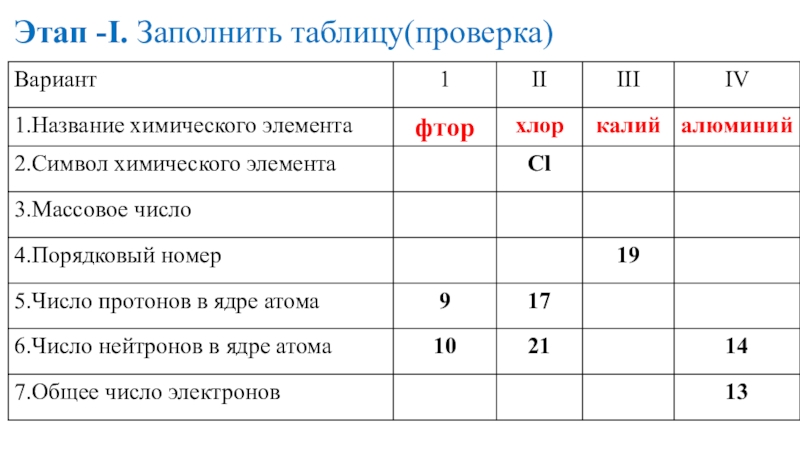
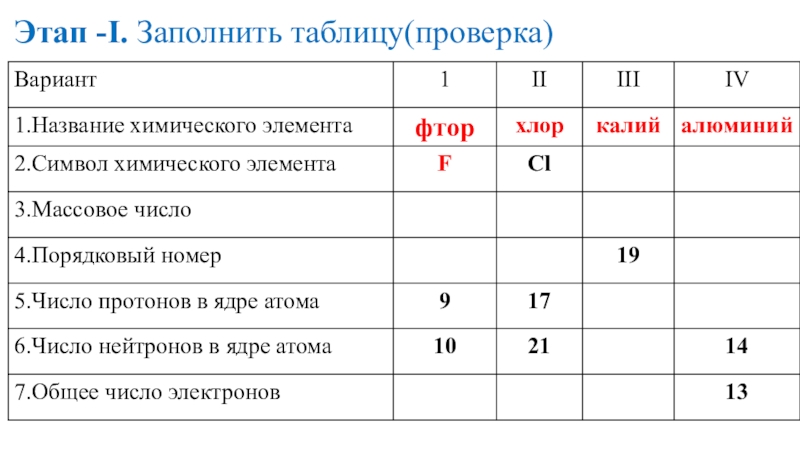
- 15. Этап -I. Заполнить таблицу
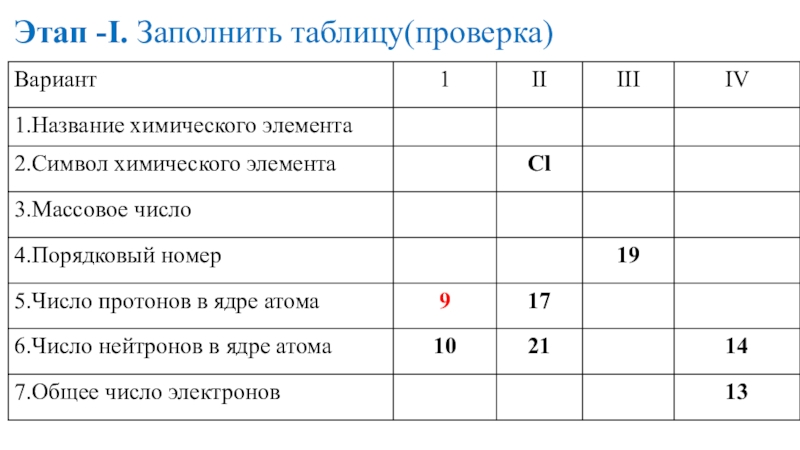
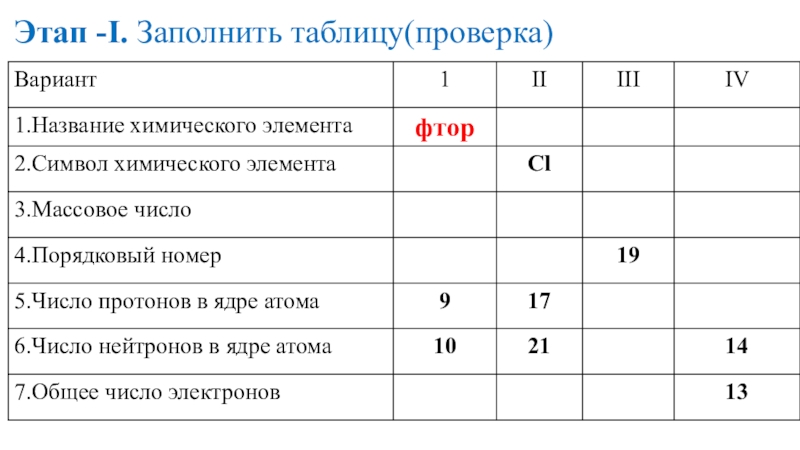
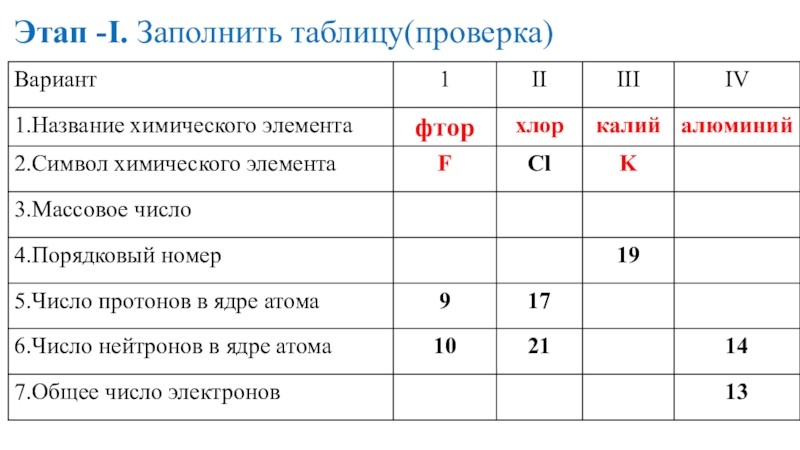
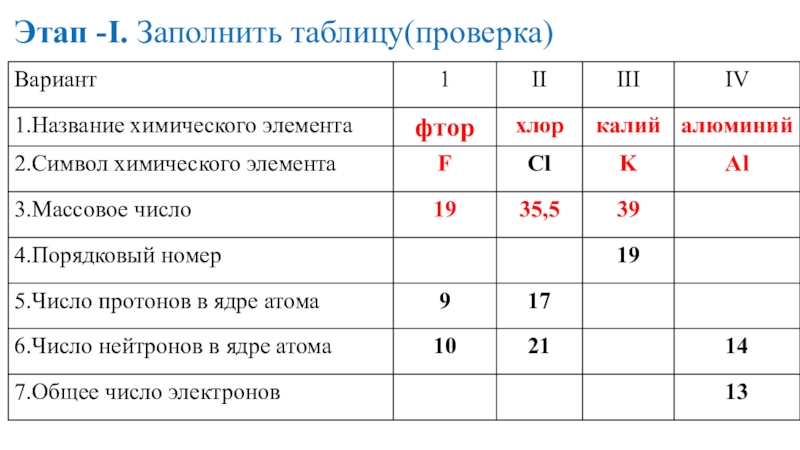
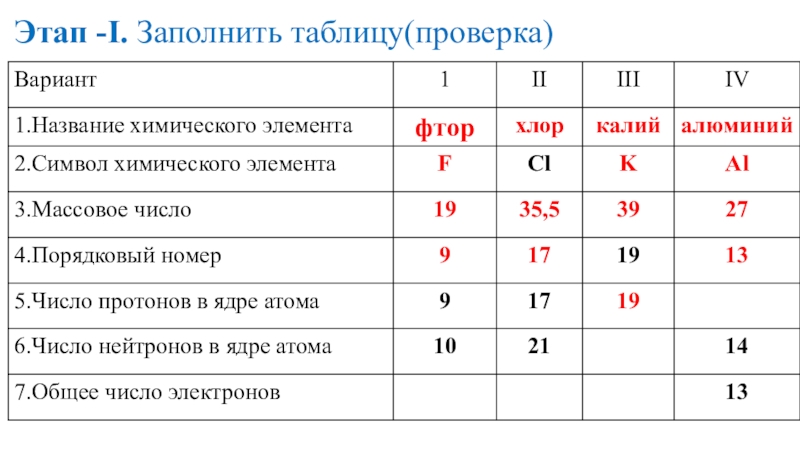
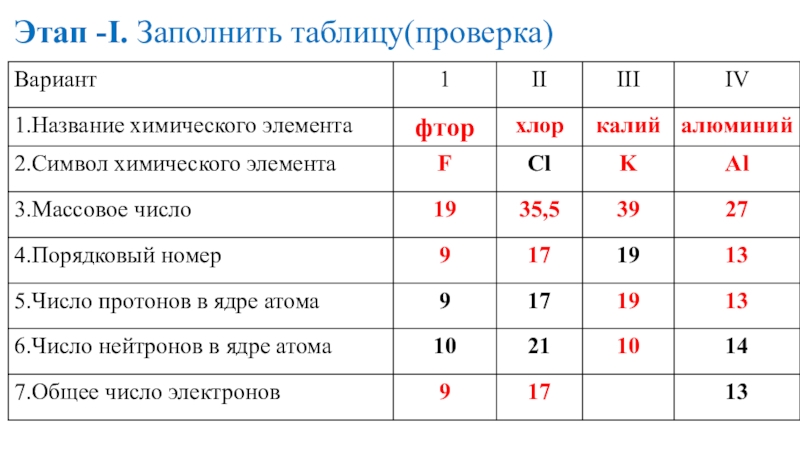
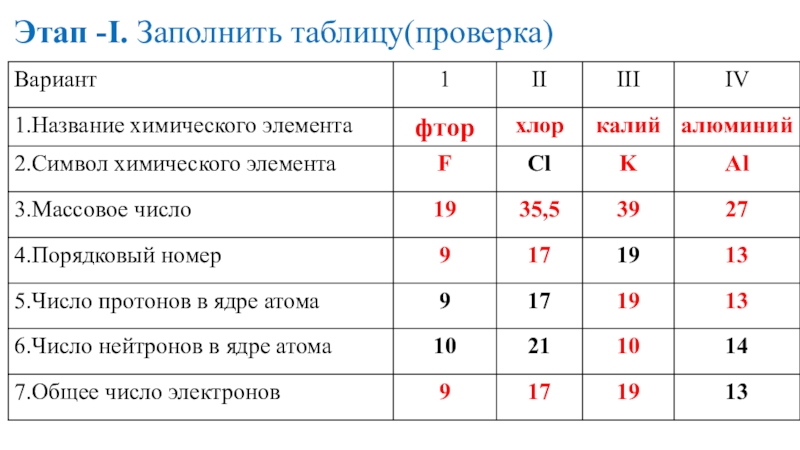
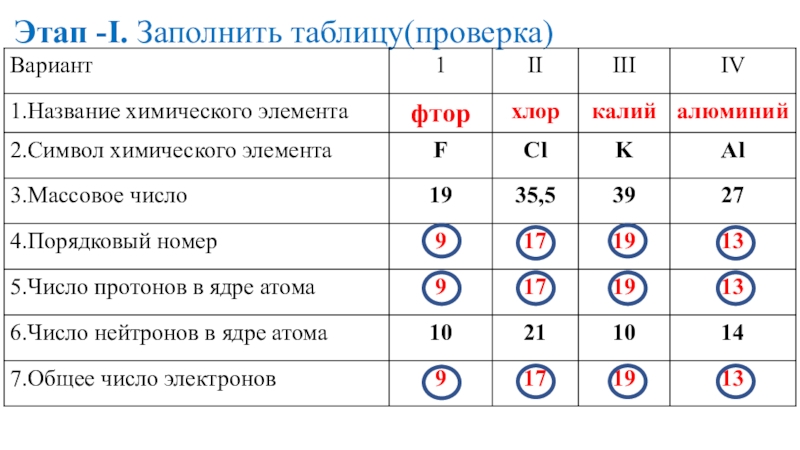
- 16. Этап -I. Заполнить таблицу(проверка)
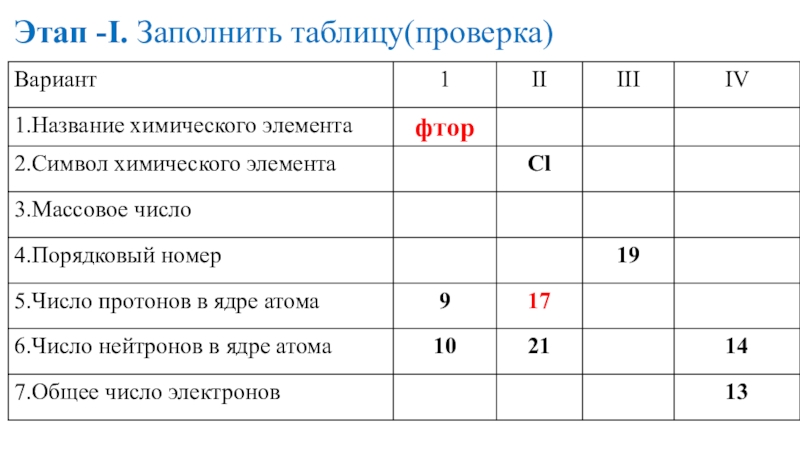
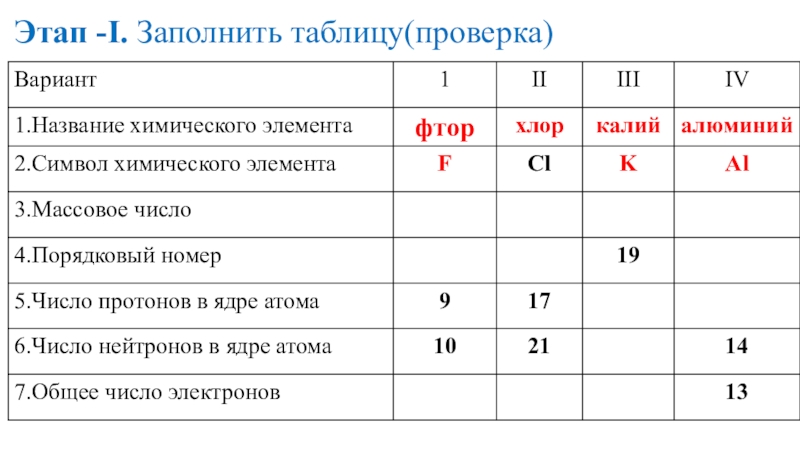
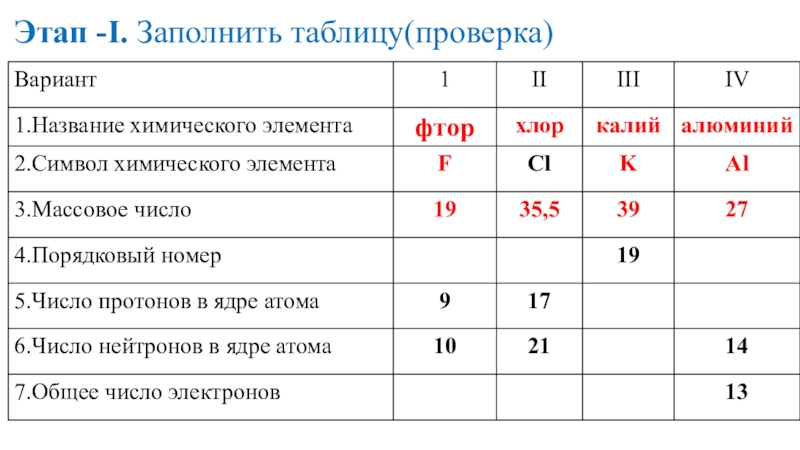
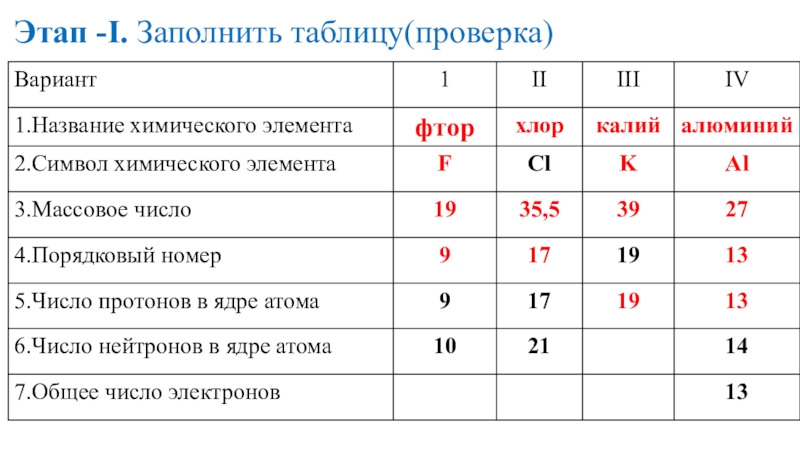
- 17. Этап -I. Заполнить таблицу(проверка)
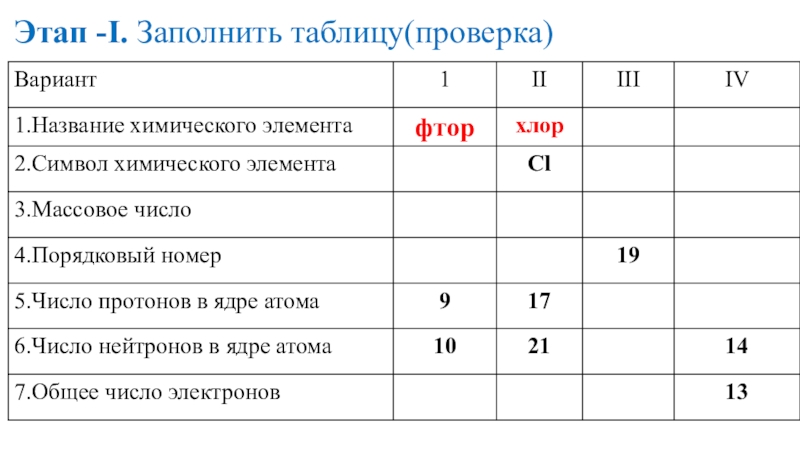
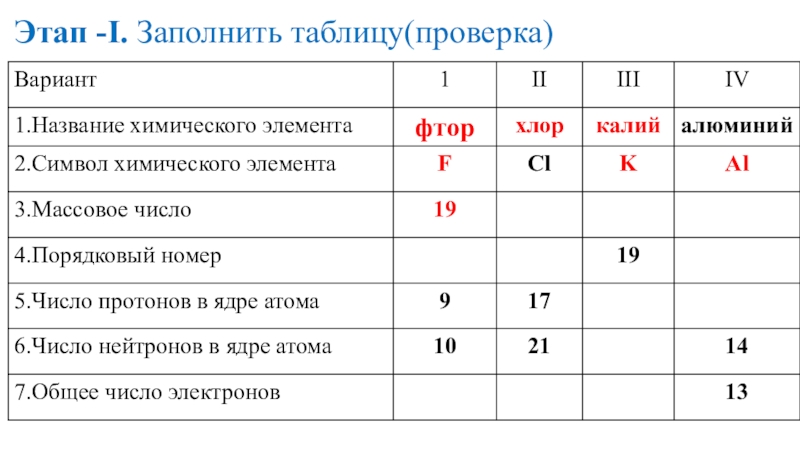
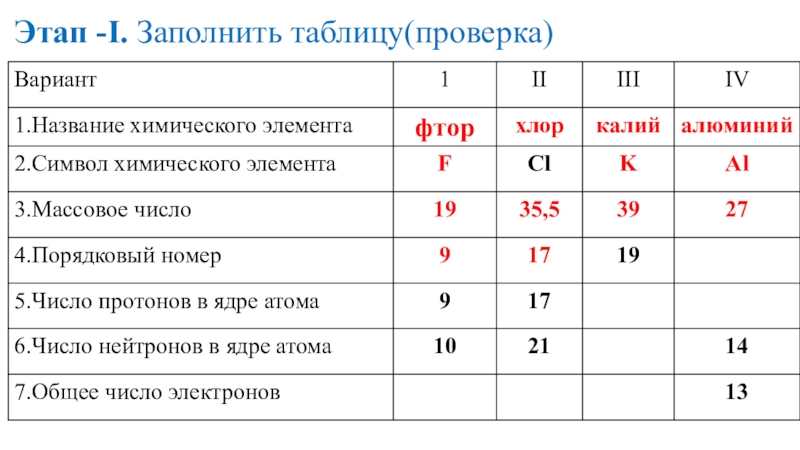
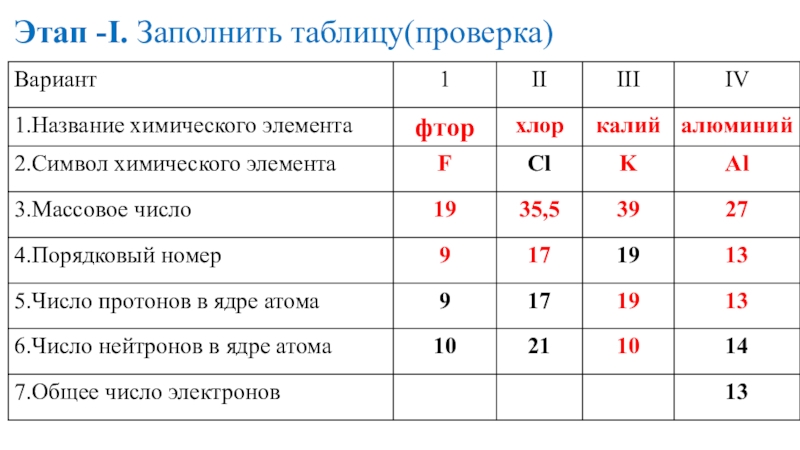
- 18. Этап -I. Заполнить таблицу(проверка)
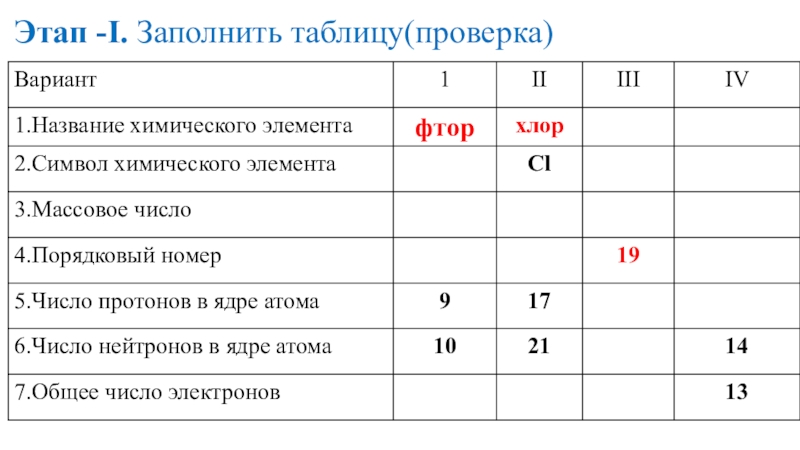
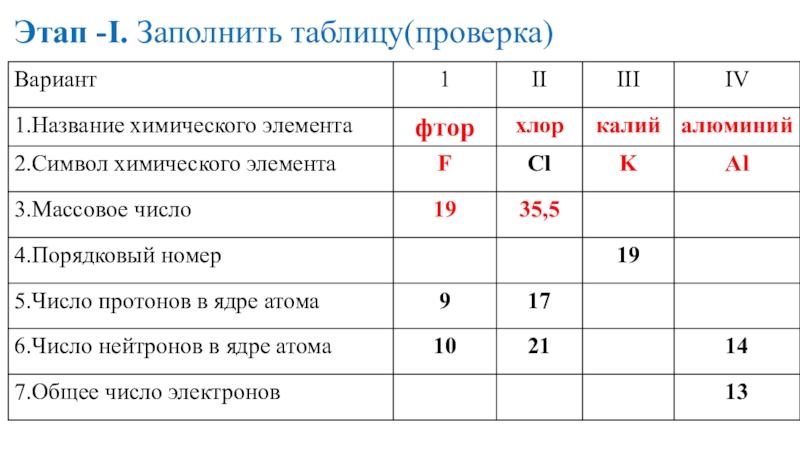
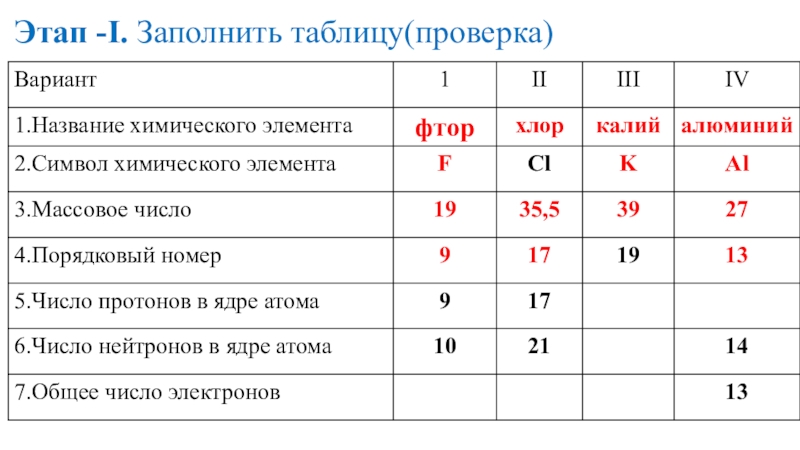
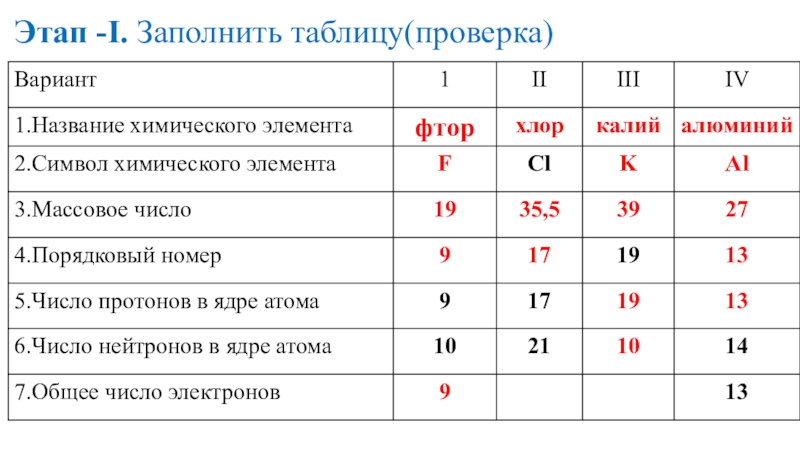
- 19. Этап -I. Заполнить таблицу(проверка)
- 20. Этап -I. Заполнить таблицу(проверка)
- 21. Этап -I. Заполнить таблицу(проверка)
- 22. Этап -I. Заполнить таблицу(проверка)
- 23. Этап -I. Заполнить таблицу(проверка)
- 24. Этап -I. Заполнить таблицу(проверка)
- 25. Этап -I. Заполнить таблицу(проверка)
- 26. Этап -I. Заполнить таблицу(проверка)
- 27. Этап -I. Заполнить таблицу(проверка)
- 28. Этап -I. Заполнить таблицу(проверка)
- 29. Этап -I. Заполнить таблицу(проверка)
- 30. Этап -I. Заполнить таблицу(проверка)
- 31. Этап -I. Заполнить таблицу(проверка)
- 32. Этап -I. Заполнить таблицу(проверка)
- 33. Этап -I. Заполнить таблицу(проверка)
- 34. Этап -I. Заполнить таблицу(проверка)
- 35. Этап -I. Заполнить таблицу(проверка)
- 36. Этап -I. Заполнить таблицу(проверка)
- 37. Этап -I. Заполнить таблицу(проверка)
- 38. Этап -I. Заполнить таблицу(проверка)
- 39. Этап -I. Заполнить таблицу(проверка)
- 40. Этап -I. Заполнить таблицу(проверка)
- 41. Э-3. Систематизация пройденного материалаУпражнения Выполнить задания № 3 и 7 после § 9
- 42. Этап-4. Подведение итогов Домашнее задание: § 9, выполнить задания № 4, 6—8 после § 9
Слайд 2Цель урока:
Формирование умения составлять схемы распределения электронов по электронным
Проблемный вопрос урока:
Как электроны располагаются в атоме? Почему свойства химических элементов повторяются периодически?
Слайд 3Э -1. Л/О «Моделирование принципа сканирующего
микроскопа» стр.48
Домашний эксперимент.
Распакуйте пластику жевательной резинки
Этот принцип используется для изготовлений печатной продукции для слепых.
Слайд 4Этап -I. Проверка домашнего задания
1.Упр.3,4 после § 8
1) Какие научные открытия доказали,
2) Каков физический смысл порядкового номера химического элемента? Дайте определение химического элемента.
Слайд 5Этап -2. Строение электронных оболочек атомов.
Электроны, вращаясь вокруг ядра образуют электронную
Число заполняемых энергетических уровней в атоме химического элемента равно номеру периода в таблице Д. И. Менделеева, в котором находится этот химический элемент. В этом заключается физический смысл номера периода в таблице Д. И. Менделеева.
Число ē = число р = порядковый номер
Слайд 6Записи в тетради.
Схемы строения электронных оболочек атомов химических элементов
11Na 2ē, 8ē, 1ē
Слайд 7Записи в тетради.
Схемы строения электронных оболочек атомов химических элементов
11Na 2ē, 8ē, 5ē
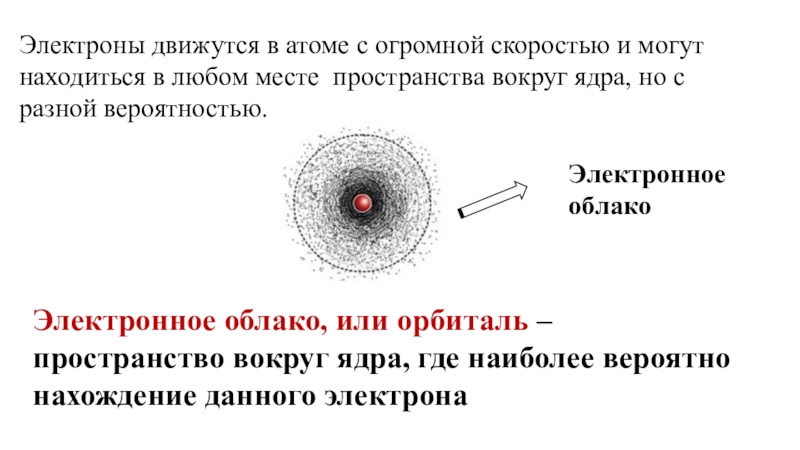
Слайд 8Электронное облако, или орбиталь – пространство вокруг ядра, где наиболее вероятно
Электронное облако
Электроны движутся в атоме с огромной скоростью и могут находиться в любом месте пространства вокруг ядра, но с разной вероятностью.
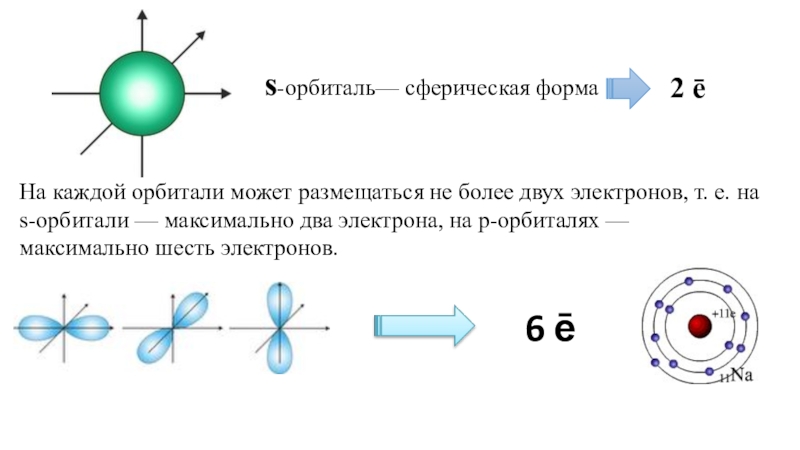
Слайд 92 ē
6 ē
s-орбиталь— сферическая форма
На каждой орбитали может размещаться не более
Слайд 10Максимальное число электронов на энергетическом уровне
2 n2
n – номер периода
1
2 энергетический уровень: 2 · 22 = 8 электронов
3 энергетический уровень: 2 · 32 = 18 электронов
Слайд 11 Для составления схемы строения электронных оболочек атомов химических элементов можно
1) определить общее число электронов в атоме (по порядковому номеру элемента);
2) определить число заполняемых электронных уровней в атоме (по номеру периода);
3) определить число электронов на каждом энергетическом уровне