называется ковалентной связью?
Какие ковалентные связи выделяют ?
Что такое валентность?
Как мы определяем валентность?
Какие элементы (металлы и неметаллы) имеют изменчивую валентность?
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Степень окисления. Определение степени окисления (8 класс)
Содержание
- 1. Презентация по химии на тему Степень окисления. Определение степени окисления (8 класс)
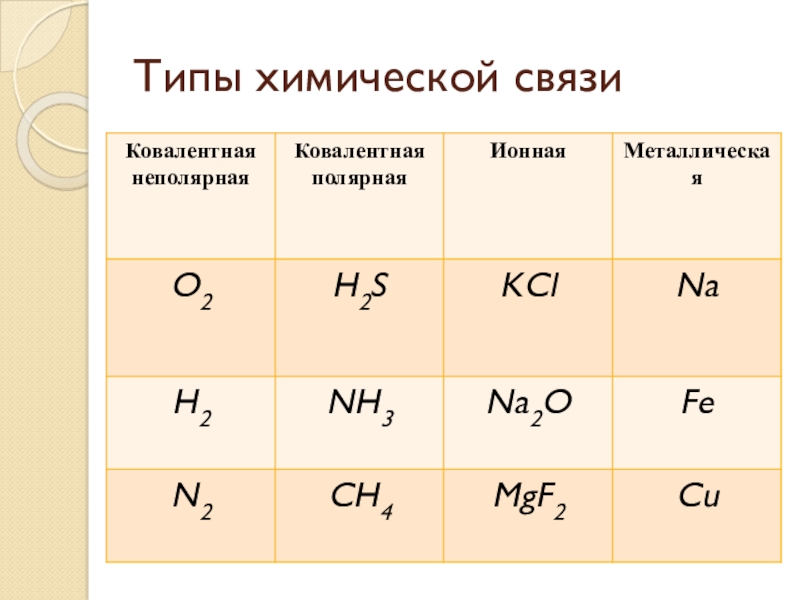
- 2. Типы химической связи
- 3. Ковалентная неполярная связьH2 H─H H:HN2 N≡N :N:::N:O2 O=O :O::O:
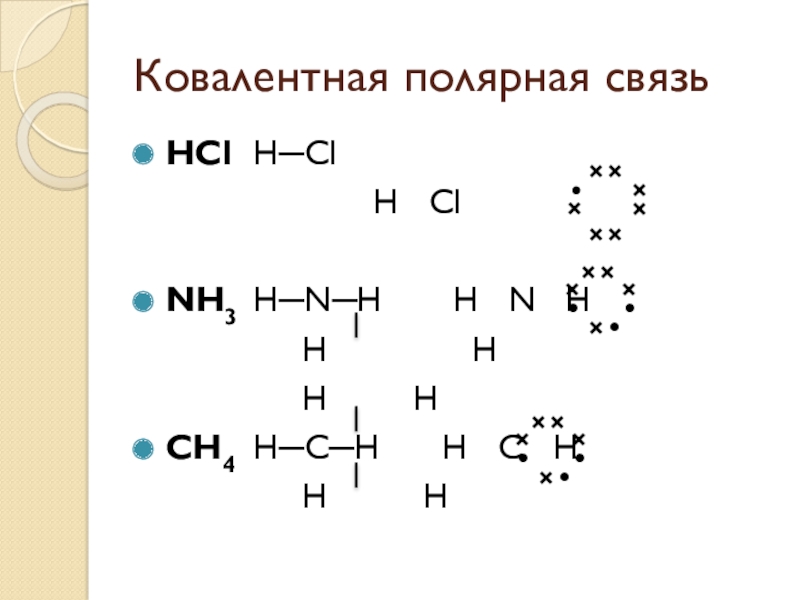
- 4. Ковалентная полярная связьHCl H─Cl H ClNH3 H─N─H H N
- 5. Степень окисления. Определение степени окисления8 класс
- 6. Цель урока:Усвоение понятия степени окисления,опираясь на прошлые
- 7. Ход урока:Выявление связи между понятиями «валентность» и
- 8. ВалентностьЭто способность атома образовывать определенное количество простых
- 9. ЭлектроотрицательностьЭто способность атомов притягивать к себе валентные
- 10. Степень окисленияЭто условный заряд атома в молекуле
- 11. Виды степени окисленияПоложительная – равна числу отданных
- 12. Правила определения степени окисления атомаВ простом веществе степень окисления атома равна нулю Н20, СI20, F20, S0, AI0
- 13. Правила определения степени окисления атомаВодород в большинстве
- 14. Правила определения степени окисления атомаКислород в большинстве
- 15. Правила определения степени окисления атомаСумма степеней окисления
- 16. Правила определения степени окисления атомаСтепень окисления F во всех соединениях равна «-1» Na+1 F-1, H+1 F-1
- 17. Правила определения степени окисления атомаСтепень окисления металлов
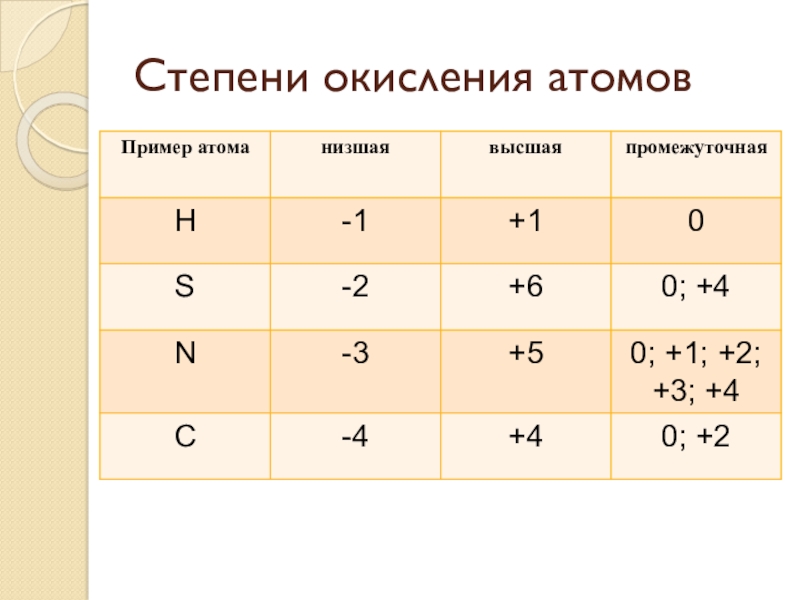
- 18. Степени окисления атомов
- 19. Алгоритм определения степени окисленияСначала расставляют известные степени
- 20. Закрепление Как и где обозначается степень окисления
- 21. Задание 1 (А). Определите степени окисления атомов в соединенияхNa+1F-1H2+1O-2Ca+2Br2-1H20P2+5O5-2Fe0
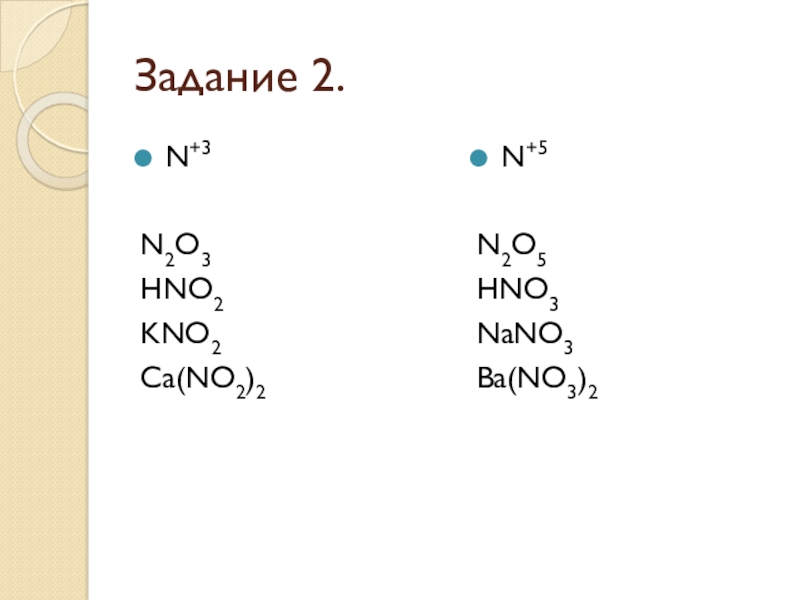
- 22. Задание 2.N+3N2O3HNO2KNO2Ca(NO2)2N+5N2O5HNO3NaNO3Ba(NO3)2
- 23. Задание 3. Найдите и исправьте ошибкиS+4H2SO3SO2H2SO4SCaSK2SO4S+6SO3CaSO4BaSO3H2SNa2SNa2SO3S+4H2SO3SO2BaSO3Na2SO3S+6SO3CaSO4H2SO4K2SO4
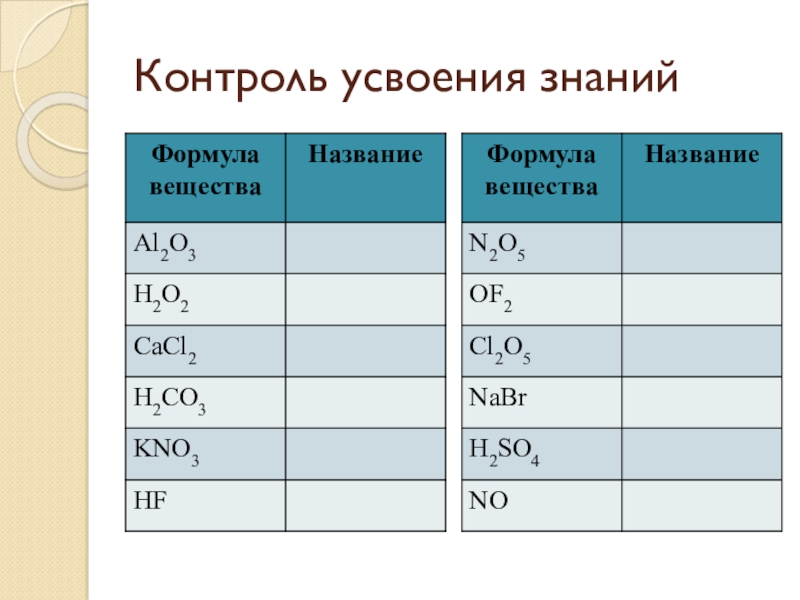
- 24. Контроль усвоения знаний
- 25. Контроль знаний
- 26. Поставьте себе отметку0 ошибок – «5»1 ошибка – «4»2-3 ошибки – «3»4-6 ошибок – «2»
- 27. Рефлексия Что я узнал на уроке?Чему научился
- 28. Домашнее заданиеОпорный конспект, задание №1(Б)Учебник, § 54
- 29. Спасибо за урок!
Типы химической связи
Слайд 1Фронтальный опрос
Что называется химической связью?
Какие виды химических связей вы знаете?
Какая связь
Слайд 6Цель урока:
Усвоение понятия степени окисления,
опираясь на прошлые знания по темам
«Валентность» и
«Химическая связь»,
изучение видов степеней окисления:
положительного, отрицательного и
нулевого значения, формирование умений
правильно определять степени окисления
атома в соединениях.
изучение видов степеней окисления:
положительного, отрицательного и
нулевого значения, формирование умений
правильно определять степени окисления
атома в соединениях.
Слайд 7Ход урока:
Выявление связи между понятиями «валентность» и «степень окисления»;
Определение степени окисления
элементов в соединениях;
Закрепление материала;
Контроль усвоения знаний, полученных на уроке.
Закрепление материала;
Контроль усвоения знаний, полученных на уроке.
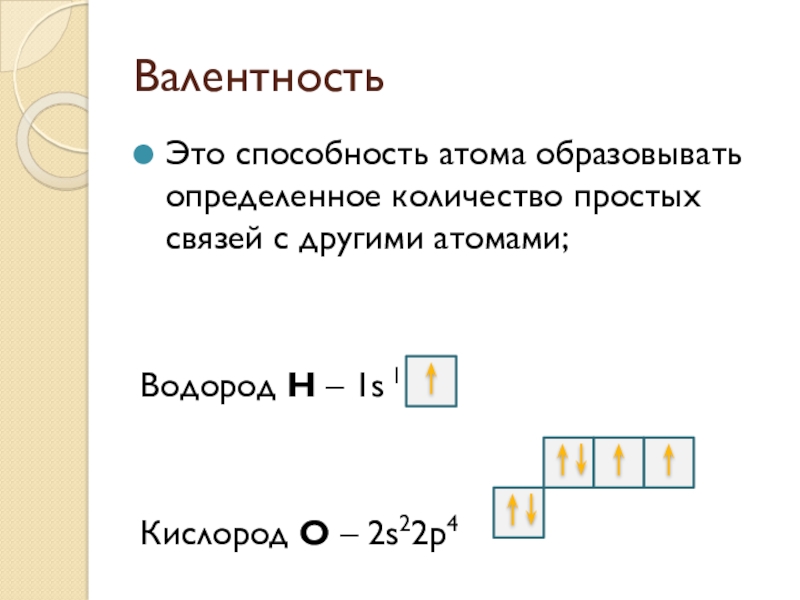
Слайд 8Валентность
Это способность атома образовывать определенное количество простых связей с другими атомами;
Водород
Н – 1s 1
Кислород O – 2s22p4
Кислород O – 2s22p4
Слайд 9Электроотрицательность
Это способность атомов притягивать к себе валентные электроны соседних атомов
H
Cl ЭО(H)=2,20; ЭО(Cl)=3,16
H-Cl H+-Cl-
H-Cl H+-Cl-
Слайд 10Степень окисления
Это условный заряд атома в молекуле или кристалле при условии,
что все связи имеют ионный характер
Стр. 245 рис. 109
Стр. 245 рис. 109
Слайд 11Виды степени окисления
Положительная – равна числу отданных электронов данным атомом (проявляют
металлы и неметаллы, кроме F, He и Ne)
Отрицательная – равна числу принятых электронов данным атомом (проявляют только неметаллы)
Нулевого значения (у элементов, входящих в состав простых веществ)
Отрицательная – равна числу принятых электронов данным атомом (проявляют только неметаллы)
Нулевого значения (у элементов, входящих в состав простых веществ)
Слайд 12Правила определения степени окисления атома
В простом веществе степень окисления атома равна
нулю
Н20, СI20, F20, S0, AI0
Н20, СI20, F20, S0, AI0
Слайд 13Правила определения степени окисления атома
Водород в большинстве соединений имеет степень окисления
«+1», кроме соединений с активными металлами, где степень окисления «-1»: Na+1H-1
H+1F-1 , H+1Cl-1 , H+1Br-1 ,
H2+10-2 , N-3H3+1
H+1F-1 , H+1Cl-1 , H+1Br-1 ,
H2+10-2 , N-3H3+1
Слайд 14Правила определения степени окисления атома
Кислород в большинстве случаев имеет степень окисления
«-2» (исключением являются: H2+1O2-1, O+2F2-1)
H2+1O-2 , S+4O2-2 , K2+1O-2 , P2+5O5-2
H2+1O-2 , S+4O2-2 , K2+1O-2 , P2+5O5-2
Слайд 15Правила определения степени окисления атома
Сумма степеней окисления всех элементов в молекуле
с учетом индексов равна нулю
Cl2O7
Cl2xO7-2
2x + 7×(-2)=0;
2x=+14
x= +7
Cl2+7O7-2
Cl2O7
Cl2xO7-2
2x + 7×(-2)=0;
2x=+14
x= +7
Cl2+7O7-2
Слайд 16Правила определения степени окисления атома
Степень окисления F во всех соединениях
равна «-1»
Na+1 F-1, H+1 F-1
Слайд 17Правила определения степени окисления атома
Степень окисления металлов главных подгрупп I, II, III групп во всех
соединениях равна «+1», «+2», «+3» соответственно
I II III
Na+1H-1 Ca+2H2-1 Al+3H3-1
Na2+1O-2 Ca+2O-2 Al2+3O3-2
I II III
Na+1H-1 Ca+2H2-1 Al+3H3-1
Na2+1O-2 Ca+2O-2 Al2+3O3-2
Слайд 19Алгоритм определения степени окисления
Сначала расставляют известные степени окисления (правила 1,2,3,5,6)
Затем по
правилу 4 определяют неизвестную степень окисления атома
H+1NxO3-2
1+x+3*(-2)=0
x= +5
H+1NxO3-2
1+x+3*(-2)=0
x= +5
Слайд 20Закрепление
Как и где обозначается степень окисления атома химического элемента?
Какие виды
степеней окисления выделяют у атомов химических элементов?
Какую степень проявляет металлы?
Какую степень проявляют элементы в простых веществах?
Какой заряд имеют катионы и анионы?
Как называется степень окисления, которая стоит между высшей и низшей степенями окисления?
Какую степень проявляет металлы?
Какую степень проявляют элементы в простых веществах?
Какой заряд имеют катионы и анионы?
Как называется степень окисления, которая стоит между высшей и низшей степенями окисления?
Слайд 21Задание 1 (А). Определите степени окисления атомов в соединениях
Na+1F-1
H2+1O-2
Ca+2Br2-1
H20
P2+5O5-2
Fe0
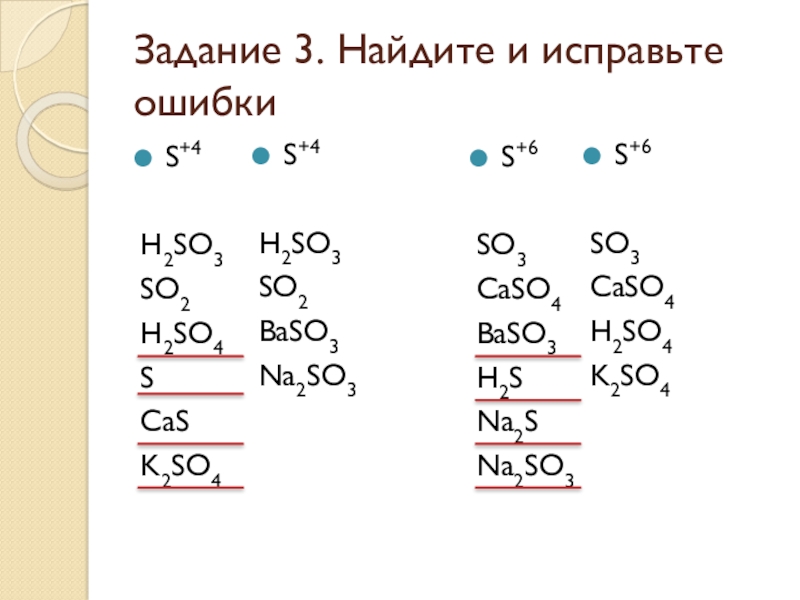
Слайд 23Задание 3. Найдите и исправьте ошибки
S+4
H2SO3
SO2
H2SO4
S
CaS
K2SO4
S+6
SO3
CaSO4
BaSO3
H2S
Na2S
Na2SO3
S+4
H2SO3
SO2
BaSO3
Na2SO3
S+6
SO3
CaSO4
H2SO4
K2SO4
Слайд 27Рефлексия
Что я узнал на уроке?
Чему научился я на уроке?
Активен ли
я был на уроке?
Понравился ли мне урок?
Доволен ли я своей работой на уроке?
Понравился ли мне урок?
Доволен ли я своей работой на уроке?
Слайд 28Домашнее задание
Опорный конспект, задание №1(Б)
Учебник, § 54 – изучить
С. 248, №
1, 4, 5, 6,12
Выучить правила определения степени окисления атомов
Выучить правила определения степени окисления атомов