- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Степень электролитической диссоциации. Сильные и слабые электролиты
Содержание
- 1. Презентация по химии на тему Степень электролитической диссоциации. Сильные и слабые электролиты
- 2. Сванте Аррениус для количественной характеристики электролитической диссоциации
- 3. Степень диссоциации электролита определяется опытным путем и
- 4. Различные электролиты имеют различную степень диссоциации. Опыт
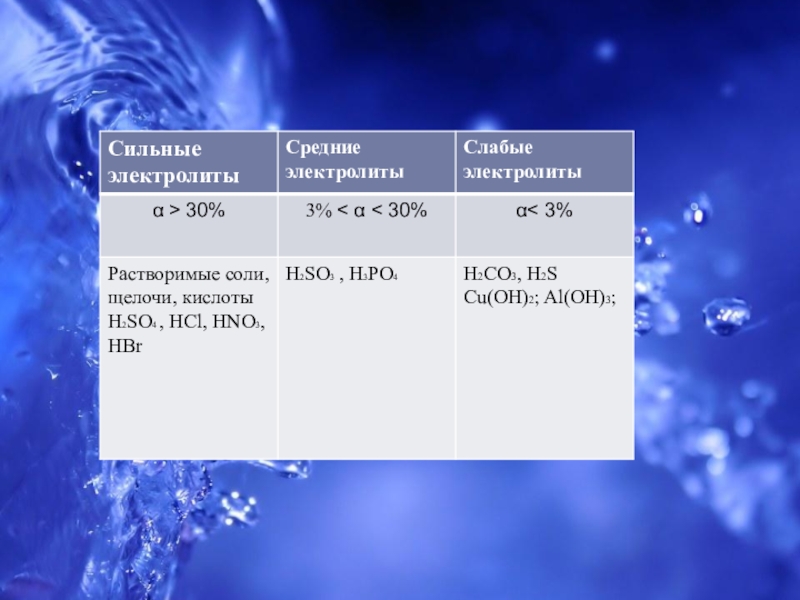
- 5. По степени диссоциации электролиты делят на: сильныеслабые.
- 6. Слайд 6
- 7. Сильные электролиты - Это такие электролиты, которые
- 8. Слабые электролиты - Это такие электролиты, которые
- 9. К слабым электролитам относятся:1) почти
- 10. 1) СH3COOH
- 11. Сильные электролиты почти полностью диссоциируют в растворе
- 12. По характеру образующихся в результате диссоциации ионов различают три типа электролитов: кислотыСолиоснования
- 13. Кислоты –это электролиты, диссоциирующие на катионы водорода
- 14. Основания – это электролиты,диссоциирующие на катионы металла(аммония
- 15. Диссоциация солейСолями-называются электролиты, при диссоциации которых образуются
- 16. Вычисления по теме «Степень электролитической диссоциации»Задача: Определите
- 17. Закрепление:Чему равна степень диссоциации электролита, если при
- 18. Слайд 18
- 19. Домашнее задание: Решите задачу: вычислите степень
Слайд 1Степень электролитической диссоциации.
Сильные и слабые электролиты.
Презентация преподавателя
химии ГБПОУ «КМТ»
Слайд 2Сванте Аррениус для количественной характеристики электролитической диссоциации ввел понятие степень электролитической
Поскольку электролитическая диссоциация - процесс обратимый, то в растворах электролитов наряду с их ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации (обозначается греческой буквой альфа α).
Степень электролитической
диссоциации –
это отношение числа молекул вещества, распавшегося на ионы, к общему количеству растворенного вещества.
α=n/N,
где n-число молекул, распавшихся на ионы
N- общее число растворенных молекул
Слайд 3Степень диссоциации электролита определяется опытным путем и выражается в долях единицы
Если α = 0, то диссоциация отсутствует;
Если α = 1 или 100%, то электролит полностью распадается на ионы.
Если же α = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ионы.
Т. о. степень электролитической диссоциации имеет значения от 0 до 1(0% до 100%)
Слайд 4Различные электролиты имеют различную степень диссоциации. Опыт показывает, что она зависит:
от температуры.
С уменьшением концентрации электролита, т.е. при разбавлении его водой, степень диссоциации всегда увеличивается.
Как правило, увеличивает степень диссоциации и повышение температуры.
Слайд 7Сильные электролиты -
Это такие электролиты, которые при растворении в воде
У таких электролитов степень диссоциации стремится к 1(100%)
Как правило, к сильным электролитам относятся вещества с ионными или сильно полярными связями:
все хорошо растворимые соли
сильные кислоты (HCl, HBr, HI, HClO4, H2SO4,HNO3)
сильные основания (LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2,Sr(OH)2,Ca(OH)2).
В растворе сильного электролита растворённое вещество находится в основном в виде ионов (катионов и анионов); недиссоциированные молекулы практически отсутствуют.
Слайд 8Слабые электролиты -
Это такие электролиты, которые в водных растворах частично
Их степень диссоциации значительно меньше 1(100%), в большинстве случаев она стремиться к нулю.
Растворы слабых электролитов наряду с ионами содержат недиссоциированные молекулы.
Слабые электролиты не могут дать большой концентрации ионов в растворе.
Слайд 9К слабым электролитам относятся:
1) почти все органические кислоты (CH3COOH-уксусная
2) некоторые неорганические кислоты (H2CO3, H2S и др.);
3) почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH);
4) вода.
Они плохо (или почти не проводят) электрический ток.
Слайд 101) СH3COOH CH3COO- + H+
2)
[CuOH]+ Cu2+ + OH- (вторая ступень)
3)H2CO3 H+ + HCO- (первая ступень)
HCO3- H+ + CO32- (вторая ступень)
Процесс электролитической диссоциации принято записывать в виде схемы, не раскрывая его механизма и опуская растворитель (H2O), хотя он является основным участником.
Слайд 11Сильные электролиты почти полностью диссоциируют в растворе ( уравнения записывают как
KOH = K + + OH -;
Ba(ОН)2 = Bа(ОН)+ + 2OH-
Слайд 12По характеру образующихся в результате диссоциации ионов различают три типа электролитов:
Соли
основания
Слайд 13Кислоты –
это электролиты, диссоциирующие на катионы водорода и анионы кислотного остатка.
Например,
HCl = H + + Cl -
HNO 3 -> H + + NO 3 -
Многоосновные кислоты диссоциируют ступенчато :
Н3РО4 ↔ Н+ + Н2РО4- (первая ступень) – дигидроортофосфат ион
Н2РО4- ↔ Н+ + НРO24- (вторая ступень) – гидроортофосфат ион
НРО24- ↔ Н+ + PОЗ4- (третья ступень) – ортофосфат ион
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени – по третей.
Слайд 14Основания –
это электролиты,диссоциирующие на катионы металла(аммония или органического основания) и
Например:
KOH = K + + OH -;
NH 4OH ↔ NH 4+ + OH –
Многокислотные основания диссоциируют ступенчато:
Ba(ОН)2 -> Bа(ОН)+ + OH- (первая ступень)
Ba(OH)+ ↔ Ba2++OH- (вторая ступень)
Слайд 15Диссоциация солей
Солями-
называются электролиты, при диссоциации которых образуются катионы металлов а также
Например, диссоциация средних солей :
(NH4)2SO4 -> 2NH4++ SO24-
Na3PO 4 -> 3 Na + + PO 34-
Слайд 16Вычисления по теме «Степень электролитической диссоциации»
Задача: Определите , чему равна степень
Алгоритм решения:
Записать формулу для вычисления степени диссоциации
α = n/N,
где n-число молекул, распавшихся на ионы
N- общее число растворенных молекул
2) Подставить данные в формулу и вычислить значение α, выразить в %
α= 90/150=0,6 или 60%
3) Выяснить, какой это электролит по силе, зная, что у слабых электролитов α < 3%, у сильных α>30%
α= 60% - это сильный электролит.
Слайд 17Закрепление:
Чему равна степень диссоциации электролита, если при растворении его в воде
2) В перечне веществ подчеркните сильные электролиты:
Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH);
H2SO4 , HCl, HNO3, HBr
Слайд 19
Домашнее задание:
Решите задачу: вычислите степень диссоциации электролита, если из
2) Дописать уравнения диссоциации:
KOH =
NaNO3 =
MgSO4 =
H2SO4 =








![Презентация по химии на тему Степень электролитической диссоциации. Сильные и слабые электролиты 1) СH3COOH CH3COO- + H+ 2) Cu(OH)2 1) СH3COOH CH3COO- + H+ 2) Cu(OH)2 [CuOH]+](/img/thumbs/a80ae4d7f908b883039c46dacfccd99c-800x.jpg)














