Бозаджи Н.М.,
учитель химии
высшей категории
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Степень окисления (9 класс)
Содержание
- 1. Презентация по химии на тему Степень окисления (9 класс)
- 2. Моделировать проставление СО.Формулировать определение СО.Применять полученные знания
- 3. ЗАДАНИЕ 1Определите типы химической связи: Na NaCl HCl- металлическая- ионная- ковалентная полярная
- 4. ЗАДАНИЕ 2Определите заряды элементов: Na Na Cl H Cl 0+-δ+δ-
- 5. Степень окисления (СО) Определяется количеством электронов, которое
- 6. СО кислорода почти всегда в сложных веществах
- 7. СО простых веществ и свободных атомов равна
- 8. Максимальная положительная степень окисления элемента равна номеру
- 9. ЗАДАНИЕ 3Определить положительные степени окисления элементов:Al
- 10. Отрицательную степень окисления могут проявлять только неметаллы.
- 11. Бинарное соединение - вещество, состоящее из 2 химических элементов.
- 12. На первом месте в формуле принято писать
- 13. На первое место в формуле ставится элемент,
- 14. Некоторые элементы могут проявлять несколько положительных степеней
- 15. ЗАДАНИЕ 8.Определите степени окисления элементовAl2O3Ca3N2P2O5Cl2O7Al2+3O3-2Ca3+2N2-3P2+5O5-2Cl2+7O7-2
- 16. ЗАДАНИЕ 9. Составить формулы бинарных соединенийХлорид цинкаСульфид натрияБромид алюминияОксид барияОксид марганца (VII)Хлорид фосфора (III)ZnCl2Na2SAlBr3BaOMn2O7PCl3
- 17. Ребята, берегите зрение!Ребята, берегите зрение!
- 18. ЗАДАНИЕ 10. А если вещество состоит из 3 элементов?H2SO4HNO3Na2SO4KMnO4
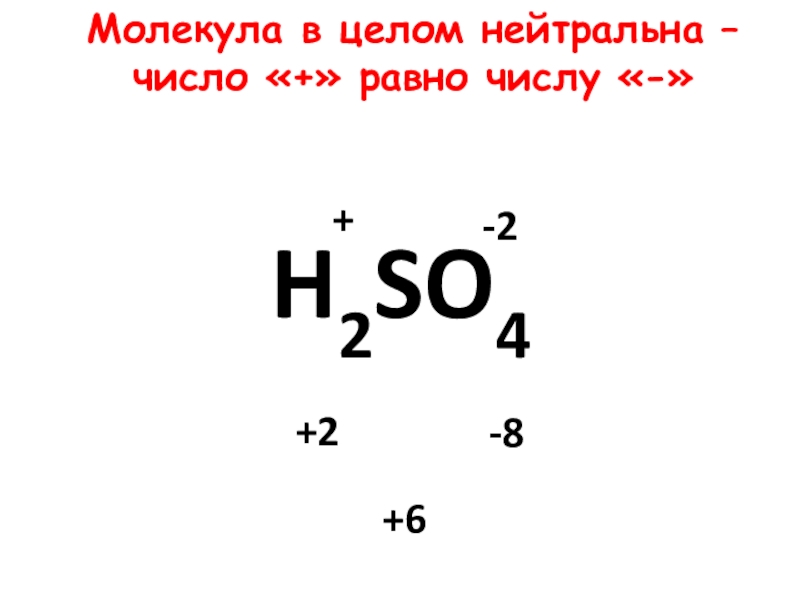
- 19. H2SO4-2+-8+2+6Молекула в целом нейтральна – число «+» равно числу «-»
- 20. ТЕСТ
- 21. Степень окисления – это величина: а) переменная, б) постоянная, в) постоянная и переменная.
- 22. 2. Высшая степень окисления фосфора равна: а) номеру группы, т.е. 5, б) нулю, в) трем.
- 23. 3. Вещество, формула которого Р2О5, называется а) оксид фосфора, б) пентаоксид фосфора (V), в) оксид фосфора (V)
- 24. 4. Степень окисления хлора равна -1 в: а) Cl2O3, б) PCl5, в) Cl2.
- 25. 5. Состав оксида серы (IV) выражается формулой а) SO2, б) SO, в) SO3.
- 26. ТЕСТ ПРОЙДЕН
- 27. Рефлексия 1.Какова цель нашего урока?2.Достигли ли мы
- 28. Разобрать и выучить конспект.Выполнить упр.кл.работы*Значение окислительно-воссстановительных реакций Домашнее задание
- 29. Спасибо за внимание!
- 30. желаю удачи!
Слайд 1Степень окисления(СО) Определение СО по химической формуле Cоставление формул.
9
Слайд 2Моделировать проставление СО.
Формулировать определение СО.
Применять полученные знания на практике.
4.Осуществлять рефлексию своей
В результате изучения темы, вы будете способны:
Слайд 3ЗАДАНИЕ 1
Определите типы химической связи:
Na
NaCl
HCl
- металлическая
- ионная
- ковалентная полярная
Слайд 5Степень окисления (СО)
Определяется количеством электронов, которое может отдавать или принимать элемент,
Условный заряд элемента, который рассчитывается из предположения, что вещество образовано ионной связью.
NB! СО численно совпадает с валентностью
Слайд 6СО кислорода почти всегда в сложных веществах -2, только со фтором
Примеры: Н2О-2, СаО-2, O+2F2
СО водорода почти всегда в сложных веществах +1, только с металлами -1
Примеры: Н+12О, Н+12SO4, NaH-1, AlH-13
СО металлов в сложных веществах всегда положительна и ее максимальное значение равно номеру группы
Примеры: СаО, NaCl
Слайд 7СО простых веществ и свободных атомов равна нулю
Примеры: Н20, О20,
Суммарная СО всех атомов в соединении равна нулю
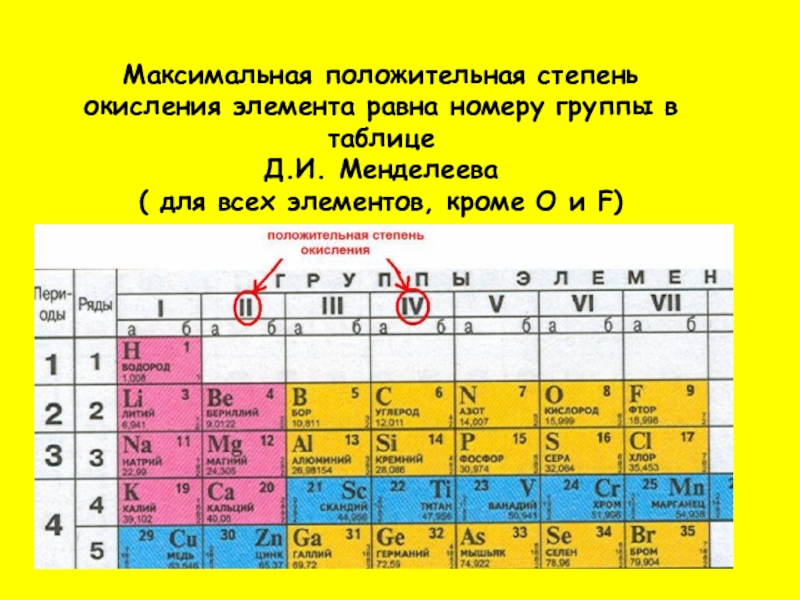
Слайд 8Максимальная положительная степень окисления элемента равна номеру группы в таблице
Д.И.
( для всех элементов, кроме О и F)
Слайд 10Отрицательную степень окисления могут проявлять только неметаллы.
Отрицательная степень окисления =
ЗАДАНИЕ 4.
Определить возможные отрицательные степени окисления у элементов:
Cl N C Ca S K Fe O F
Слайд 12На первом месте в формуле принято писать элемент с положительной степенью
Сумма положительных и отрицательных степеней окисления элементов в соединении равна 0
ЗАДАНИЕ 5. Определить степени окисления элементов в соединениях:
H2O CCl4 Mg3P2 AlF3
Слайд 13На первое место в формуле ставится элемент, номер группы которого меньше
ЗАДАНИЕ
Составить формулы веществ, образованных:
Na и O
C и Ba
S и H
Cl и P
Слайд 14Некоторые элементы могут проявлять несколько положительных степеней окисления.
Например, медь Cu
Расчет степени окисления начинают с элемента на втором месте в формуле вещества и степень окисления элемента на первом месте указывают в названии
(римской цифрой в скобках).
ЗАДАНИЕ 7 Определить степени окисления элементов и назвать вещества:
Сu2О СuCl2 SO3 SO2 H 2S
Слайд 15ЗАДАНИЕ 8.Определите степени окисления
элементов
Al2O3
Ca3N2
P2O5
Cl2O7
Al2+3O3-2
Ca3+2N2-3
P2+5O5-2
Cl2+7O7-2
Слайд 16ЗАДАНИЕ 9.
Составить формулы бинарных соединений
Хлорид цинка
Сульфид натрия
Бромид алюминия
Оксид бария
Оксид марганца
Хлорид фосфора (III)
ZnCl2
Na2S
AlBr3
BaO
Mn2O7
PCl3
Слайд 21 Степень окисления – это величина:
а) переменная,
б) постоянная,
в) постоянная и переменная.
Слайд 233. Вещество, формула которого Р2О5, называется
а) оксид фосфора,
б) пентаоксид фосфора (V),
в)
Слайд 27Рефлексия
1.Какова цель нашего урока?
2.Достигли ли мы цели?
3.Что представляло
наибольшую трудность?
4. На
5.Своей работой на уроке я…
6.Урок для меня показался…
7. Материал урока мне был…
8. Мое настроение…