- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Соли (11 класс)
Содержание
- 1. Презентация по химии на тему: Соли (11 класс)
- 2. ПЛАН УРОКАОпределение соли. Физические свойства.Номенклатура и классификация солей.Способы получения.Химические свойства.Гидролиз солей.Практическое применение.
- 3. Слайд 3
- 4. Слайд 4
- 5. Даны вещества: К2О, HCl, FeBr3, Cu(OH)2, (CaOH)3PO4
- 6. "Соль есть кислота, в которой водород
- 7. Физические свойства солейЛАБОРАТОРНАЯ РАБОТА №1Вывод: По каким физическим признакам соли отличаются друг от друга?
- 8. Слайд 8
- 9. HHHК и с л ы е,
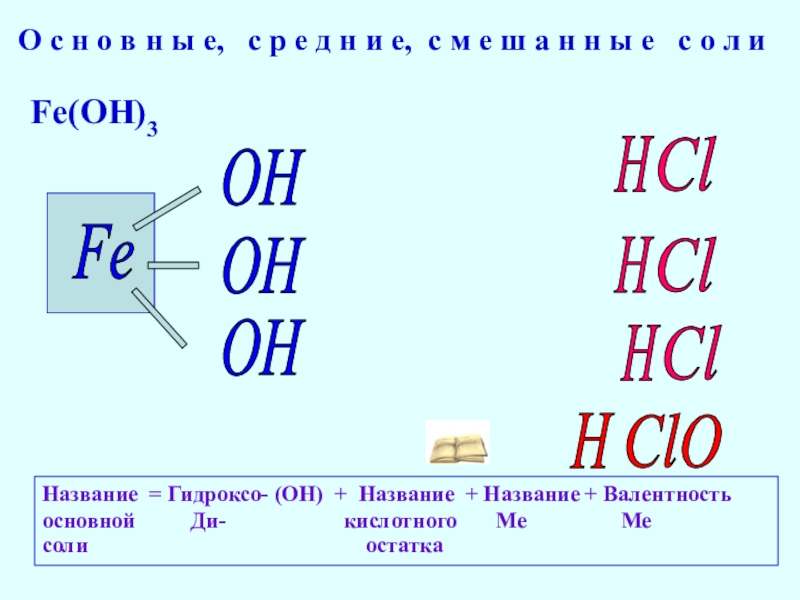
- 10. Fe(OH)3FeOHClHHClHClOHOHО с н о в н ы
- 11. Комплексные солиКристаллогидратыK4[Fe(CN)6] – гексацианоферрат (ІІІ) калия
- 12. Составьте формулы солей по названиюСульфат калия-натрия Гидрокарбонат
- 13. Классификация солейСРЕДНИЕ(НОРМАЛЬНЫЕ) SO4КИСЛЫЕCu(
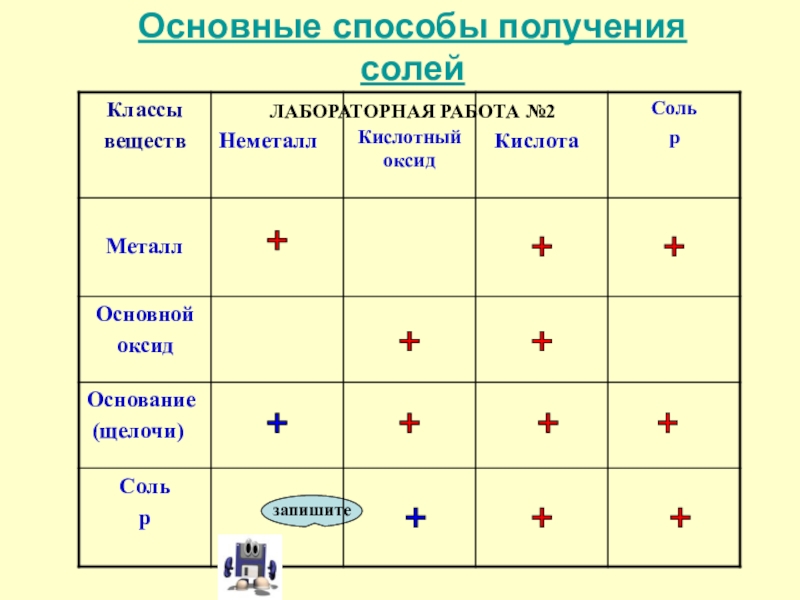
- 14. Основные способы получения солей
- 15. Слайд 15
- 16. Основные способы получения солейЛАБОРАТОРНАЯ РАБОТА №2++++++++++++
- 17. Химические свойства солей
- 18. Разложение солей – особое свойствоМеNO3 tototoдо Mgот
- 19. ОТНОШЕНИЕ СОЛЕЙ К ВОДЕ В ПРИСУТСТВИИ ИНДИКАТОРОВЛАБОРАТОРНАЯ
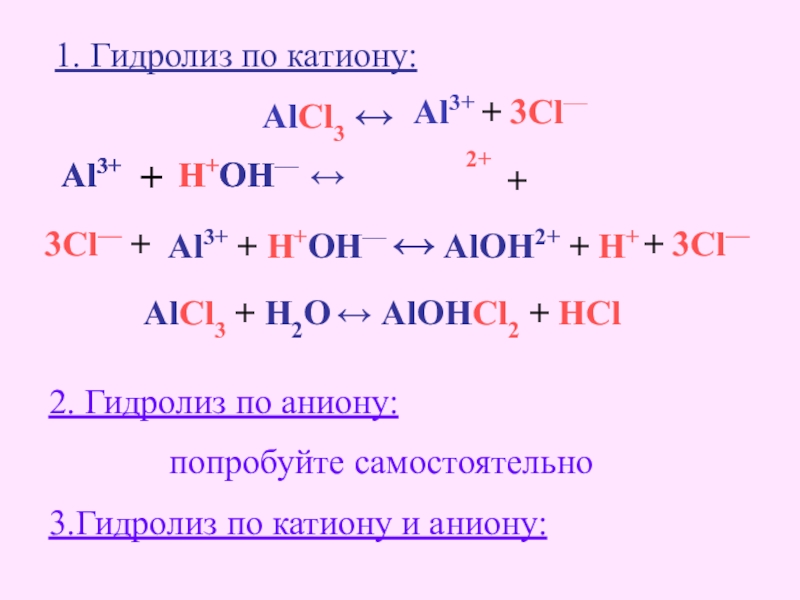
- 20. Гидролиз солейСоль образованаAlCl3слабым основаниемсильной кислотой,по КАТИОНУсреда кислая[H+]
- 21. AlCl3 ↔ Al3+ + 3Cl—1. Гидролиз по
- 22. Применение солей
- 23. Слайд 23
- 24. Слайд 24
- 25. ОТВЕТЫ К ТЕСТУ:Вариант – 1
- 26. Мы учим химию опять, чтоб в жизни
Слайд 1 «…Узнать, понять и охватить гармонию научного здания
с его
какое дает только высшая красота и правда».
Д.И.Менделеев, Сочинения, том 24
Слайд 2ПЛАН УРОКА
Определение соли. Физические свойства.
Номенклатура и классификация солей.
Способы получения.
Химические свойства.
Гидролиз солей.
Практическое
Слайд 5
Даны вещества: К2О, HCl, FeBr3, Cu(OH)2, (CaOH)3PO4
NaH, CaC2, Li3N, Ni(CO)4…
Выпишите из них формулы солей.
Классификацию веществ нельзя считать законченной, не все ветви химического древа получили свои названия.
FeBr3, (CaOH)3PO4, MnSO4,
Na[Al(OH)4],
NaHS
Слайд 6
"Соль есть кислота,
в которой водород заменен металлом".
СОЛИ – это продукты полного или частичного замещения водорода в кислоте на металл или гидроксильной группы в основании на кислотный остаток
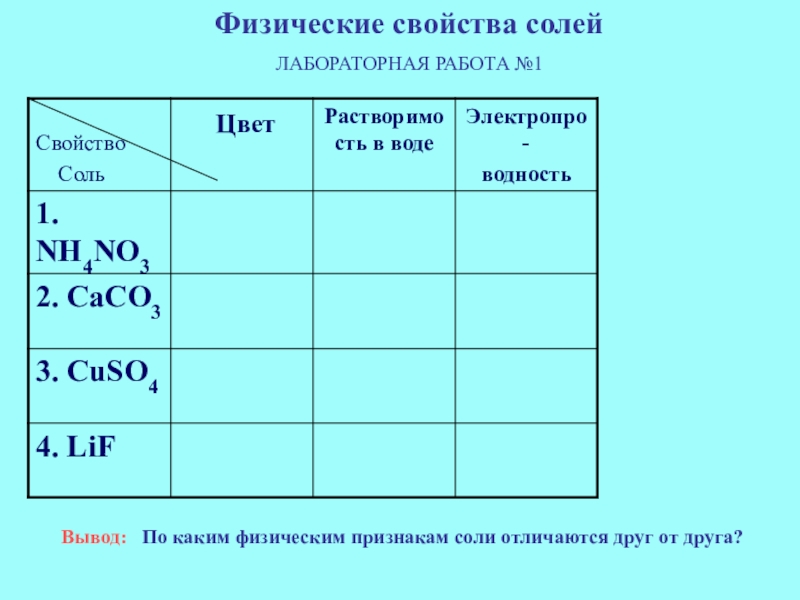
Слайд 7Физические свойства солей
ЛАБОРАТОРНАЯ РАБОТА №1
Вывод: По каким физическим признакам соли
Слайд 9
H
H
H
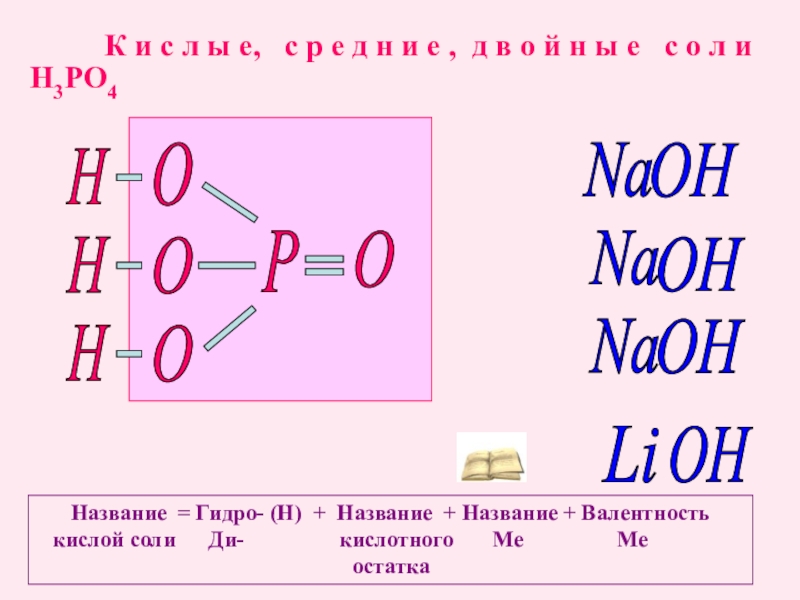
К и с л ы е, с р е д
Название = Гидро- (Н) + Название + Название + Валентность
кислой соли Ди- кислотного Ме Ме
остатка
Р
O
O
O
O
Na
OH
Na
OH
Na
OH
H3PO4
Li
OH
Слайд 10
Fe(OH)3
Fe
OH
Cl
H
H
Cl
H
Cl
OH
OH
О с н о в н ы е, с р
Название = Гидроксо- (ОН) + Название + Название + Валентность
основной Ди- кислотного Ме Ме
соли остатка
Н
ClO
Слайд 11Комплексные соли
Кристаллогидраты
K4[Fe(CN)6] – гексацианоферрат (ІІІ) калия
[Ag(NH3)2]Cl – хлорид диаммин серебра (І)
CuSO4·5H2O – медный купорос
MgSO4·7H2O – горькая английская соль
Слайд 12Составьте формулы солей по названию
Сульфат калия-натрия
Гидрокарбонат железа (ІІ)
Нитрат меди
Гидроксобромид бария
Тетрагидроксоцинкат калия
Пентагидрат сульфата меди (ІІ)
Сульфат аммония-железа (ІІІ)
Дигидрофосфат цезия
KNaSO4
Fe(HCO3)2
Cu(NO3)2
Ba(OH)Br
K2[Zn(OH)4]
CuSO4·5H2O
NH4Fe(SO4)2
CsH2PO4
Слайд 13
Классификация солей
СРЕДНИЕ
(НОРМАЛЬНЫЕ)
SO4
КИСЛЫЕ
Cu( SO4)2
ОСНОВНЫЕ
(Cu
ДВОЙНЫЕ
(SO4)2
СМЕШАННЫЕ
Ca(OCl)
КОМПЛЕКСНЫЕ
Na
«Странные» соединения
КРИСТАЛЛОГИДРАТЫ
Na2CO3·
Cu
H
Cl2
OH
[Al(OH)4]
10H2O
KAl
Слайд 17Химические свойства солей
кислота → н.соль (↑ или ↓)
щёлочь → н.основание (↓)
р.соль → н.соль (↓)
nH2O → ·nH2O (кристаллогидрат)
С
н. О
Л
Ь
С
р. О
Л
Ь
+
+
Средняя соль → Кислая соль
←
Средняя соль → Основная соль
←
кислота
щёлочь
кислота
Растворимые и малорастворимые соли диссоциируют на ионы.
Слайд 18
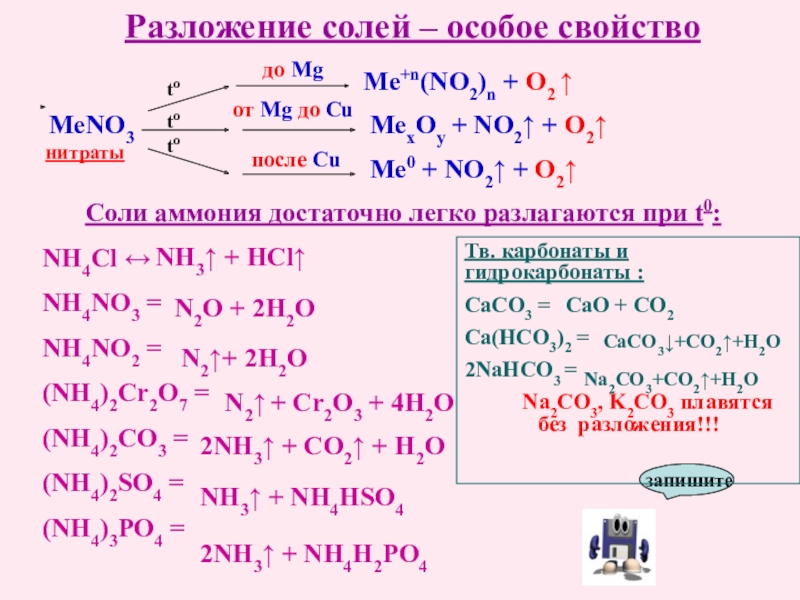
Разложение солей – особое свойство
МеNO3
to
to
to
до Mg
от Mg до Cu
после Сu
Me+n(NO2)n
MexOy + NO2↑ + O2↑
Me0 + NO2↑ + O2↑
нитраты
Соли аммония достаточно легко разлагаются при t0:
NH4Cl ↔
NH4NO3 =
NH4NO2 =
(NH4)2Cr2O7 =
(NH4)2CO3 =
(NH4)2SO4 =
(NH4)3PO4 =
NH3↑ + HCl↑
N2O + 2H2O
N2↑+ 2H2O
N2↑ + Cr2O3 + 4H2O
2NH3↑ + CO2↑ + H2O
NH3↑ + NH4HSO4
2NH3↑ + NH4H2PO4
Тв. карбонаты и гидрокарбонаты :
СаСО3 =
Са(HCO3)2 =
2NaHCO3 =
Na2CO3, K2CO3 плавятся без разложения!!!
СаО + СО2
СаСО3↓+СО2↑+Н2О
Na2CO3+CO2↑+H2O
Слайд 19
ОТНОШЕНИЕ СОЛЕЙ К ВОДЕ В ПРИСУТСТВИИ ИНДИКАТОРОВ
ЛАБОРАТОРНАЯ РАБОТА №3
при добавлении индикаторов?
Универ-
сальный
Метил-
оранж
Фенол-
фталеин
Слайд 20Гидролиз солей
Соль образована
AlCl3
слабым основанием
сильной кислотой,
по КАТИОНУ
среда кислая
[H+] > [OH-]
лакмус-красный
Na2CO3
сильным основанием
слабой кислотой,
по
среда щелочная
[H+] < [OH-]
лакмус-синий
Al2S3
слабым основанием
слабой кислотой,
по КАТИОНУ И
АНИОНУ,
полный гидролиз,
необратим
NaCl
сильным основанием,
сильной кислотой,
среда нейтральная
[H+] = [OH-]
лакмус-фиолетовый
Гидролиз – обратимая реакция , усиливается
при нагревании системы, при разведении водой
Al(OH)3
HCl
NaOH
H2CO3
Al(OH)3
H2S
Слайд 21AlCl3 ↔
Al3+ + 3Cl—
1. Гидролиз по катиону:
Al3+
Al3+
+
H+
OH—
↔
OH—
2+
H+
+
Al3+ + H+OH— ↔
3Cl— +
+ 3Cl—
AlCl3 + H2O ↔ AlOHCl2 + HCl
2. Гидролиз по аниону:
попробуйте самостоятельно
3.Гидролиз по катиону и аниону:
Слайд 26Мы учим химию опять, чтоб
в жизни знания применять,
в олимпиадах
да и ЕГЭ отлично сдать!!!
11-А
СПАСИБО ЗА УРОК!






![Презентация по химии на тему: Соли (11 класс) Комплексные солиКристаллогидратыK4[Fe(CN)6] – гексацианоферрат (ІІІ) калия Комплексные солиКристаллогидратыK4[Fe(CN)6] – гексацианоферрат (ІІІ) калия (жёлтая](/img/thumbs/9489b1331e5a042280c06976fb84b5e3-800x.jpg)

![Презентация по химии на тему: Соли (11 класс) Классификация солейСРЕДНИЕ(НОРМАЛЬНЫЕ) SO4КИСЛЫЕCu( SO4)2ОСНОВНЫЕ(Cu )2CO3ДВОЙНЫЕ (SO4)2СМЕШАННЫЕCa(OCl)КОМПЛЕКСНЫЕ Na «Странные» соединенияКРИСТАЛЛОГИДРАТЫNa2CO3·CuHCl2OH[Al(OH)4]10H2OKAl Классификация солейСРЕДНИЕ(НОРМАЛЬНЫЕ) SO4КИСЛЫЕCu( SO4)2ОСНОВНЫЕ(Cu )2CO3ДВОЙНЫЕ (SO4)2СМЕШАННЫЕCa(OCl)КОМПЛЕКСНЫЕ Na](/img/thumbs/b61a4200201c27661481073a3fd87ef0-800x.jpg)




![Презентация по химии на тему: Соли (11 класс) Гидролиз солейСоль образованаAlCl3слабым основаниемсильной кислотой,по КАТИОНУсреда кислая[H+] > [OH-]лакмус-красныйNa2CO3сильным основаниемслабой кислотой,по Гидролиз солейСоль образованаAlCl3слабым основаниемсильной кислотой,по КАТИОНУсреда кислая[H+] > [OH-]лакмус-красныйNa2CO3сильным основаниемслабой кислотой,по АНИОНУсреда щелочная[H+] < [OH-]лакмус-синийAl2S3слабым основаниемслабой кислотой,по](/img/thumbs/82dc81501696282410363da992cc0e8f-800x.jpg)