химии и биологии МОУ «Ляминская основная общеобразовательная школа» г. Чусовой
Копалиной Татьяны Геннадьевны
2011г.- г.Пермь
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Соли (8 класс)
Содержание
- 1. Презентация по химии на тему Соли (8 класс)
- 2. Соли
- 3. Содержание: 1.Классификация2.Номеклатура3.Физические свойства4.Химические свойства5.Применение
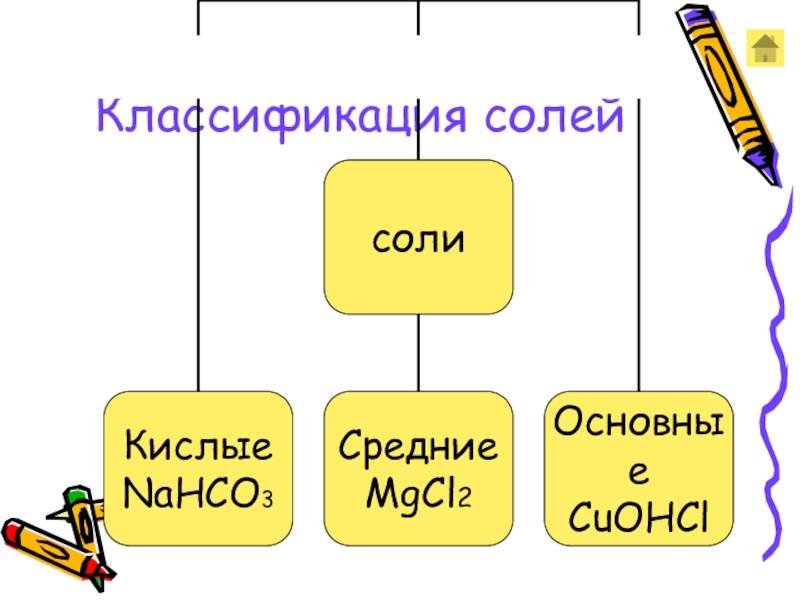
- 4. Классификация солей
- 5. Подумай и ответь в какой строчке средние
- 6. НоменклатураНазвание солей формируется с помощью суффиксов:–ид (хлорид, сульфид)-ит (нитрит, сульфит)3. - ат (карбонат, сульфат)
- 7. Назовите соли:1. ZnCl22. KNO33. MgSiO44. AlPO45. Na2SO3
- 8. Физические свойства1.Агрегатное состояние2.Цвет3.Растворимость
- 9. Химические свойства:1.с металлами2.с щелочами3.с кислотами4.с другими солями
- 10. 1.Взаимодействие с металлами1. Металл должен находиться в
- 11. 2.Взаимодействие со щелочами1.Образуется осадок2.Образуется газNaOH + Fe2(SO4)3
- 12. 3.Взаимодействие с кислотами 1. Образуется осадок2. Образуется
- 13. 4.Взаимодействие с другими солямиОбязательно образуется осадокBaCl2 +
- 14. Дополните!1… + … = Ba3PO4 + 6KOH2.
- 15. Применение:
- 16. Слайд 16
Соли
Слайд 3Содержание:
1.Классификация
2.Номеклатура
3.Физические свойства
4.Химические свойства
5.Применение
Слайд 5Подумай и ответь в какой строчке средние соли:
1. CaCO3, (CuOH)2CO3, BaSO4
2.
KBr, NH4NO3, Ca(HCO3)2
3. Na3PO4, MnCl2, AgNO3
3. Na3PO4, MnCl2, AgNO3
Слайд 6Номенклатура
Название солей формируется с помощью суффиксов:
–ид (хлорид, сульфид)
-ит (нитрит, сульфит)
3. -
ат (карбонат, сульфат)
Слайд 101.Взаимодействие с металлами
1. Металл должен находиться в ряду напряжений до металла
соли;
2. Не использовать щелочные металлы;
3. Должна образоваться растворимая соль;
Fe + CuSO4 = FeSO4 + Cu
2. Не использовать щелочные металлы;
3. Должна образоваться растворимая соль;
Fe + CuSO4 = FeSO4 + Cu
Слайд 112.Взаимодействие со щелочами
1.Образуется осадок
2.Образуется газ
NaOH + Fe2(SO4)3 =
Na2SO4 + Fe(OH)3
KOH
+ (NH4)SO4 =
K2SO4 + NH3 + H2O
K2SO4 + NH3 + H2O
Слайд 123.Взаимодействие с кислотами
1. Образуется осадок
2. Образуется газ
Na2SiO3 + H2SO4 =
Na2SO4
+ H2SiO4
CaCO3 + HCl =
CaCl2 + CO2 + H2O
CaCO3 + HCl =
CaCl2 + CO2 + H2O
Слайд 134.Взаимодействие с другими солями
Обязательно образуется осадок
BaCl2 + Na2SO4 =
BaSO4 +2 NaCl
(качественная р-ия)
2AgNO3 + CuCl2 =
2AgCl + Cu(NO3)2
2AgNO3 + CuCl2 =
2AgCl + Cu(NO3)2
Слайд 14Дополните!
1… + … = Ba3PO4 + 6KOH
2. … + … =
CaCO3 +2KNO3
3. MgSO4 + … = Mg(NO3)2 + …
4. … +2HCl = ZnCl2 + …
3. MgSO4 + … = Mg(NO3)2 + …
4. … +2HCl = ZnCl2 + …