- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Щелочно-земельные металлы(9класс)
Содержание
- 1. Презентация по химии на тему Щелочно-земельные металлы(9класс)
- 2. Цели:Обобщить и системати-зировать знания о щелочноземельных металлахУметь
- 3. Положение в периодической системе. Строение атомаЩелочноземельные
- 4. Физические свойства цвет
- 5. Химические свойства2Me0 +O2 → 2Me+2O-2Me0 +H2
- 6. Соединения щелочноземельных металловОксиды щелочноземельных металлов легко реагируют с оксидами неметаллов с образованием соответствующих солей.
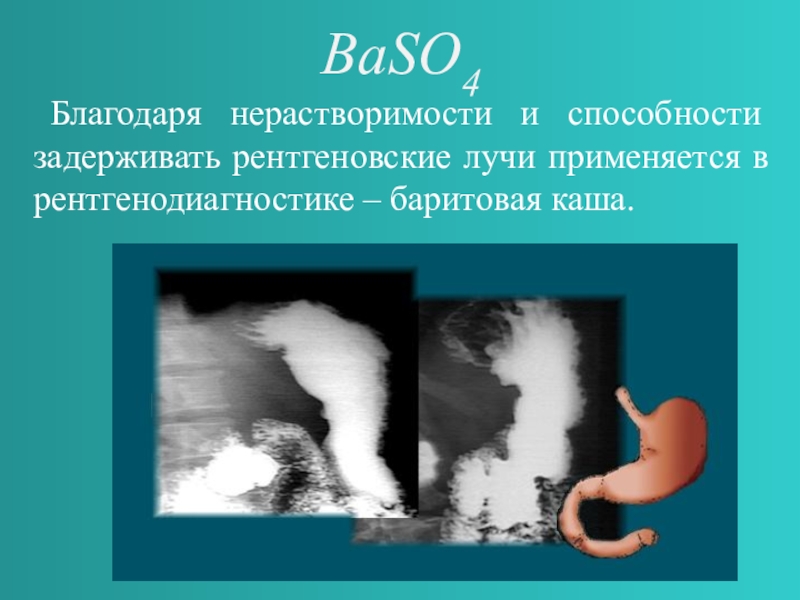
- 7. BaSO4 Благодаря нерастворимости и способности задерживать рентгеновские лучи применяется в рентгенодиагностике – баритовая каша.
- 8. Ca3(PO4)2 Входит в состав фосфоритов и апатитов,
- 9. CaCO3Карбонат кальция – одно из самых распространённых
- 10. CaSO4∙ 2H2O Встречается в природе в виде
- 11. MgCO3 Широко применяется в производстве стекла,
- 12. Са(ОН)2 Гидроксид кальция или гашёная известь
- 13. Проверка знаний Сравните атомы
- 14. Проверь себя (самостоятельная работа )
- 15. Используемая литература Рудзитис Г.Е., Фельдман Ф.Г. Химия
Цели:Обобщить и системати-зировать знания о щелочноземельных металлахУметь характеризовать элементы по положению в периодической таблицеЗнать физические и хими-ческие свойства Знать применение соеди-нений щелочноземельных металлов
Слайд 2Цели:
Обобщить и системати-зировать знания о щелочноземельных металлах
Уметь характеризовать элементы по положению
в периодической таблице
Знать физические и хими-ческие свойства
Знать применение соеди-нений щелочноземельных металлов
Знать физические и хими-ческие свойства
Знать применение соеди-нений щелочноземельных металлов
Слайд 3Положение в периодической системе.
Строение атома
Щелочноземельные металлы в периодической системе находятся
в главной подгруппе II группы.
Являются сильными восстановителями, отдают 2 ē, во всех соединениях проявляют степень окисления +2.
Mg +12 2ē, 8ē, 2ē
Ca +20 2ē, 8ē, 8 ē, 2ē
Sr +38 2ē, 8ē, 18 ē, 8ē, 2ē
Ba +56 2ē, 8ē, 18 ē, 18 ē, 8ē, 2ē
Являются сильными восстановителями, отдают 2 ē, во всех соединениях проявляют степень окисления +2.
Mg +12 2ē, 8ē, 2ē
Ca +20 2ē, 8ē, 8 ē, 2ē
Sr +38 2ē, 8ē, 18 ē, 8ē, 2ē
Ba +56 2ē, 8ē, 18 ē, 18 ē, 8ē, 2ē
Слайд 4Физические свойства
цвет пламени
ρ t плавления
1,74г/см3 651 С0
1,54г/см3 851С0
2,63г/см3 770С0
3,76г/см3 710С0
1,74г/см3 651 С0
1,54г/см3 851С0
2,63г/см3 770С0
3,76г/см3 710С0
Mg
Ca
Sr
Ba
Слайд 5Химические свойства
2Me0 +O2 → 2Me+2O-2
Me0 +H2 → Me+2H2
Me0 +Cl02
→ Me+2Cl2
Me0 +S0 → Me+2S-2
Me0 +2HCl → Me+2Cl2 + H2
Me0 +2HOH → Me+2(OH)2 +Н2
Me0 +S0 → Me+2S-2
Me0 +2HCl → Me+2Cl2 + H2
Me0 +2HOH → Me+2(OH)2 +Н2
Слайд 6Соединения щелочноземельных
металлов
Оксиды щелочноземельных металлов легко реагируют с оксидами неметаллов с образованием
соответствующих солей.
Слайд 7BaSO4
Благодаря нерастворимости и способности задерживать рентгеновские лучи применяется в рентгенодиагностике
– баритовая каша.
Слайд 8Ca3(PO4)2
Входит в состав фосфоритов и апатитов, а также в состав
костей и зубов. В организме взрослого человека содержится 1 кг Са в виде фосфата кальция.
Слайд 9CaCO3
Карбонат кальция – одно из самых распространённых на Земле соедине-ний. Его
содержат горные породы – мел, мрамор, известняк.
Слайд 10CaSO4∙ 2H2O
Встречается в природе в виде минерала гипса, представляющего собой
кристаллогидрат. Используется в строитель-стве, в медицине для наложения гипсовых повя-зок, для получения слепков.
Слайд 11MgCO3
Широко применяется в производстве стекла, цемента, кирпича, а также
в металлургии для перевода пустой породы в шлак.
Слайд 12Са(ОН)2
Гидроксид кальция или гашёная известь с песком и водой
называется известковым раствором и широко используется в строительстве. При нагревании разлагается на оксид и воду.
Слайд 13Проверка знаний
Сравните атомы элементов, поставив знаки
> или = вместо *:
а) заряд ядра: Mg * Ca, Na *Mg, Ca * К;
б) число электронных слоев: Mg * Ca, Na * Mg,
Ca * К;
в) число электронов на внешнем уровне: Mg * Ca, Na *Mg, Ca * К;
г) радиус атома: Mg * Ca, Na * Mg, Ca * K;
д) восстановительные свойства: Mg * Ca, Na * Mg, Ca * K.
а) заряд ядра: Mg * Ca, Na *Mg, Ca * К;
б) число электронных слоев: Mg * Ca, Na * Mg,
Ca * К;
в) число электронов на внешнем уровне: Mg * Ca, Na *Mg, Ca * К;
г) радиус атома: Mg * Ca, Na * Mg, Ca * K;
д) восстановительные свойства: Mg * Ca, Na * Mg, Ca * K.
Слайд 14 Проверь себя
(самостоятельная работа )
Дополните схемы взаимодействия щелочноземельных металлов с неметаллами общими формулами и названиями продуктов реакции.
Запишите конкретные уравнения реакции, расставив коэффициенты в них методом электронного баланса:
а) М + S б) М + N2
в) М + Н 2 г) М + С12
Пример: ___________________ Пример: _____________________
Допишите уравнения реакций:
а) Са + H2O → ……………………….
б) Mg + НСl →……………………….
в) Ва + О2 →………………………..
Осуществить превращения по схеме:
Ме → МеО → Ме(ОН)2 → МеSО4
Запишите конкретные уравнения реакции, расставив коэффициенты в них методом электронного баланса:
а) М + S б) М + N2
в) М + Н 2 г) М + С12
Пример: ___________________ Пример: _____________________
Допишите уравнения реакций:
а) Са + H2O → ……………………….
б) Mg + НСl →……………………….
в) Ва + О2 →………………………..
Осуществить превращения по схеме:
Ме → МеО → Ме(ОН)2 → МеSО4
Слайд 15Используемая литература
Рудзитис Г.Е., Фельдман Ф.Г. Химия 9.- Москва.: Просвещение, 2001
Габриелян О.С.
Химия 9.-Москва.:Дрофа,
2008
Габриелян О.С., Остроумов И.Г. Настольная книга учителя. Химия 9.-Москва.:Дрофа 2002
Коллекция Виртуальной лаборатории. Учебное электронное издание
2008
Габриелян О.С., Остроумов И.Г. Настольная книга учителя. Химия 9.-Москва.:Дрофа 2002
Коллекция Виртуальной лаборатории. Учебное электронное издание