Мухина Ирина Валентиновна
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Подгруппа азота. Азот. (9 класс)
Содержание
- 1. Презентация по химии на тему Подгруппа азота. Азот. (9 класс)
- 2. Положение в Периодической системе химических элементов
- 3. Положение в Периодической системе химических элементов и
- 4. Соединения: с водородомОбщая формула R-3H3 NH3
- 5. Соединения: с кислородомОксиды R+32O3N2O3 оксид азота(III)P2O3 оксид
- 6. Соединения: с кислородомОксиды R+52O5N2O5оксид азота(V)P2O5 оксид фосфора
- 7. Азот7N14 7p, 7n, 7ēV группа главная подгруппа,
- 8. Нахождение в природеВ свободном виде - в
- 9. Строение молекулыN2 образование молекулы азота:В молекуле азота:
- 10. Физические свойства азотаГаз, без цвета, без запаха
- 11. Химические свойства азотаВзаимодействует с металлами при нагревании,
- 12. Химические свойства азотаС кислородом и фтором азот
Слайд 1Подгруппа азота.
Азот.
Пниктогены.
МБОУ «Гимназия № 6 имени академика-кораблестроителя А.Н. Крылова»
города Алатыря
Слайд 2 Положение в Периодической системе химических элементов и строение атомов.
N, P,
На внешнем энергетическом уровне 5 ē
До заполнения внешнего энергетического уровня не хватает 3 ē → степень окисления - -3 (низшая степень окисления)
Могут отдать 5 ē с внешнего энергетического уровня → степень окисления - +5 (высшая степень окисления)
Слайд 3Положение в Периодической системе химических элементов и строение атомов.
От N к
число энергетических уровней ↑,
число ē на внешнем энергетическом уровне постоянно,
радиусы атомов ↑ =>
неметаллические свойства (и окислительные) ослабевают, а металлические (и восстановительные) усиливаются
Слайд 4Соединения: с водородом
Общая формула R-3H3
NH3 –аммиак
PH3 – фосфин
AsH3 –
SbH3 – стибин
BiH3 -висмутин
Водные растворы проявляют основные свойства
От NH3 к BiH3:
основные свойства растворов ослабевают
восстановительные соединений свойства усиливаются
стабильность соединений уменьшается
Слайд 5Соединения: с кислородом
Оксиды R+32O3
N2O3 оксид азота(III)
P2O3 оксид фосфора (III)
As2O3 оксид мышьяка
Кислотные оксиды
Кислоты HR+3O2
HNO2 – азотистая кислота
HPO2 (H3PO3) – фосфористая кислота
H3AsO3 – мышьяковистая кислота
Все – слабые электролиты
От HNO2 к H3AsO3 сила кислот убывает
Проявляют и окислительные, и восстановительные свойства
Слайд 6Соединения: с кислородом
Оксиды R+52O5
N2O5оксид азота(V)
P2O5 оксид фосфора (V)
As2O5 оксид мышьяка (V)
Кислотные
Кислоты HR+5O3
HNO3 – азотная кислота
HPO3(H3PO4) – фосфорная кислота
H3AsO4 – мышьяковая кислота
HNO3 – сильный электролит
От HNO3 к H3AsO4 сила кислот убывает
Проявляют только окислительные свойства.
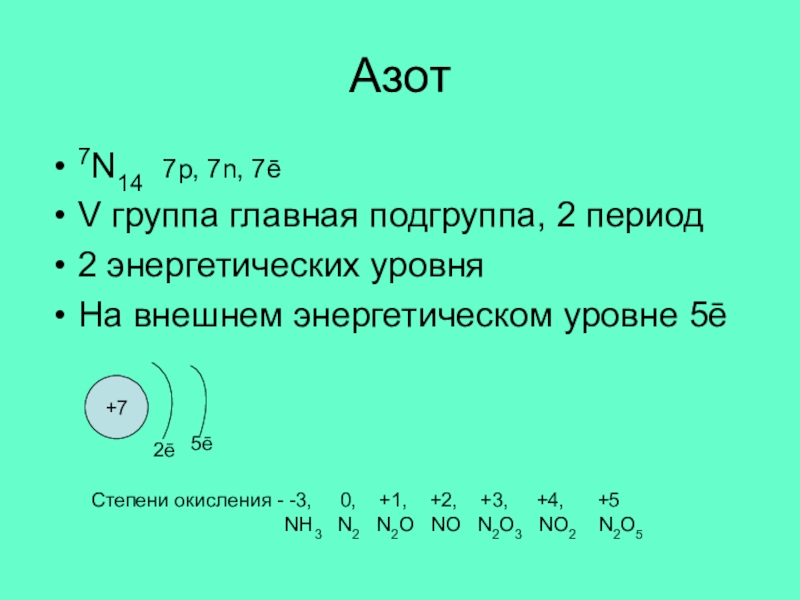
Слайд 7Азот
7N14 7p, 7n, 7ē
V группа главная подгруппа, 2 период
2 энергетических уровня
На
+7
2ē
5ē
Степени окисления - -3, 0, +1, +2, +3, +4, +5
NH3 N2 N2O NO N2O3 NO2 N2O5
Слайд 8Нахождение в природе
В свободном виде - в воздухе(78% по объёму)
Входит в
Входит в состав белков (гемоглобин-белок крови, миозин – белок мышц и т.д.). В среднем белок на 16% состоит из азота.
Слайд 9Строение молекулы
N2
образование молекулы азота:
В молекуле азота:
Ковалентная неполярная химическая
Тройная химическая связь, благодаря чему
молекула азота очень прочная и химически неактивная.
Слайд 10Физические свойства азота
Газ, без цвета, без запаха и вкуса.
При охлаждении до
Малорастворим в воде
Слайд 11Химические свойства азота
Взаимодействует с металлами при нагревании, образуя нитриды:
С литием
3Mg + N2 → Mg3N2
Нитрид магния
6Li + N2 → 2Li3N
Нитрид лития
Азот при взаимодействии с металлами проявляет
окислительные свойства
Слайд 12Химические свойства азота
С кислородом и фтором азот проявляет восстановительные свойства:
N2 +
Оксид азота (II)
Реакция протекает при температуре электрической дуги - 3000о -4000оС