- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Периодический закон и ПСХЭ Д.И. Менделеева
Содержание
- 1. Презентация по химии на тему Периодический закон и ПСХЭ Д.И. Менделеева
- 2. Первые попытки классификации химических элементов В начале XIX
- 3. Первые попытки классификации химических элементов Ряд ученых предпринимали
- 4. Первые попытки классификации химических элементов
- 5. Первые попытки классификации химических элементов
- 6. Периодический закон Проблему классификации
- 7. Периодический закон 17 февраля 1869 г.
- 8. Периодический закон 1 марта 1869 г.
- 9. Периодический закон Свойства химических элементов, а также
- 10. На основе периодического закона была
- 11. Слайд 11
- 12. Слайд 12
- 13. Периоды – горизонтальные ряды химических элементов, начинающиеся
- 14. Группы – это вертикаль-ные ряды химических элементов,
- 15. Зависимость свойств химических элементов от положения в
- 16. Зависимость свойств химических элементов от положения в
- 17. Строение атома и атомного ядра.
- 18. В природе
- 19. Движение электрона в атоме Современная модель атома строится
- 20. Важнейшей характеристикой электрона является энергия его связи
- 21. На одном энергетическом уровне могут находиться орбитали,
- 22. Форма облаков s-, p-, d-электронов и их
- 23. Порядок заполнения электронами
- 24. На одной орбитали может находиться только два
- 25. Характеристика элемента по его положению в ПСХЭЗнак
- 26. Сравнение свойств простого вещества со свойствами простых
- 27. Генетический ряд металла:Металл
Слайд 2Первые попытки классификации химических элементов
В начале XIX в. было известно 63
Как Вы думаете, почему проблема классификации химических элементов приобрела особую остроту?
Какую классификацию химических элементов можно было предложить в тот период?
Слайд 3Первые попытки классификации химических элементов
Ряд ученых предпринимали попытки классифицировать известные химические
В 1829 г. профессор химии, технологии и фармакологии Йенского университета (Германия) Иоганн Вольфганг Дёберейнер предложил идею объединения элементов в группы, основываясь на сходстве их свойств. Расположив элементы в порядке увеличения их атомных масс, он обнаружил, что атомная масса среднего из трёх сходных по свойствам элементов равна примерно среднему арифметическому атомных масс двух соединений. В соответствии с этим Деберейнер составил следующие триады элементов:
Li (7) Na (23) K (39)
Ca (40) Sr (88) Ba (137)
Cl (35,5) Br (80) I (127)
S (32) Se (79) Te (128)
Слайд 4Первые попытки классификации химических элементов
В 1862 г. французский
В 1863 – 1865 гг. Джон Александер Ньюлендс упорядочил элементы в соответствии с их атомными массами и обнаружил, что номера аналогичных элементов отличаются на величину 7.
Слайд 5Первые попытки классификации химических элементов
В 1864 г. немецкий
При построении своей таблицы Майер использовал общепринятые в то время значения атомных масс. (Некоторые из них, как было установлено позже, были определены неправильно. Кроме того, в его таблице не нашлось места для водорода, бора и алюминия.)
Первые попытки классификации химических элементов окончились неудачей, так как не удалось объединить все элементы в единую систему.
Слайд 6Периодический закон
Проблему классификации химических элементов удалось решить
Сравнивая относительные атомные массы элементов и химические свойства простых веществ, Д. И. Менделеев обнаружил закономерное повторение свойств элементов и их соединений.
Слайд 7Периодический закон
17 февраля 1869 г. Д. И.
«...элементы, расположенные по величинам их атомного веса представляют явствен-ную периодичность свойств.»
Д.И. Менделеев.
Слайд 8Периодический закон
1 марта 1869 г. он разослал свой вариант
Но на этом его работа не закончилась, она только началась – трудная и кропотливая, продолжающаяся и по сей день.
Слайд 9Периодический закон
Свойства химических элементов, а также свойства и формы их
(Формулировка
Д.И. Менделеева)
Сегодня периодический закон читается так:
Свойства химических элементов, а также свойства и формы их соединений находятся в периодической зависимости от заряда атомных ядер.
Слайд 10
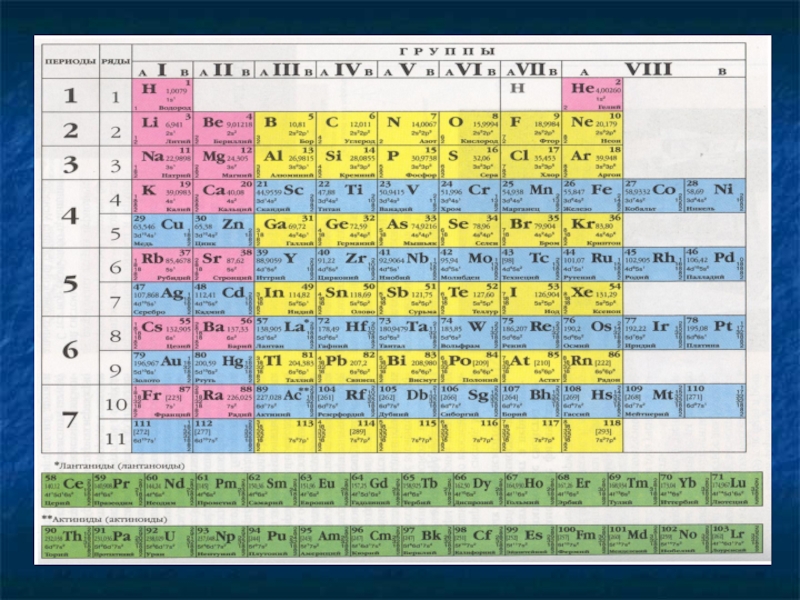
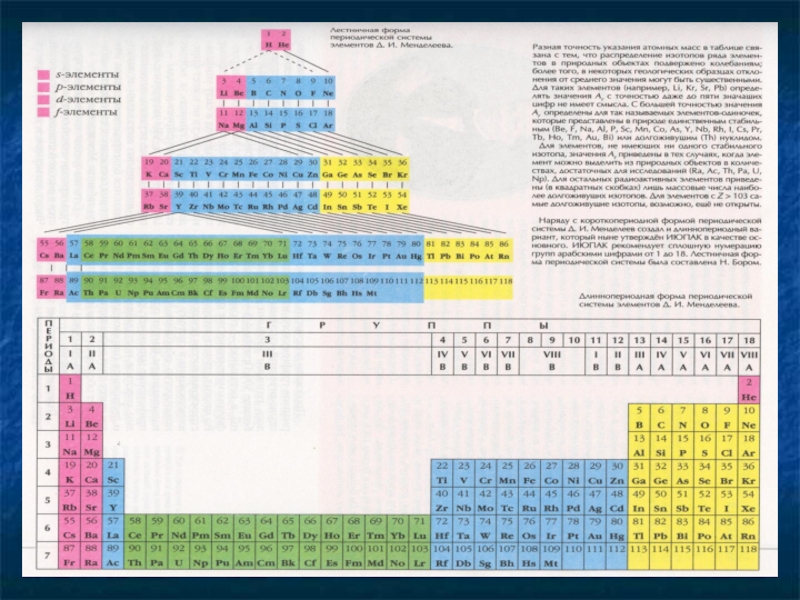
На основе периодического закона была построена периодическая система.
Периодическая система
Периодическая таблица – это графическое изображение периодической системы.
Слайд 13Периоды – горизонтальные ряды химических элементов, начинающиеся щелочными металлами и заканчивающиеся
1
2 малые периоды
3
4 чётный ряд
нечётный ряд
большие 5
периоды 6
7
Периодическая система состоит из горизонтальных и вертикальных рядов.
Слайд 14
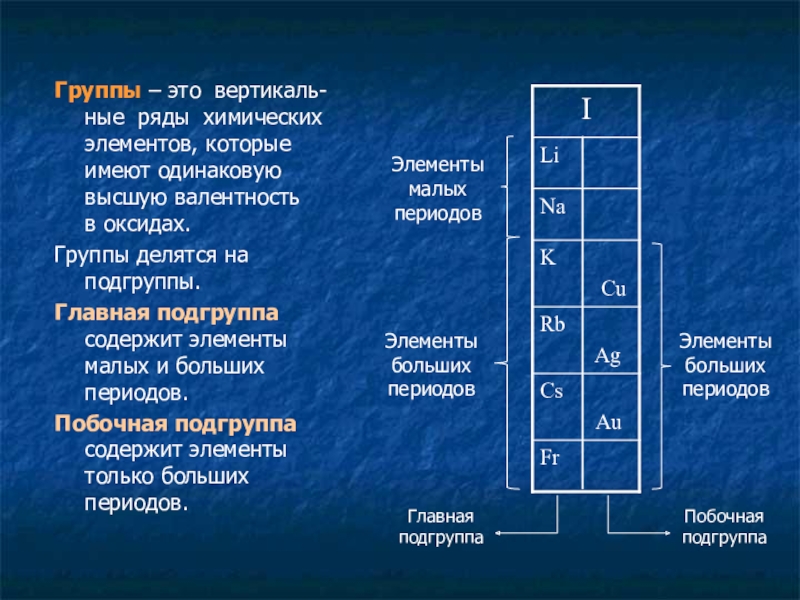
Группы – это вертикаль-ные ряды химических элементов, которые имеют одинаковую высшую
Группы делятся на подгруппы.
Главная подгруппа содержит элементы малых и больших периодов.
Побочная подгруппа содержит элементы только больших периодов.
Элементы малых периодов
Элементы больших периодов
Элементы больших периодов
Побочная подгруппа
Главная подгруппа
Слайд 15Зависимость свойств химических элементов от положения в ПСХЭ
В периоде с увеличением
атомные радиусы уменьшаются;
относительная электроотрицательность атомов увеличивается;
металлические свойства уменьшаются;
неметаллические свойства увеличиваются;
восстановительные свойства уменьшаются;
окислительные свойства увеличиваются;
высшая валентность увеличивается от I до VIII;
свойства соединений изменяются от основных через амфотерные к кислотным.
Слайд 16Зависимость свойств химических элементов от положения в ПСХЭ
В группе главной подгруппе
атомные радиусы увеличиваются;
относительная электроотрицательность атомов уменьшается;
металлические свойства увеличиваются;
неметаллические свойства уменьшаются;
восстановительные свойства увеличиваются;
окислительные свойства уменьшаются;
свойства соединений изменяются от кислотных через амфотерные к основным.
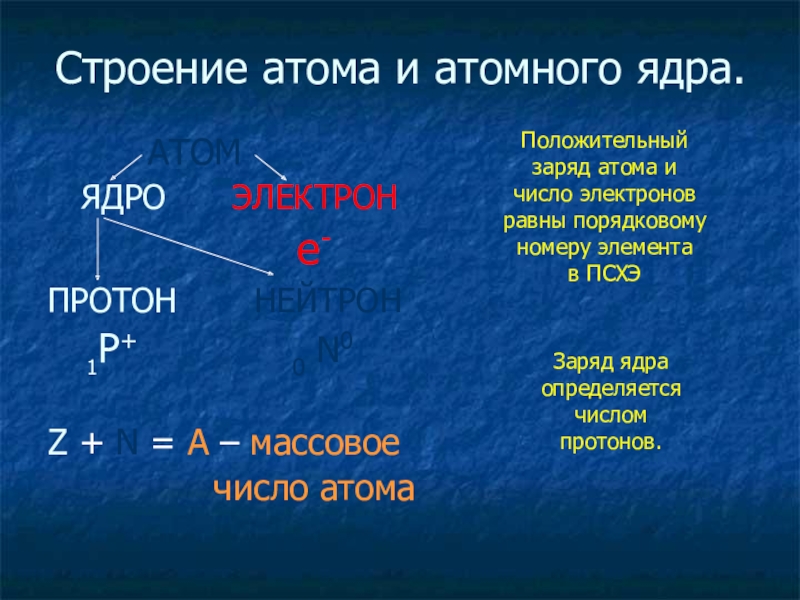
Слайд 17Строение атома и атомного ядра.
АТОМ
e-
ПРОТОН НЕЙТРОН
1Р+ 0 N0
Z + N = A – массовое
число атома
Заряд ядра определяется числом протонов.
Положительный заряд атома и число электронов равны порядковому номеру элемента в ПСХЭ
Слайд 18
В природе встречаются атомы одного и
1Н – протий 1Н – дейтерий 1Н – тритий
е = 1 е = 1 е = 1
р+ = 1 р+ = 1 р+ = 1
n0 = 0 n0 = 1 n0 = 2
Изотопы –
это разновидности атомов одного элемента, имеющих одинаковое число протонов и различное число нейтронов, а значит разную массу.
Слайд 19Движение электрона в атоме
Современная модель атома строится на представлении о микромире.
Часть атомного пространства, в которой вероятность нахождения данного электрона наибольшая, называется электронным облаком.
Пространство, в котором движется электрон, называют орбиталью.
Слайд 20
Важнейшей характеристикой электрона является энергия его связи с атомом. Электроны, обладающие
Энергетические уровни нумеруют от ядра.
Схема электронного строения
показывает распределение
электронов по энергетичес-
ким уровням
11Na
Номер периода в ПСХЭ показывает число энергетиче6ских уровней в атоме
+11
2
8
1
Слайд 21
На одном энергетическом уровне могут находиться орбитали, которые имеют различные геометрические
Поэтому энергетические уровни состоят из энергетических подуровней.
Слайд 22
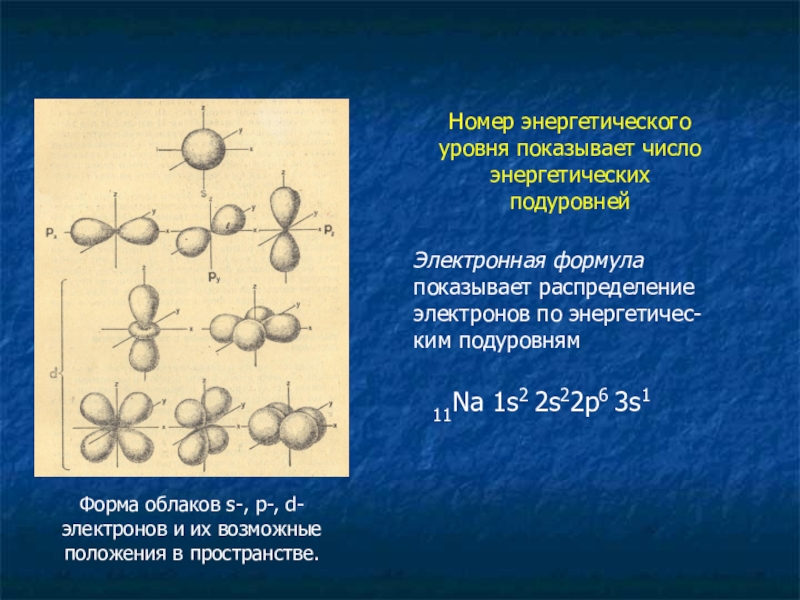
Форма облаков s-, p-, d-электронов и их возможные положения в пространстве.
Номер
Электронная формула показывает распределение электронов по энергетичес- ким подуровням
11Na 1s2 2s22p6 3s1
Слайд 23
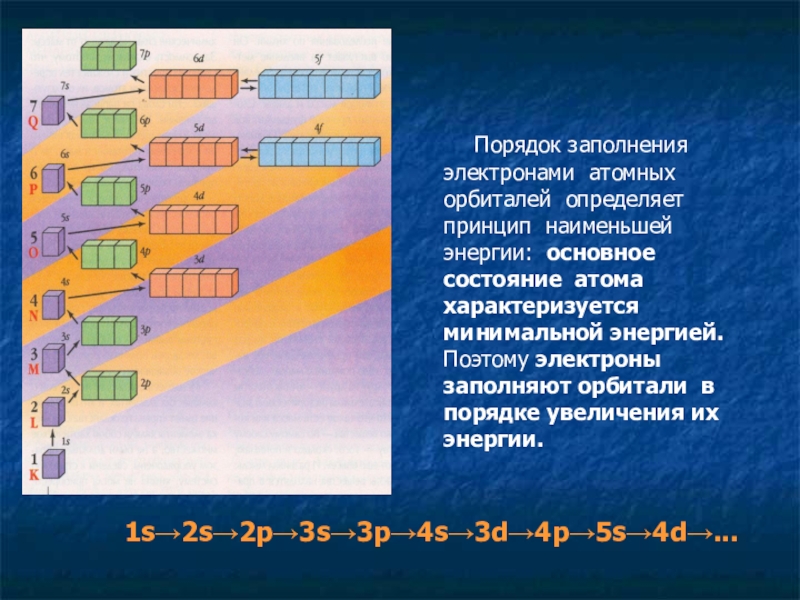
Порядок заполнения электронами атомных орбиталей определяет принцип
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→...
Слайд 24
На одной орбитали может находиться только два электрона.
Электронно – графическая
11Na
s
p
3
2
1
Слайд 25Характеристика элемента по его положению в ПСХЭ
Знак химического элемента, его относительная
Положение в ПСХЭ: № периода (малый или большой); № группы, подгруппа (главная или побочная).
Строение атома: е, р+, n0.
Электронное строение атома: электронная и электронно-графическая формулы.
Характер простого вещества.
Сравнение свойств простого вещества со свойствами простых веществ, образованных соседями по подгруппе элементов.
Слайд 26Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по
Состав высшего оксида, его характер (основнй, амфотерный, кислотный)
Состав высшего гидроксида, его характер (кислородосодержащая кислота, основание, амфотерный гидроксид).
Состав летучего водородного соединения (для элементов IV-VII групп главных подгрупп).
Слайд 27Генетический ряд металла:
Металл Основный
(простое
вещество) оксид
Генетический ряд неметалла:
Неметалл Кислотный
(простое ? ? Кислота ? Соль
вещество) оксид