- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Периодическая система химических элементов
Содержание
- 1. Презентация по химии на тему: Периодическая система химических элементов
- 2. Цели урока: Сформировать представления о строении периодической системы2. Освоить на практике закономерности изменения свойств элементов.
- 3. Историческая справка Открыта 1 марта 1969 Д.
- 4. Периодическая система химических элементов Д.И.Менделеева (длиннопериодный вариант)
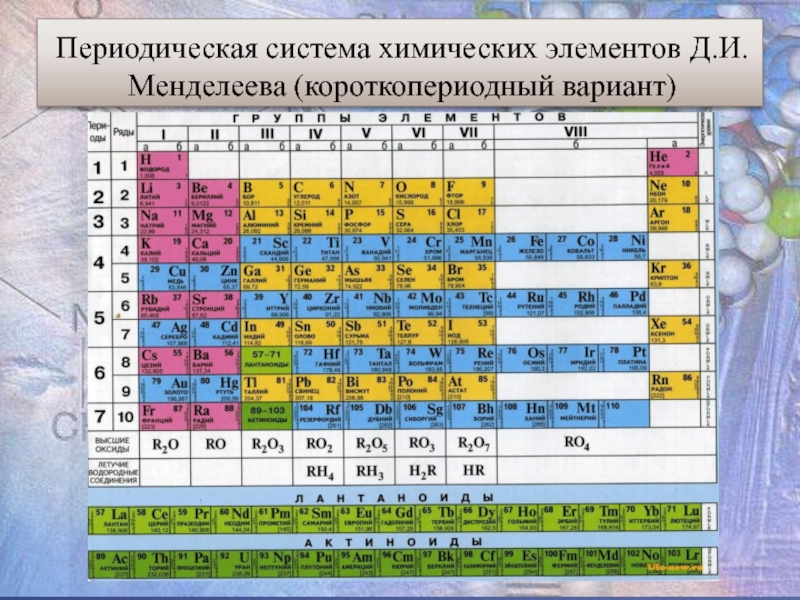
- 5. Периодическая система химических элементов Д.И.Менделеева (короткопериодный вариант)
- 6. Слайд 6
- 7. Горизонтальные ряды , сходные по
- 8. Изменение свойств элементов в периодахR атома уменьшается;Заряд
- 9. Вертикальные ряды , сходные по
- 10. Изменение свойств элементов в группахR атома увеличивается;Заряд
- 11. Сравнить:Радиус атома:
- 12. Сравнить:Радиус атома:
Цели урока: Сформировать представления о строении периодической системы2. Освоить на практике закономерности изменения свойств элементов.
Слайд 2Цели урока:
Сформировать представления о строении периодической системы
2. Освоить на практике
закономерности изменения свойств элементов.
Слайд 3Историческая справка
Открыта 1 марта 1969 Д. И. Менделеевым
Является графическим отображением
периодического закона
Известны более 400 вариантов, но самые используемые короткий и длинный вариант
Известны более 400 вариантов, но самые используемые короткий и длинный вариант
Слайд 7 Горизонтальные ряды , сходные по свойству химических элементов, начинающиеся
щелочным металлом и заканчивающиеся инертным газом
Подразделяются на малые (1,2,3,7) и большие (4,5,6)
Номер периода равен числу энергетических уровней
Подразделяются на малые (1,2,3,7) и большие (4,5,6)
Номер периода равен числу энергетических уровней
Периоды
Слайд 8Изменение свойств элементов в периодах
R атома уменьшается;
Заряд ядра увеличивается;
Число энергетических уровней
не изменяется;
Число электронов на внешнем уровне увеличивается;
Металлические свойства ослабевают;
Неметаллические свойства усиливаются.
Число электронов на внешнем уровне увеличивается;
Металлические свойства ослабевают;
Неметаллические свойства усиливаются.
Слайд 9 Вертикальные ряды , сходные по свойству химических элементов
Подразделяются на главные и побочные
Номер группы равен числу электронов на внешнем энергетическом уровне
Номер группы равен числу электронов на внешнем энергетическом уровне
Группы
Слайд 10Изменение свойств элементов в группах
R атома увеличивается;
Заряд ядра увеличивается;
Число энергетических уровней
увеличивается;
Число электронов на внешнем уровне не изменяется;
Металлические свойства усиливаются;
Неметаллические свойства уменьшаются.
Число электронов на внешнем уровне не изменяется;
Металлические свойства усиливаются;
Неметаллические свойства уменьшаются.
Слайд 11Сравнить:
Радиус атома:
Na * Mg S * O
Заряд ядра: Ca* Mg N * P
Число энергетических уровней: Na * Mg S * O
Число электронов на внешнем уровне: Ca* Mg N * P
Металлические свойства: Na * Mg S * O
Неметаллические свойства: Ca* Mg N * P
Заряд ядра: Ca* Mg N * P
Число энергетических уровней: Na * Mg S * O
Число электронов на внешнем уровне: Ca* Mg N * P
Металлические свойства: Na * Mg S * O
Неметаллические свойства: Ca* Mg N * P
Самостоятельная работа
Слайд 12Сравнить:
Радиус атома:
Na < Mg S < O
Заряд ядра: Ca < Mg С < F
Число энергетических уровней: Na = Mg S > O
Число электронов на внешнем уровне: Ca = Mg С < F
Металлические свойства: Na > Mg S > O
Неметаллические свойства: Ca < Mg С < F
Заряд ядра: Ca < Mg С < F
Число энергетических уровней: Na = Mg S > O
Число электронов на внешнем уровне: Ca = Mg С < F
Металлические свойства: Na > Mg S > O
Неметаллические свойства: Ca < Mg С < F
Проверь себя: