- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Периодическая система химических элементов Д.И. Менделеева
Содержание
- 1. Презентация по химии на тему: Периодическая система химических элементов Д.И. Менделеева
- 2. Слайд 2
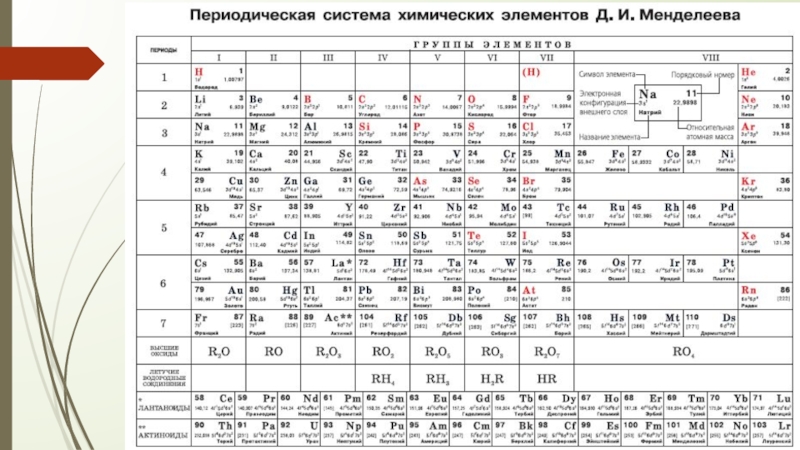
- 3. Периодическая система химических элементов Д. И. Менделеева
- 4. План составления схемы строения электронной оболочки атомов:Записываем
- 5. Инертные (благородные) газыПричина инертности (химической неактивности): завершенный внешний энергетический уровень
- 6. 8 электронов на внешнем энергетическом уровнеОтдача электронов
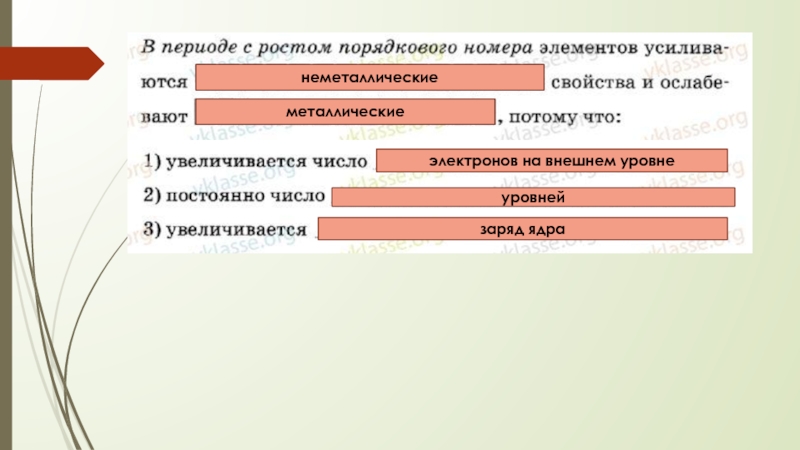
- 7. В периоде слева направо:1) Заряд ядра –
- 8. В группе, в главной подгруппе сверху вниз:1)
- 9. Подведение итогов1 марта 1869г. Формулировка периодического закона
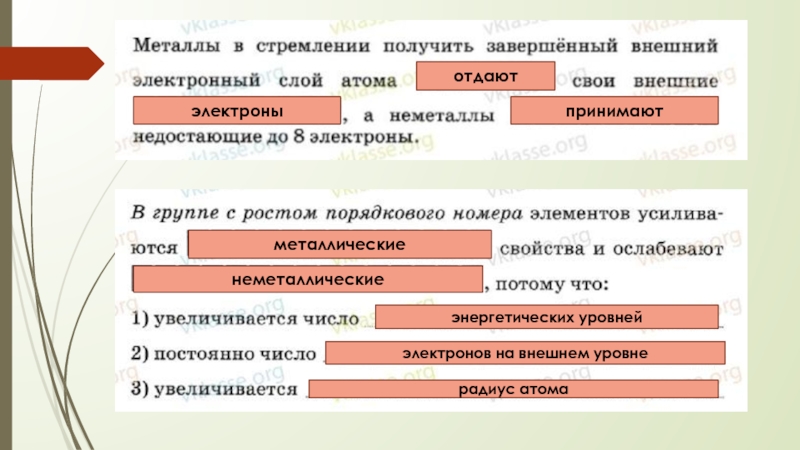
- 10. отдаютэлектроныпринимаютметаллическиенеметаллическиеэнергетических уровнейэлектронов на внешнем уровнерадиус атома
- 11. неметаллическиеметаллическиеэлектронов на внешнем уровнеуровнейзаряд ядра
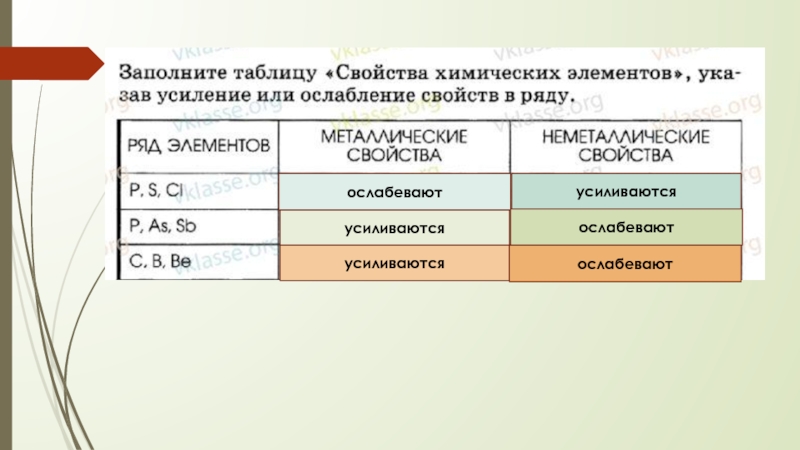
- 12. ослабеваютусиливаютсяусиливаютсяусиливаютсяослабеваютослабевают
- 13. Домашнее заданиепараграф 10 до стр 63 (таблица включительно)стр 66 № 3, 4
Слайд 1Периодическая система химических элементов
Д. И. Менделеева
Подготовила студентка ТГПУ им. Л.Н.
направления подготовки: «Педагогическое образование»
Профили «Биология» и «Химия»
Карелина Мария Михайловна
Слайд 3Периодическая система химических элементов Д. И. Менделеева
Порядковый номер химического элемента -
Период – химические элементы, расположенные в строчку (периодов всего 7). Период определяет количество энергетических уровней в атоме.
Группы – химические элементы, расположенные в столбик (групп всего 8). Группа определяет количество электронов внешнего уровня для элементов главных подгрупп.
Химический элемент – это вид атомов с определённым зарядом ядра.
Слайд 4План составления схемы строения электронной оболочки атомов:
Записываем знак химического элемента и
Определяем количество энергетических уровней (оно равно номеру периода) и количество электронов на каждом уровне (на первом – не больше двух, на втором – не больше восьми, на внешнем уровне число электронов равно номеру группы)
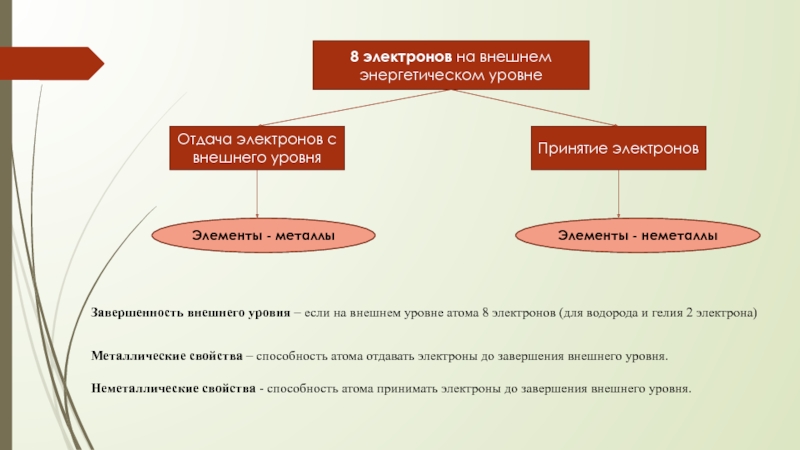
Слайд 5Инертные (благородные) газы
Причина инертности (химической неактивности): завершенный внешний энергетический уровень
Слайд 68 электронов на внешнем энергетическом уровне
Отдача электронов с внешнего уровня
Принятие электронов
Элементы
Элементы - неметаллы
Завершенность внешнего уровня – если на внешнем уровне атома 8 электронов (для водорода и гелия 2 электрона)
Металлические свойства – способность атома отдавать электроны до завершения внешнего уровня.
Неметаллические свойства - способность атома принимать электроны до завершения внешнего уровня.
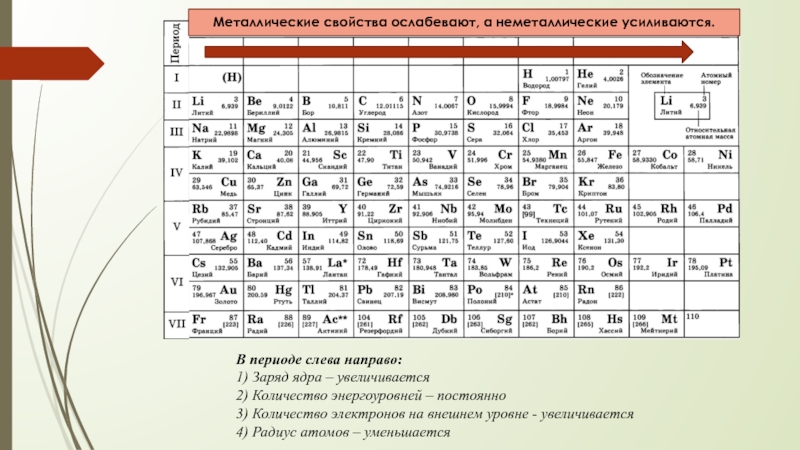
Слайд 7В периоде слева направо:
1) Заряд ядра – увеличивается
2) Количество энергоуровней –
3) Количество электронов на внешнем уровне - увеличивается
4) Радиус атомов – уменьшается
Металлические свойства ослабевают, а неметаллические усиливаются.
Слайд 8В группе, в главной подгруппе сверху вниз:
1) Заряд ядра – увеличивается
2)
3) Число электронов на внешнем уровне – постоянно
4) Радиус атомов - увеличивается
металлические
свойства элементов усиливаются, неметаллические - ослабевают.
Слайд 9Подведение итогов
1 марта 1869г. Формулировка периодического закона Д.И. Менделеева.
Свойства простых веществ,
Современная формулировка периодического закона
Свойства химических элементов и их соединений находятся в периодической зависимости от величины заряда ядер их атомов, выражающейся в периодической повторяемости структуры внешней электронной оболочки.