- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Основные законы химии 10 класс
Содержание
- 1. Презентация по химии на тему: Основные законы химии 10 класс
- 2. СодержаниеОсновные законы химии......................................... Обозначения, названия и единицы физической величины…………………………………………………………….. Задания......................................................................
- 3. Закон сохранения массы. Был открыт М. В. Ломоносовым
- 4. Стехиометрия – раздел химии, в котором рассматриваются
- 5. При разложении воды, кислот, щелочей или солей
- 6. Закон постоянства состава вещества. Сформулирован Ж.-Л. Прустом в
- 7. Вещества постоянного состава называют дальтонидами в честь
- 8. закону постоянства состава подчиняются главным образом
- 9. Современная формулировка закона постоянства состава вещества таков: Состав
- 10. Закон Авогадро. Сформулирован А. Авогадро в результате проведения
- 11. Н2 + Сl2 = 2 HСl
- 12. Из закона Авогадро вытекают 2
- 13. Массы двух разных газов, занимающих одинаковый объем
- 14. Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона). илигде p
- 15. Основные законы химии
- 16. Найдите относительные молекулярные массы веществ, состав которых
- 17. Какова масса
- 18. Список использованной литературыГабриелян О.С. Химия для профессий
СодержаниеОсновные законы химии......................................... Обозначения, названия и единицы физической величины…………………………………………………………….. Задания......................................................................
Слайд 2Содержание
Основные законы химии.........................................
Обозначения, названия и единицы физической величины……………………………………………………………..
Задания......................................................................
Слайд 3Закон сохранения массы.
Был открыт М. В. Ломоносовым и сформулирован А. Лавуазье:
Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции.
Этот закон является одним из основных стехиометрических законов химии, , все расчёты по химическим реакциям производятся на его основе.
Слайд 4
Стехиометрия – раздел химии, в котором рассматриваются массовые и объемные соотношения
между реагирующими веществами, вывод химических формул и составление уравнений химических реакций.
Слайд 5
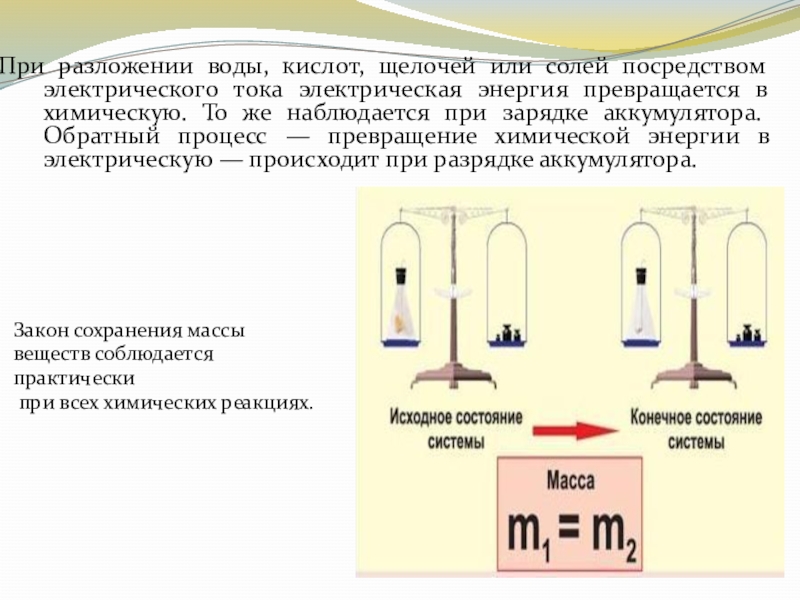
При разложении воды, кислот, щелочей или солей посредством электрического тока электрическая
энергия превращается в химическую. То же наблюдается при зарядке аккумулятора. Обратный процесс — превращение химической энергии в электрическую — происходит при разрядке аккумулятора.
Закон сохранения массы
веществ соблюдается
практически
при всех химических реакциях.
Закон сохранения массы
веществ соблюдается
практически
при всех химических реакциях.
Слайд 6
Закон постоянства состава вещества.
Сформулирован Ж.-Л. Прустом в 1799 г.:
Всякое чистое вещество
независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
Закон находится в соответствии с атомно-молекулярным учением. Молекула любого вещества состоит из определённого количества атомов, имеющих постоянную массу. Массовый состав и состав вещества постоянны независимо от способа его получения. Такие соединения называются дальтониды.
Закон находится в соответствии с атомно-молекулярным учением. Молекула любого вещества состоит из определённого количества атомов, имеющих постоянную массу. Массовый состав и состав вещества постоянны независимо от способа его получения. Такие соединения называются дальтониды.
Слайд 7
Вещества постоянного состава называют дальтонидами в честь английского физика и химика
Дж. Дальтона,
Вещества переменного состава – бертоллидами в честь французского химика К. Бертолле.
Вещества переменного состава – бертоллидами в честь французского химика К. Бертолле.
Слайд 8
закону постоянства состава подчиняются главным образом вещества, имеющие молекулярную структуру,
если же вещества не имеют молекулярной структуры, то возможны отклонения от этого закона.
Однако уже в начале XIX в. К. Бертолле показал:
элементы могут соединятся друг с другом в разных соотношениях в зависимости от массы реагирующих веществ.
Слайд 9
Современная формулировка закона постоянства состава вещества таков:
Состав соединений молекулярной структуры является
постоянным независимо от способа их получения. Состав соединений немолекулярной структуры (с атомной, ионной или металлической кристаллической решеткой) не является постоянным и зависит от способа их получения.
Слайд 10
Закон Авогадро.
Сформулирован А. Авогадро в результате проведения многочисленных экспериментов:
В равных объемах
различных газов при одинаковых условиях содержится одинаковое число молекул.
Слайд 11Н2 + Сl2 = 2 HСl
1 молекула 1 молекула 2 молекулы
1 объем 1 объем 2 объема
молекулы простых газов состоят из двух атомов: О2, Н2, Cl2, N2. При этом допущении реакцию между хлором и водородом, приводящую к образованию хлороводорода можно представить уравнением:
из которого видно, что из одной молекулы водорода и одной молекулы хлора образуются две молекулы хлороводорода. Следовательно, и объём, занимаемый хлороводородом, должен быть вдвое больше объёма вступившего в реакцию водорода или хлора. Суммарный же объём исходных газов в соответствии с приведённым уравнением должен быть равен объёму образовавшегося хлороводорода.
1 объем 1 объем 2 объема
молекулы простых газов состоят из двух атомов: О2, Н2, Cl2, N2. При этом допущении реакцию между хлором и водородом, приводящую к образованию хлороводорода можно представить уравнением:
из которого видно, что из одной молекулы водорода и одной молекулы хлора образуются две молекулы хлороводорода. Следовательно, и объём, занимаемый хлороводородом, должен быть вдвое больше объёма вступившего в реакцию водорода или хлора. Суммарный же объём исходных газов в соответствии с приведённым уравнением должен быть равен объёму образовавшегося хлороводорода.
Слайд 12 Из закона Авогадро вытекают 2 следствия:
Один моль любого газа
при одинаковых условиях занимает один и тот же объем. Этот объем, называемый молярным ( ), при нормальных условиях (давление = 101325 Па и абсолютной температуре = 273,15 К) равен 22,4 л:
Слайд 13
Массы двух разных газов, занимающих одинаковый объем при одинаковых условиях, относятся
между собой как их молярные массы
Отношение масс двух газов, занимающих равный объем при одинаковых условиях, называют относительной плотностью одного газа по другому и обозначают буквой D.
Отношение масс двух газов, занимающих равный объем при одинаковых условиях, называют относительной плотностью одного газа по другому и обозначают буквой D.
Слайд 14
Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона).
или
где p – давление;
V –
объем газа; m – масса газа;
М – молярная масса газа;
Т – температура;
n – количество вещества газа, моль;
R – универсальная газовая постоянная, значение которой зависит от единиц, в которых измеряют давление и объем.
М – молярная масса газа;
Т – температура;
n – количество вещества газа, моль;
R – универсальная газовая постоянная, значение которой зависит от единиц, в которых измеряют давление и объем.
Слайд 16Найдите относительные молекулярные массы веществ, состав которых описывается формулами:
Рассчитайте относительные молекулярные
массы медного купороса и кристаллической соды
Задания
Слайд 17
Какова масса молекул
аммиака ?
Какова масса 5,6 (н. у.) углекислого газа? Сколько молекул содержится в этом объеме газа?
Каков объем 128 г сернистого газа при нормальных условиях? Сколько молекул содержится в 128 г этого газа?
Найдите массу кислорода, содержащегося в баллоне объемом 50 л при температуре и давлении 790 кПа.
Какова масса 5,6 (н. у.) углекислого газа? Сколько молекул содержится в этом объеме газа?
Каков объем 128 г сернистого газа при нормальных условиях? Сколько молекул содержится в 128 г этого газа?
Найдите массу кислорода, содержащегося в баллоне объемом 50 л при температуре и давлении 790 кПа.
Задания
Слайд 18Список использованной литературы
Габриелян О.С. Химия для профессий и специальностей технического профиля.
Учебник - М. Академия, 2011.
Габриелян О.С. Химия: учеб. для студ. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. – М., 2009.
Габриелян О.С. Химия. 8-11 класс. Базовый уровень: учеб. для общеобразоват. учреждений. – М., 2006.
1с химия. Мультимедийное пособие
Тестер А.Баженова. http://edu-lider.ru/proverka-znanij-konstruktor-testov/
Габриелян О.С. Химия: учеб. для студ. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. – М., 2009.
Габриелян О.С. Химия. 8-11 класс. Базовый уровень: учеб. для общеобразоват. учреждений. – М., 2006.
1с химия. Мультимедийное пособие
Тестер А.Баженова. http://edu-lider.ru/proverka-znanij-konstruktor-testov/