- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Содержание
- 1. Презентация по химии на тему ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
- 2. Цели урока Обобщить сведения об ионахЗакрепить умение
- 3. ПРОВЕРЬ СВОИ ЗНАНИЯВещества, растворы которых проводят электрический
- 4. ПРОВЕРЬ СВОИ ЗНАНИЯ (дополните схему) ЭЛЕКТРОЛИТЫ(по степени электролитической диссоциации )
- 5. ПРОВЕРЬ СВОИ ЗНАНИЯ (дополните таблицу)
- 6. Расскажите о последовательности процессов, происходящих при
- 7. История открытия теории электролитической диссоциации В
- 8. Основные положения ТЭДПри растворении в воде электролиты
- 9. ИОНЫ – это положительно или отрицательно заряженные
- 10. ЭЛЕКТРОННЫЕ ФОРМУЛЫ+11Na0 2ē 8ē 1ē
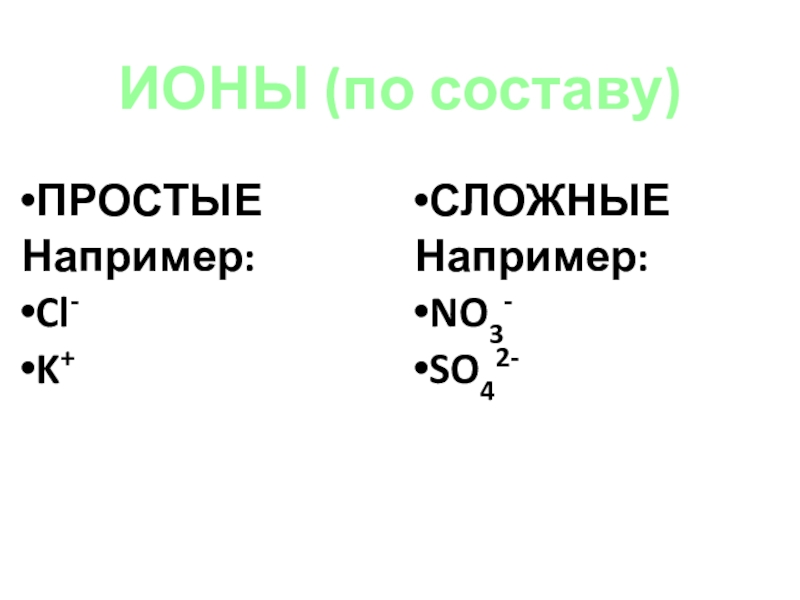
- 11. ИОНЫ (по составу)ПРОСТЫЕНапример:Cl-K+СЛОЖНЫЕНапример:NO3-SO42-
- 12. Основные положения ТЭД2. Причиной диссоциации электролита в
- 13. ИОНЫ (по наличию водной оболочки)ГИДРАТИРОВАННЫЕНапример:
- 14. Основные положения ТЭД3. Под действием электрического тока
- 15. ИОНЫ (по знаку заряда)КАТИОНЫ положительно заряженные частицыАНИОНЫ отрицательно заряженные частицы
- 16. Основные положения ТЭД 4. Электролитическая диссоциация –
- 17. Основные положения ТЭД 5. Не все электролиты в одинаковой мере диссоциируют на ионы.
- 18. ЭЛЕКТРОЛИТЫ(по степени диссоциации) СЛАБЫЕ
- 19. Основные положения ТЭД6. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
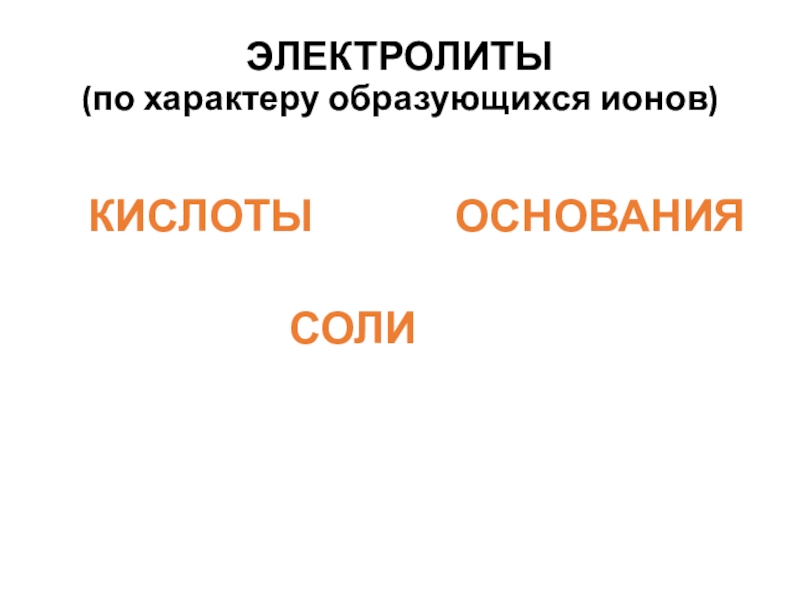
- 20. ЭЛЕКТРОЛИТЫ (по характеру образующихся ионов)КИСЛОТЫ
- 21. ЗАДАНИЕ Составьте возможные уравнения электролитической диссоциации
- 22. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ Кислоты – это электролиты,
- 23. КИСЛОТЫэлектролиты, которые при диссоциации образуют катионы водорода
- 24. Многоосновные кислоты диссоциируют ступенчатоH3PO4 (фосфорная кислота)1)
- 25. ЗАДАНИЕ Составьте возможные уравнения электролитической диссоциации веществ
- 26. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ Основания – это электролиты,
- 27. ОСНОВАНИЯэлектролиты, которые при диссоциации образуют катионы металла
- 28. Многокислотные основания диссоциируют ступенчатоBa(OH)2 (гидроксид бария)1)
- 29. ЗАДАНИЕ Составьте возможные уравнения электролитической диссоциации веществ
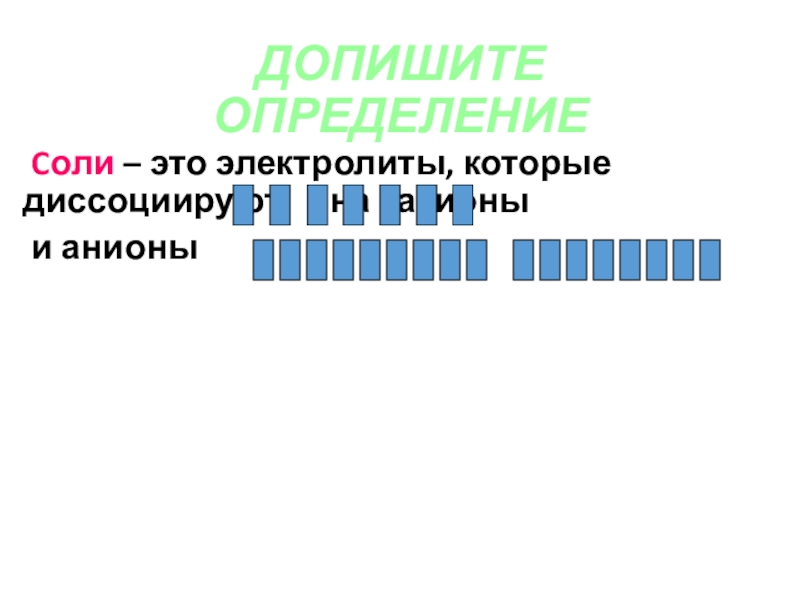
- 30. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ Cоли – это электролиты,
- 31. СОЛИ электролиты, которые при диссоциации образуют
- 32. ПРОВЕРЬ СВОИ ЗНАНИЯ Пользуясь таблицей растворимости, приведите
- 33. ОЦЕНКИ ЗА УРОК
- 34. ДОМАШНЕЕ ЗАДАНИЕ§ 37, положения ТЭД записать в тетрадь, выучить наизустьОпределения кислот, оснований, солей выучить наизустьЗадание №1-6
- 35. Разложение хлорида меди электрическим током
Цели урока Обобщить сведения об ионахЗакрепить умение записывать процесс диссоциации при помощи химических знаков и формулСформулировать основные положения теории электролитической диссоциации
Слайд 2Цели урока
Обобщить сведения об ионах
Закрепить умение записывать процесс диссоциации при помощи
химических знаков и формул
Сформулировать основные положения теории электролитической диссоциации
Сформулировать основные положения теории электролитической диссоциации
Слайд 3ПРОВЕРЬ СВОИ ЗНАНИЯ
Вещества, растворы которых проводят электрический ток, называют ………
Процесс распада
электролита на ионы называют ……..
Вещества, растворы которых не проводят электрический ток, называют ……….
Отношение числа частиц, распавшихся на ионы, к общему числу растворенных частиц называют …………
Вещества, растворы которых не проводят электрический ток, называют ……….
Отношение числа частиц, распавшихся на ионы, к общему числу растворенных частиц называют …………
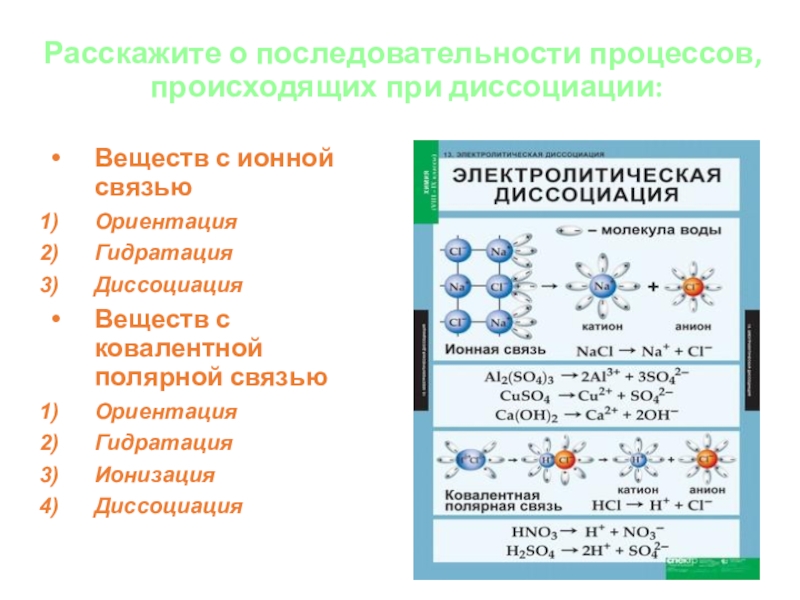
Слайд 6Расскажите о последовательности процессов,
происходящих при диссоциации:
Веществ с ионной связью
Ориентация
Гидратация
Диссоциация
Веществ
с ковалентной полярной связью
Ориентация
Гидратация
Ионизация
Диссоциация
Ориентация
Гидратация
Ионизация
Диссоциация
Слайд 7История открытия теории электролитической диссоциации
В 1887 году шведский химик
Сванте Аррениус сформулировал основные положения теории электролитической диссоциации
Слайд 8Основные положения ТЭД
При растворении в воде электролиты диссоциируют (распадаются) на положительные
и отрицательные ионы.
NaCl = Na+ + Cl-
Ионы – это одна из форм существования химического элемента
NaCl = Na+ + Cl-
Ионы – это одна из форм существования химического элемента
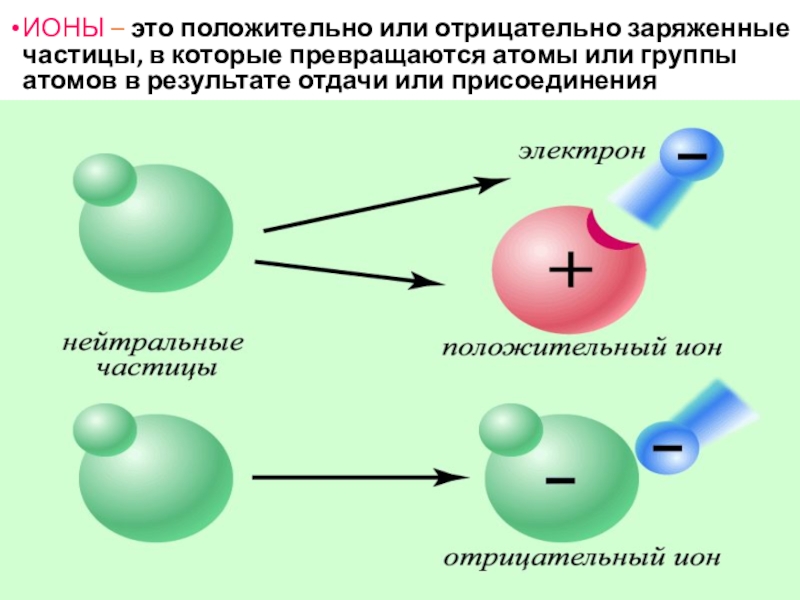
Слайд 9ИОНЫ – это положительно или отрицательно заряженные частицы, в которые превращаются
атомы или группы атомов в результате отдачи или присоединения электронов
Слайд 10ЭЛЕКТРОННЫЕ ФОРМУЛЫ
+11Na0 2ē 8ē 1ē
+11Na+ 2ē 8ē
атом ион
+17Cl0 2ē 8ē 7ē +17Cl- 2ē 8ē 8ē
атом ион
атом ион
+17Cl0 2ē 8ē 7ē +17Cl- 2ē 8ē 8ē
атом ион
Слайд 12Основные положения ТЭД
2. Причиной диссоциации электролита в водном растворе является его
гидратация, т.е. взаимодействие электролита с молекулами воды и разрыв химической связи в нем.
Слайд 13ИОНЫ
(по наличию водной оболочки)
ГИДРАТИРОВАННЫЕ
Например:
В растворах и кристаллогидратах
CuSO4 * 5H2O
Na2SO4* 10H2O
Na2SO4* 10H2O
НЕГИДРАТИРОВАННЫЕ
Например:
В безводных солях
Cu2+SO42-
Na+NO3-
Слайд 14Основные положения ТЭД
3. Под действием электрического тока положительно заряженные ионы
движутся к отрицательному полюсу источника тока – катоду, поэтому их называют катионами, а отрицательно заряженные ионы движутся к положительному полюсу источника тока – аноду, поэтому их называют анионами.
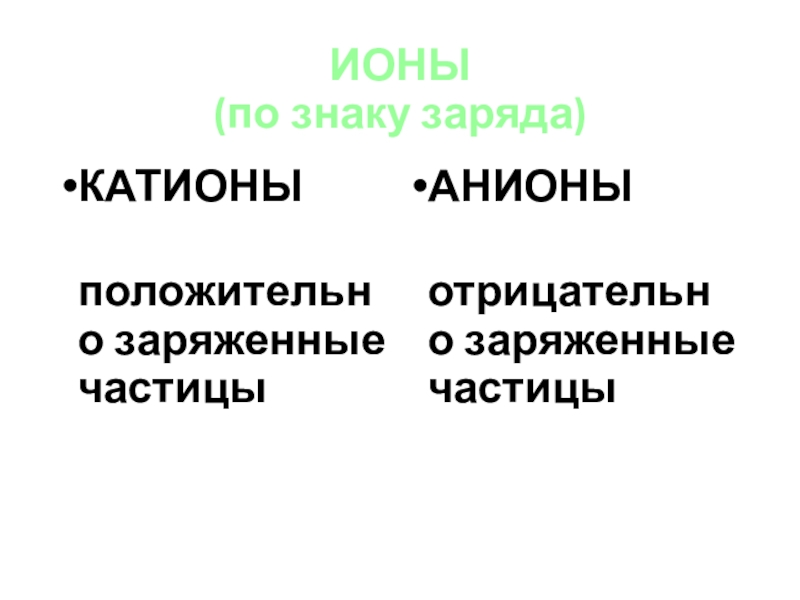
Слайд 15ИОНЫ
(по знаку заряда)
КАТИОНЫ
положительно заряженные частицы
АНИОНЫ
отрицательно заряженные частицы
Слайд 16Основные положения ТЭД
4. Электролитическая диссоциация – процесс обратимый для слабых
электролитов.
Наряду с процессом диссоциации протекает и обратный процесс – ассоциация (соединение ионов)
HNO2 H+ + NO2-
Наряду с процессом диссоциации протекает и обратный процесс – ассоциация (соединение ионов)
HNO2 H+ + NO2-
Слайд 19Основные положения ТЭД
6. Химические свойства растворов электролитов определяются свойствами тех ионов,
которые они образуют при диссоциации.
Слайд 21ЗАДАНИЕ
Составьте возможные уравнения электролитической диссоциации веществ в водных растворах.
1) HCl 2) HNO3 3) Н2SiO3
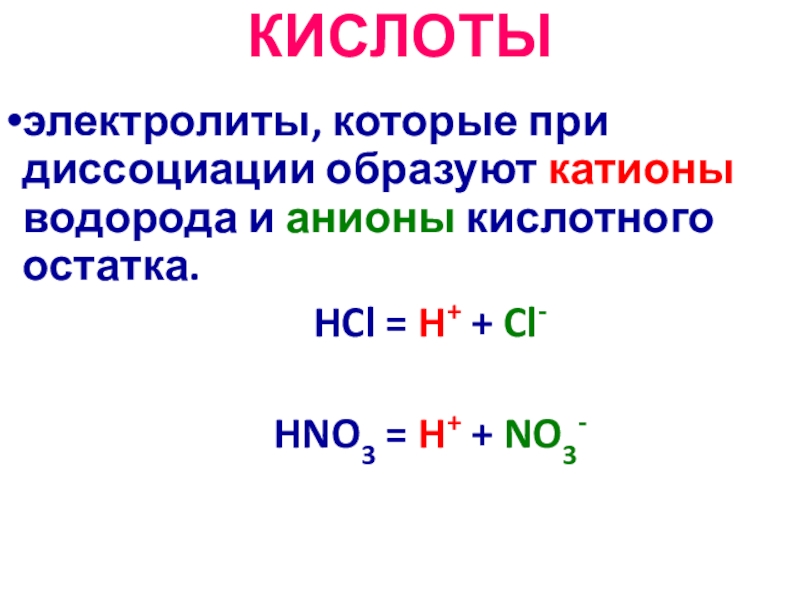
Слайд 23КИСЛОТЫ
электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка.
HCl = H+ + Cl-
HNO3 = H+ + NO3-
HNO3 = H+ + NO3-
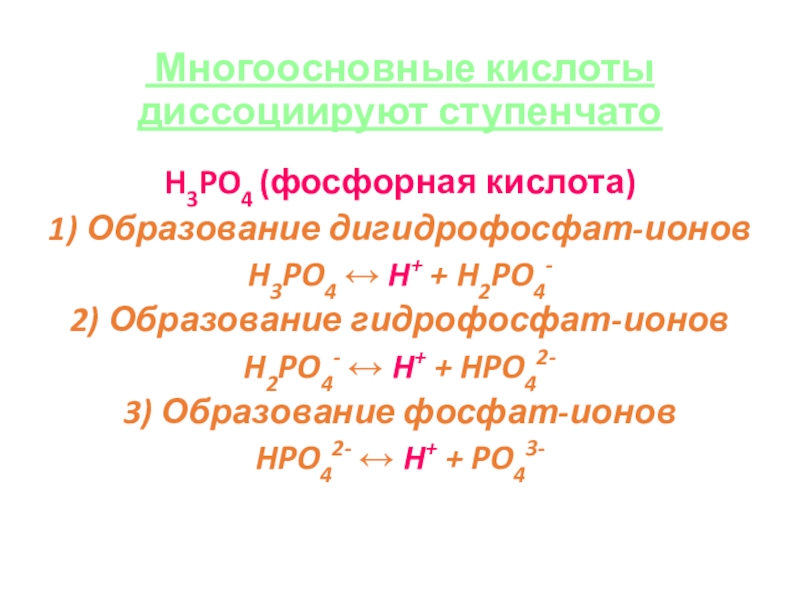
Слайд 24 Многоосновные кислоты диссоциируют ступенчато
H3PO4 (фосфорная кислота)
1) Образование дигидрофосфат-ионов
H3PO4 ↔ H+
+ H2PO4-
2) Образование гидрофосфат-ионов
H2PO4- ↔ H+ + HPO42-
3) Образование фосфат-ионов
HPO42- ↔ H+ + PO43-
2) Образование гидрофосфат-ионов
H2PO4- ↔ H+ + HPO42-
3) Образование фосфат-ионов
HPO42- ↔ H+ + PO43-
Слайд 25ЗАДАНИЕ
Составьте возможные уравнения электролитической диссоциации веществ в водных растворах.
1) NaOH 2) KOH 3) Fe(OH)2
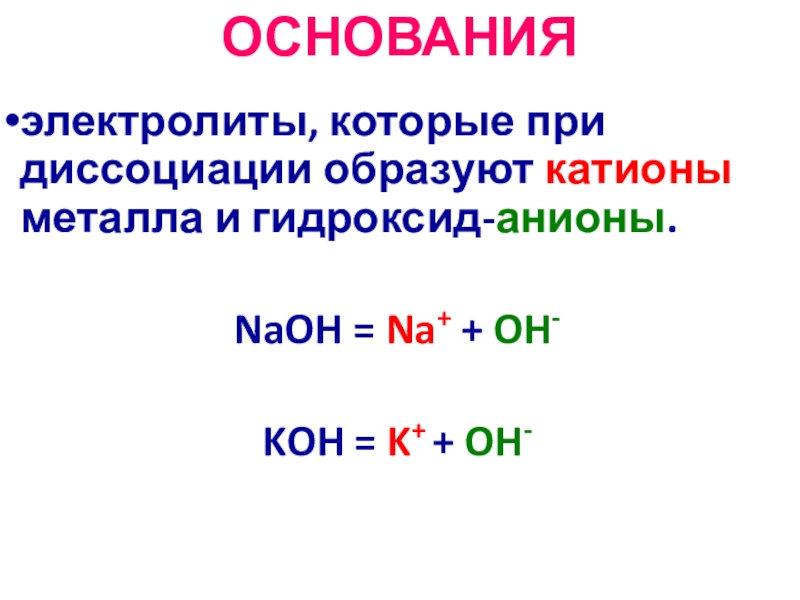
Слайд 27ОСНОВАНИЯ
электролиты, которые при диссоциации образуют катионы металла и гидроксид-анионы.
NaOH =
Na+ + OH-
KOH = K+ + OH-
KOH = K+ + OH-
Слайд 28 Многокислотные основания диссоциируют ступенчато
Ba(OH)2 (гидроксид бария)
1) Образование гидроксо-ионов бария
Ba(OH)2 ↔
OH- + BaOH+
2) Образование ионов бария
BaOH+ ↔ Ba2+ + OH-
2) Образование ионов бария
BaOH+ ↔ Ba2+ + OH-
Слайд 29ЗАДАНИЕ
Составьте возможные уравнения электролитической диссоциации веществ в водных растворах.
1) NaCl 2) KNO3 3) BaSO4
Слайд 31СОЛИ
электролиты, которые при диссоциации образуют катионы металла (или аммония
NH4) и анионы кислотных остатков.
K3PO4 = 3K+ + PO43-
NH4Cl = NH4+ + Cl-
K3PO4 = 3K+ + PO43-
NH4Cl = NH4+ + Cl-
Слайд 32ПРОВЕРЬ СВОИ ЗНАНИЯ
Пользуясь таблицей растворимости, приведите примеры трех веществ, которые в
растворах образуют сульфат-ионы. Запишите уравнения электролитической диссоциации этих веществ.
1) H2SO4 ↔ H+ + HSO4-
2) HSO4- ↔ H+ + SO42-
1) H2SO4 ↔ H+ + HSO4-
2) HSO4- ↔ H+ + SO42-
Слайд 34ДОМАШНЕЕ ЗАДАНИЕ
§ 37, положения ТЭД записать в тетрадь, выучить наизусть
Определения кислот,
оснований, солей выучить наизусть
Задание №1-6
Задание №1-6