- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Основания как электролиты (9 класс)
Содержание
- 1. Презентация по химии на тему: Основания как электролиты (9 класс)
- 2. Основание как электролиты
- 3. Уравнение диссоциации сильных оснований (щелочей)NaOH Na+
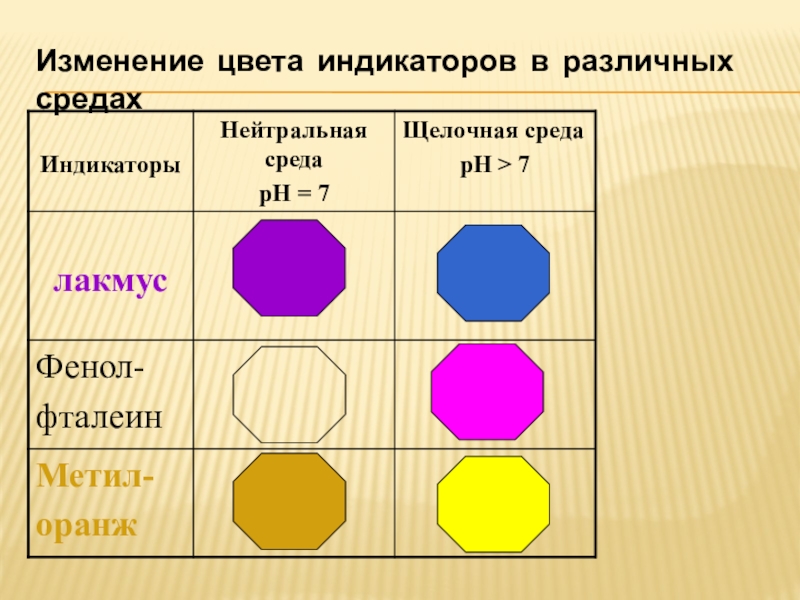
- 4. Изменение цвета индикаторов в различных средах
- 5. Общие свойства оснований:1. Основания взаимодействуют с кислотами
- 6. Специфические свойства нерастворимых оснований:При нагревании разлагаютсяFe(OH)2 FeO + H2O
- 7. Амфотерные гидроксиды способны вступать во взаимодействие как
- 8. Домашнее задание:§10
Основание как электролиты
Слайд 3Уравнение диссоциации сильных оснований (щелочей)
NaOH Na+ + OH-
Ba(OH)2 Ba2+
+ 2OH-
Слабые многокислотные основания диссоциируют ступенчато.
Fe(OH)2 FeOH+ + OH- К1 > K2
FeOH+ ↔ Fe2+ + OH-
Слабые многокислотные основания диссоциируют ступенчато.
Fe(OH)2 FeOH+ + OH- К1 > K2
FeOH+ ↔ Fe2+ + OH-
Основания - электролиты, которые при диссоциации образуют только один вид анионов - гидроксид-ионы ОН-.
Слайд 5Общие свойства оснований:
1. Основания взаимодействуют с кислотами (реакция нейтрализации):
NaOH + HCl
= NaCl + H2O
2. Взаимодействуют с кислотными оксидами
Ca(OH)2 +2 HCl = CaCl2 +2 H2O
3. Взаимодействуют с солями:
CuNO3+ NaOH CuOH ↓ + NaNO3
2. Взаимодействуют с кислотными оксидами
Ca(OH)2 +2 HCl = CaCl2 +2 H2O
3. Взаимодействуют с солями:
CuNO3+ NaOH CuOH ↓ + NaNO3
Слайд 6 Специфические свойства нерастворимых оснований:
При нагревании разлагаются
Fe(OH)2 FeO + H2O
Слайд 7Амфотерные гидроксиды
способны вступать во взаимодействие как с кислотами так и
со щелочами.
Очень слабые электролиты
H+ + RO- ↔ ROH ↔ R+ + OH-
1. Al(OH)3 +HCl AlCl3 + H2O
2. Al(OH)3 + NaOH NaAlO2 + 2H2O
3. При нагревании разлагается
Al(OH)3 Al2O3 + H2O
Очень слабые электролиты
H+ + RO- ↔ ROH ↔ R+ + OH-
1. Al(OH)3 +HCl AlCl3 + H2O
2. Al(OH)3 + NaOH NaAlO2 + 2H2O
3. При нагревании разлагается
Al(OH)3 Al2O3 + H2O