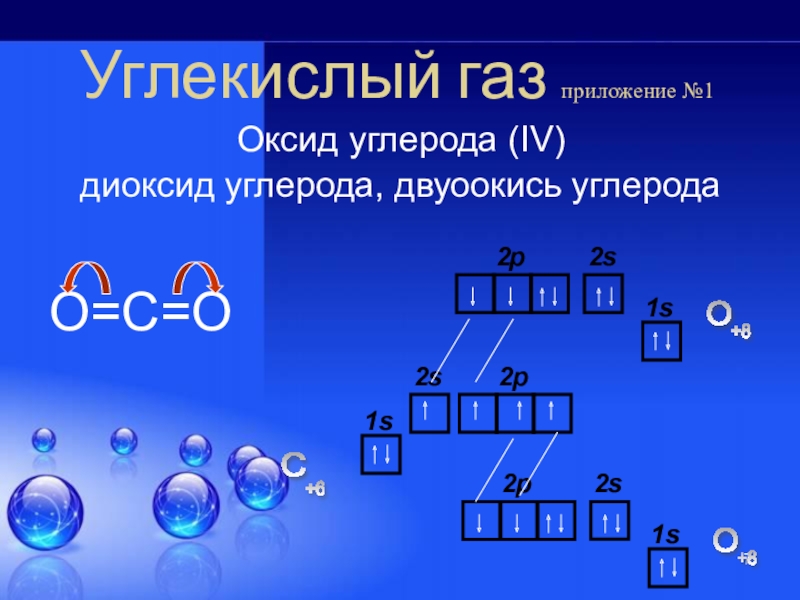
Много тысяч лет назад
Я уже пылал в костре,
Освещая интерьер
Первобытных их пещер.
И украсить был я рад
Дам и рыцарей наряд,
Что блистали при дворе…
Если мягким быть решу,-
То в тетради я пишу.»
Такова, друзья, природа
Элемента углерода!
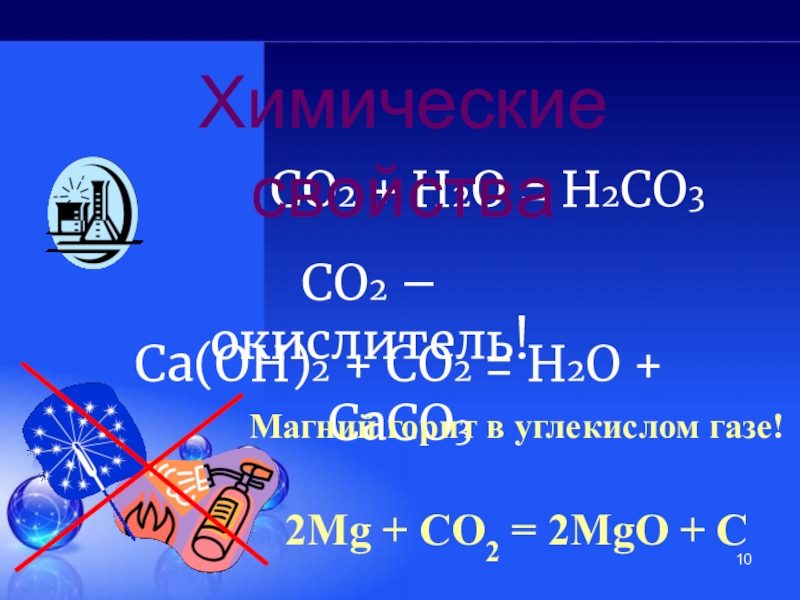
Однако, и соединения этого необычного атома не менее интересны…