- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Окислительно-восстановительные реакции
Содержание
- 1. Презентация по химии на тему Окислительно-восстановительные реакции
- 2. Девиз урока «Кто-то теряет,
- 3. горение
- 4. Тема урока: «Окислительно-восстановительные реакции» Цель:Познакомиться с
- 5. Быть может, эти электроны-Миры, где пять материков,Искусства,
- 6. Что такое степень окисления? Степень окисления
- 7. Важнейшие восстановители и окислители Восстановители:
- 8. Степень окисления марганца в соединении перманганата калия
- 9. Правила определения степеней окисления1 .Степень окисления элемента
- 10. Лабораторная работаПравила техники безопасности.Опыт 1. Проведите химическую
- 11. Ответы:Cu+2S+6O4-2 +2Na +1O-2H+1Cu +2(O -2H+1)2+Na2 +1S +6O4-2
- 12. Классификация окислительно-восстановительных реакций 1.Межмолекулярные окислительно-восстановительные реакции
- 13. 2.Внутримолекулярные окислительно - восстановительные реакции Во внутримолекулярных реакциях
- 14. 3.Реакции диспропорционирования Окислительно - восстановительные реакции,
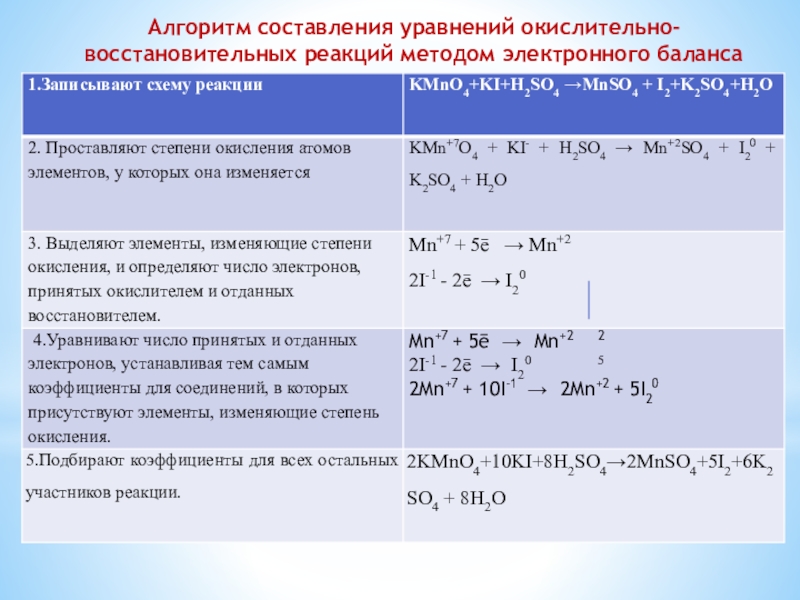
- 15. Алгоритм составления уравнений окислительно-восстановительных реакций методом электронного баланса
- 16. Электронный баланс - метод нахождения коэффициентов
- 17. Окислительно – восстановительные реакции – это
- 18. Запомним:1.Окислительно - восстановительные реакции – это такие
- 19. Примеры окислительно-восстановительных реакций Пример 1.Сu+2O-2+H2 Cu+H2+1O-2 (реакция
- 20. Пример 2.2Mg0 + O20 2Mg+2О-2 (р-я соединения)Мg0
- 21. Значение окислительно – восстановительных реакций фотосинтезСгорание топливаПолучение металловГниение , брожениеКоррозия металлов и сплавов
- 22. Суть ОВР: Окислительно-восстановительные реакции - представляют собой
- 23. «Окислитель как отъявленный злодейКак пират, бандит, агрессор,
- 24. Слайд 24
- 25. Внимание!!!Самостоятельная работа...
Девиз урока «Кто-то теряет, а кто-то находит…» Сами, трудясь, вы сделаете все и для близких людей и для себя, а если при труде успеха не будет, неудача – не беда, попробуйте ещё.Д.
Слайд 1Выполнила:
Учитель химии
Баймухаметова
Батила Тургинбаевна
Окислительно-восстановительные реакции
Слайд 2Девиз урока
«Кто-то теряет,
а кто-то находит…»
Сами, трудясь, вы сделаете
все
и для близких людей и для себя,
а если при труде успеха не будет,
неудача – не беда, попробуйте ещё.
Д. И. Менделеев.
и для близких людей и для себя,
а если при труде успеха не будет,
неудача – не беда, попробуйте ещё.
Д. И. Менделеев.
Слайд 4Тема урока: «Окислительно-восстановительные реакции»
Цель:
Познакомиться с окислительно-восстановитель-ными реакциями и выяснить, в
чём отличие обменных реакций от окислительно-восстановительных реакций.
Научиться определять в реакциях окислитель и восстановитель.
Научиться составлять схемы процессов отдачи и принятия электронов.
Познакомиться с важнейшими окислительно-восстановительными реакциями, встречающимися в природе.
Научиться определять в реакциях окислитель и восстановитель.
Научиться составлять схемы процессов отдачи и принятия электронов.
Познакомиться с важнейшими окислительно-восстановительными реакциями, встречающимися в природе.
Слайд 5
Быть может, эти электроны-
Миры, где пять материков,
Искусства, знанья, войны, троны
И память сорока веков!
Еще, быть может, каждый атом-
Вселенная, где сто планет;
Там - все, что здесь, в объёме сжатом,
Но также то, чего здесь нет.
В. Брюсосова.
Еще, быть может, каждый атом-
Вселенная, где сто планет;
Там - все, что здесь, в объёме сжатом,
Но также то, чего здесь нет.
В. Брюсосова.
Слайд 6Что такое степень окисления?
Степень окисления – это условный заряд
атома химического элемента в соединении, вычисленный на основе предположения, что все соединения состоят только из ионов. Степень окисления может быть положительной, отрицательной или равняться нулю, что зависит от природы соответствующих соединений.
Одни элементы имеют: постоянные степени окисления,
другие — переменные.
Элементы с постоянной положительной степенью окисления относятся - щелочные металлы: Li+1, Na+1, K+1, Rb+1, Cs+1, Fr+1, следующие элементы II группы периодической системы: Ве+2, Mg+2, Ca+2, Sr+2, Ва+2, Ra+2, Zn+2, а также элемент III А группы - А1+3 и некоторые другие.
Металлы в соединениях всегда имеют положительную степень окисления.
Из неметаллов постоянную отрицательную степень окисления (-1) имеет F.
В простых веществах, образованных атомами металлов или неметаллов, степени окисления элементов равны нулю, например: Na°, Al°, Fe°, Н2, О2, F2, Cl2, Br2.
Для водорода характерны степени окисления: +1 (Н20), -1 (NaH).
Для кислорода характерны степени окисления: -2 (Н20), -1 (Н2О2), +2 (OF2).
Одни элементы имеют: постоянные степени окисления,
другие — переменные.
Элементы с постоянной положительной степенью окисления относятся - щелочные металлы: Li+1, Na+1, K+1, Rb+1, Cs+1, Fr+1, следующие элементы II группы периодической системы: Ве+2, Mg+2, Ca+2, Sr+2, Ва+2, Ra+2, Zn+2, а также элемент III А группы - А1+3 и некоторые другие.
Металлы в соединениях всегда имеют положительную степень окисления.
Из неметаллов постоянную отрицательную степень окисления (-1) имеет F.
В простых веществах, образованных атомами металлов или неметаллов, степени окисления элементов равны нулю, например: Na°, Al°, Fe°, Н2, О2, F2, Cl2, Br2.
Для водорода характерны степени окисления: +1 (Н20), -1 (NaH).
Для кислорода характерны степени окисления: -2 (Н20), -1 (Н2О2), +2 (OF2).
Слайд 8Степень окисления марганца в соединении перманганата калия KMnO4.
1.Степень окисления калия +1,
кислорода -2.
2.Подсчитаем число отрицательных зарядов: 4 • (-2) = - 8
3.Число положительных зарядов у марганца – 1.
4.Составляем следующее уравнение:
(+1) + х+ (-2)*4 =0
1+ х - 8=0
Х = 8 - 1 = 7
Х= +7
+7 – это степень окисления марганца в перманганате калия.
2.Подсчитаем число отрицательных зарядов: 4 • (-2) = - 8
3.Число положительных зарядов у марганца – 1.
4.Составляем следующее уравнение:
(+1) + х+ (-2)*4 =0
1+ х - 8=0
Х = 8 - 1 = 7
Х= +7
+7 – это степень окисления марганца в перманганате калия.
Слайд 9Правила определения степеней окисления
1 .Степень окисления элемента в простом веществе равно
0.
Например: Са, Н2, Cl2, Na.
2 .Степень окисления фтора во всех соединениях, кроме F2, равна – 1. Пример: S+6F6-1
3 .Степень окисления кислорода во всех соединениях, кроме О2, О3, F2-1O+2 и перекисных соединениях Na2+1 O-12; Н2+1О-12 равна –2
Примеры: Na2O-2, BaO-2, CO2-2.
4 .Степень окисления водорода равна +1, если в соединениях есть хотя бы один неметалл, -1 в соединениях с металлами (гидридах)
5. Степень окисления О в Н2
Примеры: C-4H4+1 Ba+2H2-1 H2
Степень окисления металлов всегда положительна (кроме простых веществ).
Степень окисления металлов главных подгрупп всегда равна номеру группы.
Степень окисления побочных подгрупп может принимать разные значения. Примеры: Na+ Cl-, Al2+3O3-2, Cr2+3 O3-2, Cr+2O-2.
6 . Максимальная положительная степень окисления равна номеру группы (исключения Cu+2, Au+3). Минимальная степень окисления равна номеру группы минус восемь.
Примеры: H+1N+5O-23, N-3H+13.
7 . Сумма степеней окисления атомов в молекуле (ионе) равна 0 (заряду иона).
Например: Са, Н2, Cl2, Na.
2 .Степень окисления фтора во всех соединениях, кроме F2, равна – 1. Пример: S+6F6-1
3 .Степень окисления кислорода во всех соединениях, кроме О2, О3, F2-1O+2 и перекисных соединениях Na2+1 O-12; Н2+1О-12 равна –2
Примеры: Na2O-2, BaO-2, CO2-2.
4 .Степень окисления водорода равна +1, если в соединениях есть хотя бы один неметалл, -1 в соединениях с металлами (гидридах)
5. Степень окисления О в Н2
Примеры: C-4H4+1 Ba+2H2-1 H2
Степень окисления металлов всегда положительна (кроме простых веществ).
Степень окисления металлов главных подгрупп всегда равна номеру группы.
Степень окисления побочных подгрупп может принимать разные значения. Примеры: Na+ Cl-, Al2+3O3-2, Cr2+3 O3-2, Cr+2O-2.
6 . Максимальная положительная степень окисления равна номеру группы (исключения Cu+2, Au+3). Минимальная степень окисления равна номеру группы минус восемь.
Примеры: H+1N+5O-23, N-3H+13.
7 . Сумма степеней окисления атомов в молекуле (ионе) равна 0 (заряду иона).
Слайд 10Лабораторная работа
Правила техники безопасности.
Опыт 1. Проведите химическую реакцию между растворами сульфата
меди (II) и гидроксида натрия.
Опыт 2.
1.Поместите в раствор сульфата меди (II) железный гвоздь.
2.Составьте уравнения химических реакций.
3.Определите тип каждой химической реакции.
4.Определите степень окисления атома каждого химического элемента до реакции и после реакции.
5.Подумайте, чем отличаются эти реакции?
Опыт 2.
1.Поместите в раствор сульфата меди (II) железный гвоздь.
2.Составьте уравнения химических реакций.
3.Определите тип каждой химической реакции.
4.Определите степень окисления атома каждого химического элемента до реакции и после реакции.
5.Подумайте, чем отличаются эти реакции?
Слайд 11Ответы:
Cu+2S+6O4-2 +2Na +1O-2H+1Cu +2(O -2H+1)2+Na2 +1S +6O4-2
– реакция обмена
Cu+2S+6O4-2 + Fe0 Fe+2 S+6O4 -2+Сu0 – реакция замещения
Реакция №2 отличается от реакции №1 тем, что в данном случае изменяется степень окисления у атомов химических элементов до реакции и после реакции.
Обратите внимание на это важное отличие двух реакций. Вторая реакция является ОВР.
Подчеркнем в уравнении реакции символы химических элементов, которые поменяли степень окисления. Выпишем их и укажем, что атомы сделали со своими электронами (Отдали или приняли?), т.е. переходы электронов.
Cu+2 + 2 е- Сu0 – окислитель, восстанавливается
Fe0 - 2 е- Fe+2 - восстановитель, окисляется
Cu+2S+6O4-2 + Fe0 Fe+2 S+6O4 -2+Сu0 – реакция замещения
Реакция №2 отличается от реакции №1 тем, что в данном случае изменяется степень окисления у атомов химических элементов до реакции и после реакции.
Обратите внимание на это важное отличие двух реакций. Вторая реакция является ОВР.
Подчеркнем в уравнении реакции символы химических элементов, которые поменяли степень окисления. Выпишем их и укажем, что атомы сделали со своими электронами (Отдали или приняли?), т.е. переходы электронов.
Cu+2 + 2 е- Сu0 – окислитель, восстанавливается
Fe0 - 2 е- Fe+2 - восстановитель, окисляется
Слайд 12Классификация окислительно-восстановительных реакций
1.Межмолекулярные окислительно-восстановительные реакции
Окислитель и восстановитель находятся в
разных веществах; обмен электронами в этих реакциях происходит между различными атомами или молекулами:
2Са0 + O20 → 2 Са+2O-2
Са - восстановитель; O2 - окислитель
Cu+2O + C+2O → Cu0 + C+4O2
CO - восстановитель; CuO – окислитель
Zn0 + 2HCl → Zn+2Cl2 + H20
Zn - восстановитель; HСl - окислитель
Mn+4O2 + 2KI-1 + 2H2SO4 → I20 + K2SO4 + Mn+2SO4 + 2H2O
KI - восстановитель; MnO2 - окислитель.
2Са0 + O20 → 2 Са+2O-2
Са - восстановитель; O2 - окислитель
Cu+2O + C+2O → Cu0 + C+4O2
CO - восстановитель; CuO – окислитель
Zn0 + 2HCl → Zn+2Cl2 + H20
Zn - восстановитель; HСl - окислитель
Mn+4O2 + 2KI-1 + 2H2SO4 → I20 + K2SO4 + Mn+2SO4 + 2H2O
KI - восстановитель; MnO2 - окислитель.
Слайд 132.Внутримолекулярные окислительно - восстановительные реакции
Во внутримолекулярных реакциях окислитель и восстановитель
находятся в одной и той же молекуле. Внутримолекулярные реакции протекают, как правило, при термическом разложении веществ, содержащих окислитель и восстановитель.
4Na2Cr2O7 → 4Na2CrO4 + 2Cr2O3 + 3O2
Cr+6- окислитель; О-2 - восстановитель
4Na2Cr2O7 → 4Na2CrO4 + 2Cr2O3 + 3O2
Cr+6- окислитель; О-2 - восстановитель
Слайд 143.Реакции диспропорционирования
Окислительно - восстановительные реакции, в которых один элемент
одновременно повышает и понижает степень окисления.
3S + 6NaOH → Na2SO3 + 2Na2S + 3H2O
Сера в степени окисления 0 является и окислителем и восстановителем.
4.Реакции компропорционирования
Окислительно-восстановительные реакции, в которых атомы одного элемента в различных степенях окисления в результате реакции приобретают одну степень окисления.
5NaBr + NaBrO3 + 3H2SO4 → 3Na2SO4 + 3Br2 + 3H2O
Br+5 – окислитель; Br-1 – восстановитель
3S + 6NaOH → Na2SO3 + 2Na2S + 3H2O
Сера в степени окисления 0 является и окислителем и восстановителем.
4.Реакции компропорционирования
Окислительно-восстановительные реакции, в которых атомы одного элемента в различных степенях окисления в результате реакции приобретают одну степень окисления.
5NaBr + NaBrO3 + 3H2SO4 → 3Na2SO4 + 3Br2 + 3H2O
Br+5 – окислитель; Br-1 – восстановитель
Слайд 15Алгоритм составления уравнений окислительно-восстановительных реакций методом электронного баланса
Слайд 16 Электронный баланс - метод нахождения коэффициентов в уравнениях окислительно-восстановительных реакций,
при котором рассматривается обмен электронами между атомами элементов, изменяющих свою степень окисления. Число электронов, отданных восстановителем, равно числу электронов, принятых окислителем.
Слайд 17 Окислительно – восстановительные реакции – это такие реакции, в которых
одновременно протекают процессы окисления и восстановления и, как правило, изменяются степени окисления элементов.
Рассмотрим процесс на примере взаимодействия цинка с разбавленной серной кислотой:
Рассмотрим процесс на примере взаимодействия цинка с разбавленной серной кислотой:
Слайд 18Запомним:
1.Окислительно - восстановительные реакции – это такие реакции, при которых происходит
переход электронов от одних атомов, молекул или ионов к другим.
2.Окисление – это процесс отдачи электронов, степень окисления при этом повышается.
3.Восстановление – это процесс присоединения электронов, степень окисления при этом понижается.
4.Атомы, молекулы или ионы, отдающие электроны, окисляются; являются восстановителями. 5.Атомы, ионы или молекулы, принимающие электроны, восстанавливаются; являются окислителями.
6.Окисление всегда сопровождается восстановлением, восстановление связано с окислением.
7.Окислительно – восстановительные реакции – единство двух противоположных процессов: окисления и восстановления.
2.Окисление – это процесс отдачи электронов, степень окисления при этом повышается.
3.Восстановление – это процесс присоединения электронов, степень окисления при этом понижается.
4.Атомы, молекулы или ионы, отдающие электроны, окисляются; являются восстановителями. 5.Атомы, ионы или молекулы, принимающие электроны, восстанавливаются; являются окислителями.
6.Окисление всегда сопровождается восстановлением, восстановление связано с окислением.
7.Окислительно – восстановительные реакции – единство двух противоположных процессов: окисления и восстановления.
Слайд 19Примеры окислительно-восстановительных реакций
Пример 1.
Сu+2O-2+H2 Cu+H2+1O-2 (реакция замещения)
Схема
Сu+2+2e Cu0 2 1о (окислитель)
электронного 2Н0- 2е 2Н+1 2 1в (восстановитель)
баланса
электронного 2Н0- 2е 2Н+1 2 1в (восстановитель)
баланса
Слайд 20Пример 2.
2Mg0 + O20 2Mg+2О-2 (р-я соединения)
Мg0 - 2е
Мg+2 4 1 восстановитель
2О0 + 2 1е 2О-2 2 окислитель
Пример 3.
2Н2+1О-2 электр.ток 2Н20+ О20 (р-я разложения)
2Н+1 – 2 1е 2Н0 4 2 окислитель
2О-2 + 2 2е 2О0 1 восстановитель
2О0 + 2 1е 2О-2 2 окислитель
Пример 3.
2Н2+1О-2 электр.ток 2Н20+ О20 (р-я разложения)
2Н+1 – 2 1е 2Н0 4 2 окислитель
2О-2 + 2 2е 2О0 1 восстановитель
Слайд 21Значение окислительно – восстановительных реакций
фотосинтез
Сгорание топлива
Получение металлов
Гниение , брожение
Коррозия металлов
и сплавов
Слайд 22Суть ОВР:
Окислительно-восстановительные реакции - представляют собой единство двух противоположных процессов
- окисления и восстановления.
В этих реакциях число электронов, отдаваемых восстановителями, равно числу электронов, присоединяемых окислителями.
При этом независимо от того, переходят ли электроны с одного атома на другой полностью или лишь частично, оттягиваются к одному из атомов, условно говорят только об отдаче или присоединении электронов
В этих реакциях число электронов, отдаваемых восстановителями, равно числу электронов, присоединяемых окислителями.
При этом независимо от того, переходят ли электроны с одного атома на другой полностью или лишь частично, оттягиваются к одному из атомов, условно говорят только об отдаче или присоединении электронов
Слайд 23«Окислитель как отъявленный злодей
Как пират, бандит, агрессор, Бармалей
Отнимает электроны - и
ОК!
Потерпев урон, восстановитель
Восклицает: «Вот я, помогите!
Электроны мне мои верните!»
Но никто не помогает и ущерб
Не возмещает…»
Потерпев урон, восстановитель
Восклицает: «Вот я, помогите!
Электроны мне мои верните!»
Но никто не помогает и ущерб
Не возмещает…»
Вот почему выбран девиз урока:
« Кто-то теряет, а кто-то находит…»