- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Одноатомные спирты
Содержание
- 1. Презентация по химии на тему Одноатомные спирты
- 2. Этапы урока1. Проверка знаний: 1)Классификация спиртов. 2)
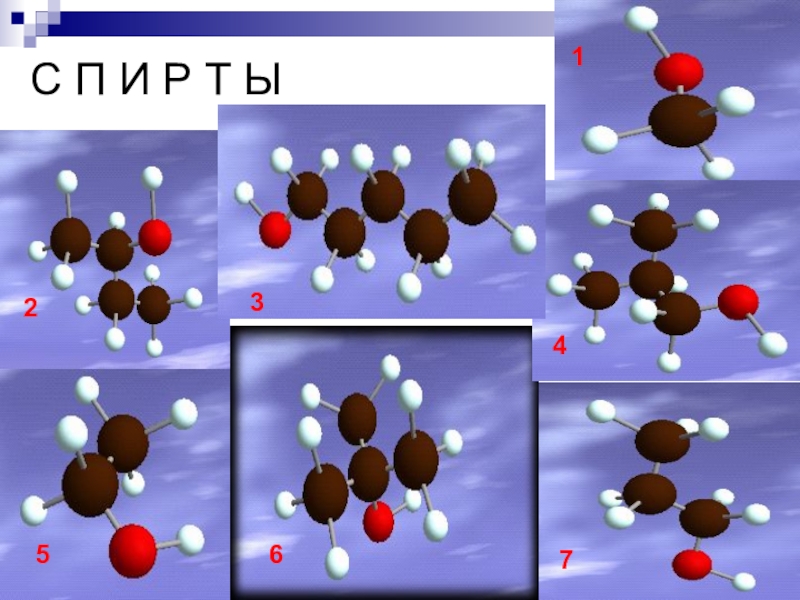
- 3. С П И Р Т Ы1 2 3 4 56 7
- 4. Физические свойства спиртов.
- 5. Физические свойства спиртовТемпература кипения спиртов возрастают с
- 6. Химические свойства спиртов
- 7. Спирты – амфотерные соединения.Действие спиртов на индикаторы:
- 8. Реакции замещенияЗамещение атомов водорода гидроксильной группы вследствие
- 9. Б)взаимодействие с органическими и неорганическими кислотами с
- 10. 2.Замещение гидроксильных групп вследствие разрыва связи С–О:А)
- 11. Реакции отщепления.Дегидратация спиртов может быть двух типов:
- 12. Внутримолекулярная дегидратацияПротекает при более высокой температуре с
- 13. Реакции окисления1.Горение ( полное окисление): С2Н5ОН
- 14. Вторичные спирты окисляются в кетоны:СН3–СН––СН3
- 15. Обобщение изученного материала:Спирты – органические амфотерные соединения.Дегидратация
Этапы урока1. Проверка знаний: 1)Классификация спиртов. 2) Состав, номенклатура, физические свойства предельных одноатомных спиртов.2.Изучение нового материала:Общая характеристика реакционной способности предельных одноатомных спиртов.Химические свойства спиртов.3. Решение задач.
Слайд 2Этапы урока
1. Проверка знаний:
1)Классификация спиртов.
2) Состав, номенклатура, физические свойства
предельных одноатомных спиртов.
2.Изучение нового материала:
Общая характеристика реакционной способности предельных одноатомных спиртов.
Химические свойства спиртов.
3. Решение задач.
2.Изучение нового материала:
Общая характеристика реакционной способности предельных одноатомных спиртов.
Химические свойства спиртов.
3. Решение задач.
Слайд 4Физические свойства спиртов.
П О Ч Е М У
?
метиловый спирт пропан
(М=32 г/моль) - ( М=44 г/моль) -
жидкость газ
Слайд 5Физические свойства спиртов
Температура кипения спиртов возрастают с увеличением числа атомов углерода
в молекуле и понижаются при разветвлении углеродного скелета. Объясните эти закономерности.
Слайд 8Реакции замещения
Замещение атомов водорода гидроксильной группы вследствие разрыва связи О-Н:
А) взаимодействие
с активными металлами с образованием алкоголятов металлов:
2С2Н5ОН + 2Na → 2С2Н5ОNa + Н2↑
Гидролиз алколятов:
С2Н5ОNa + Н2О С2Н5ОН + NaОН
2С2Н5ОН + 2Na → 2С2Н5ОNa + Н2↑
Гидролиз алколятов:
С2Н5ОNa + Н2О С2Н5ОН + NaОН
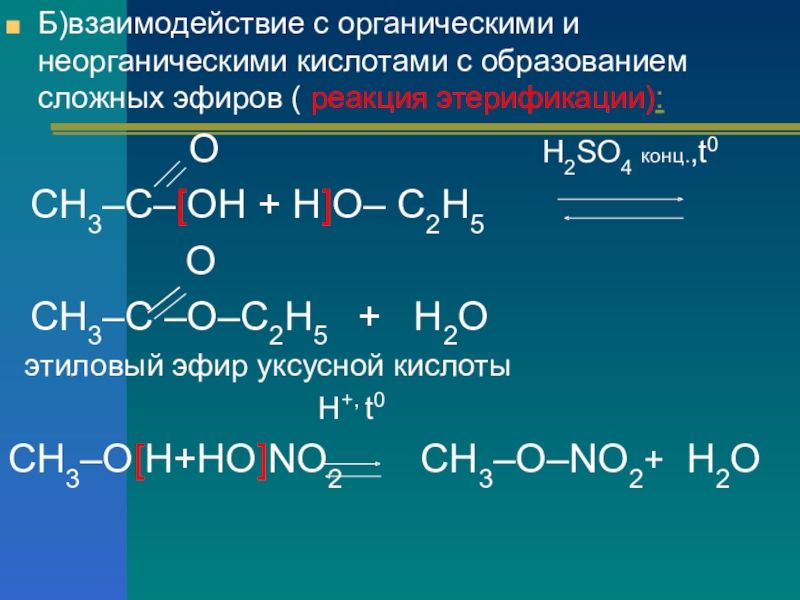
Слайд 9Б)взаимодействие с органическими и неорганическими кислотами с образованием сложных эфиров (
реакция этерификации):
О Н2SO4 конц.,t0
СН3–С–[ОН + Н]О– С2Н5
О
СН3–С –О–С2Н5 + Н2О
этиловый эфир уксусной кислоты
H+, t0
СН3–О[Н+НО]NO2 СН3–О–NO2+ Н2О
О Н2SO4 конц.,t0
СН3–С–[ОН + Н]О– С2Н5
О
СН3–С –О–С2Н5 + Н2О
этиловый эфир уксусной кислоты
H+, t0
СН3–О[Н+НО]NO2 СН3–О–NO2+ Н2О
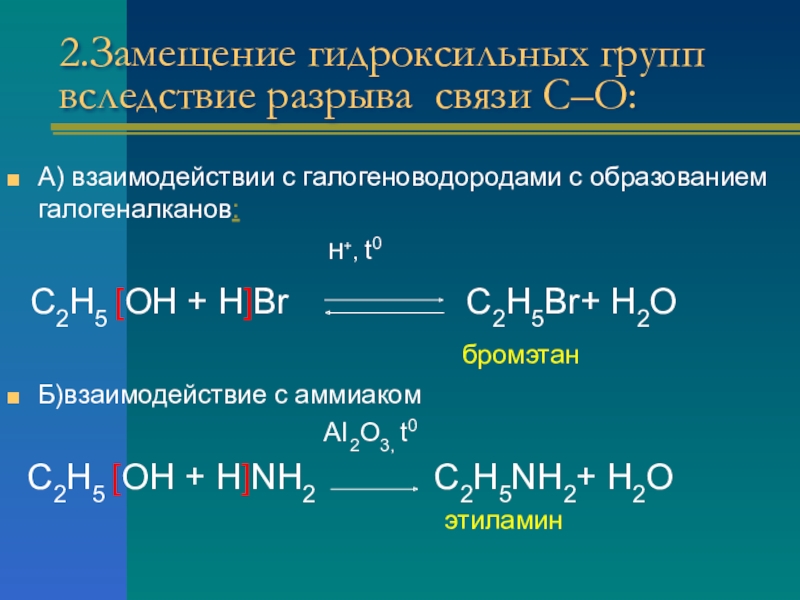
Слайд 102.Замещение гидроксильных групп вследствие разрыва связи С–О:
А) взаимодействии с галогеноводородами с
образованием галогеналканов:
H+, t0
С2Н5 [ОН + Н]Br С2Н5Br+ Н2О
бромэтан
Б)взаимодействие с аммиаком
AI2O3, t0
С2Н5 [ОН + Н]NH2 С2Н5NH2+ Н2О
этиламин
H+, t0
С2Н5 [ОН + Н]Br С2Н5Br+ Н2О
бромэтан
Б)взаимодействие с аммиаком
AI2O3, t0
С2Н5 [ОН + Н]NH2 С2Н5NH2+ Н2О
этиламин
Слайд 11Реакции отщепления.
Дегидратация спиртов может быть двух типов: межмолекулярная и внутримолекулярная:
А) межмолекулярная
– с образованием простых эфиров:
H+, t<1400
С2Н5[ОН + Н]О–С2Н5 С2Н5–О–С2Н5+Н2О
диэтиловый эфир
H+, t<1400
С2Н5[ОН + Н]О–С2Н5 С2Н5–О–С2Н5+Н2О
диэтиловый эфир
Слайд 12Внутримолекулярная дегидратация
Протекает при более высокой температуре с образованием алкенов:
H+, t>1700
С2Н5ОН С2Н4 + Н2О
этен
Дегидратация вторичных и третичных спиртов происходит по правилу Зайцева:
H+, t>1700
СН3–СН–СН–СН3 СН3–СН–СН–СН3+ Н2О
ОН Н
С2Н5ОН С2Н4 + Н2О
этен
Дегидратация вторичных и третичных спиртов происходит по правилу Зайцева:
H+, t>1700
СН3–СН–СН–СН3 СН3–СН–СН–СН3+ Н2О
ОН Н
ОН Н
Слайд 13Реакции окисления
1.Горение ( полное окисление):
С2Н5ОН + 3О2
2СО2 + 3Н2О
2.Неполное окисление:
А) первичные спирты окисляются в альдегиды: t0 О
СН3СН2ОН + СuО СН3С– Н + Сu + Н2О
уксусный альдегид
2.Неполное окисление:
А) первичные спирты окисляются в альдегиды: t0 О
СН3СН2ОН + СuО СН3С– Н + Сu + Н2О
уксусный альдегид
Слайд 14 Вторичные спирты окисляются в кетоны:
СН3–СН––СН3 + [О]
СН3–СН–СН3+ Н2О
ОН О
ацетон
Третичные спирты окислению не подвергаются.
ОН О
ацетон
Третичные спирты окислению не подвергаются.
Слайд 15Обобщение изученного материала:
Спирты – органические амфотерные соединения.
Дегидратация спиртов проходит в присутствии
катализатора H2SO4( конц) и температурах:
> 170 оС – внутримолекулярная дегидратация;
< 140 о С – межмолекулярная дегидратация.
Спирты горят и окисляются.
> 170 оС – внутримолекулярная дегидратация;
< 140 о С – межмолекулярная дегидратация.
Спирты горят и окисляются.










![Презентация по химии на тему Одноатомные спирты Вторичные спирты окисляются в кетоны:СН3–СН––СН3 + [О] Вторичные спирты окисляются в кетоны:СН3–СН––СН3 + [О] СН3–СН–СН3+ Н2О](/img/thumbs/0b4bb918ebb510d85097f409baee7062-800x.jpg)






