- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Обобщение и систематизация знаний по теме Неметаллы (9класс)
Содержание
- 1. Презентация по химии на тему Обобщение и систематизация знаний по теме Неметаллы (9класс)
- 2. обобщить и систематизировать знания о
- 3. Закрепить понимание зависимости свойств от типа кристаллической
- 4. Слайд 4
- 5. Техника безопасностиВерны ли следующие
- 6. Техника безопасностиВерны ли следующие
- 7. Техника безопасностиВерны ли суждения
- 8. Техника безопасностиВерны ли следующие
- 9. Техника безопасностиВерны ли
- 10. Техника безопасностиКакой
- 11. Техника безопасности
- 12. Работа
- 13. Работа в
- 14. Работа
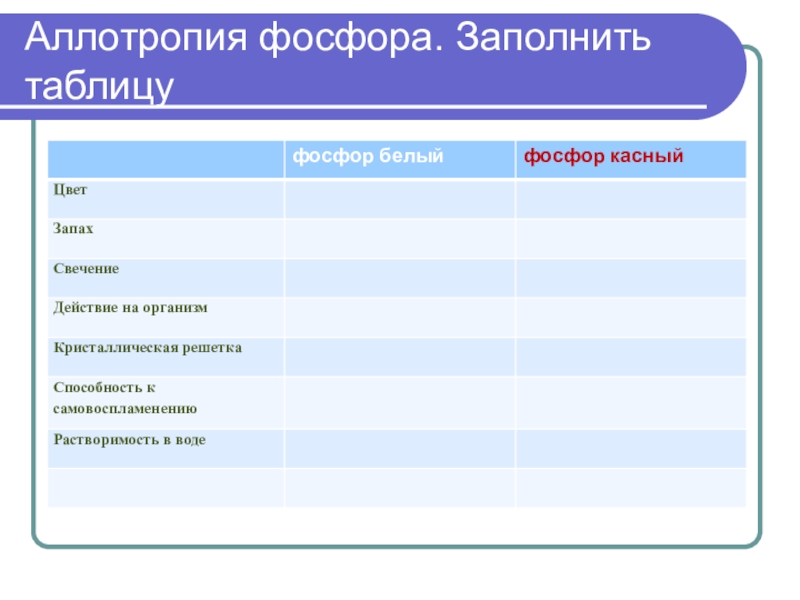
- 15. Аллотропия фосфора. Заполнить таблицу
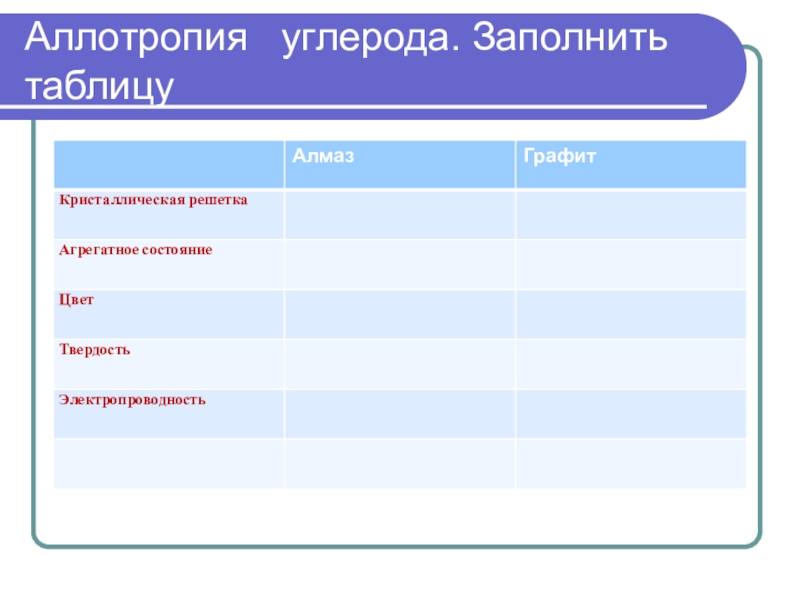
- 16. Аллотропия углерода. Заполнить таблицу
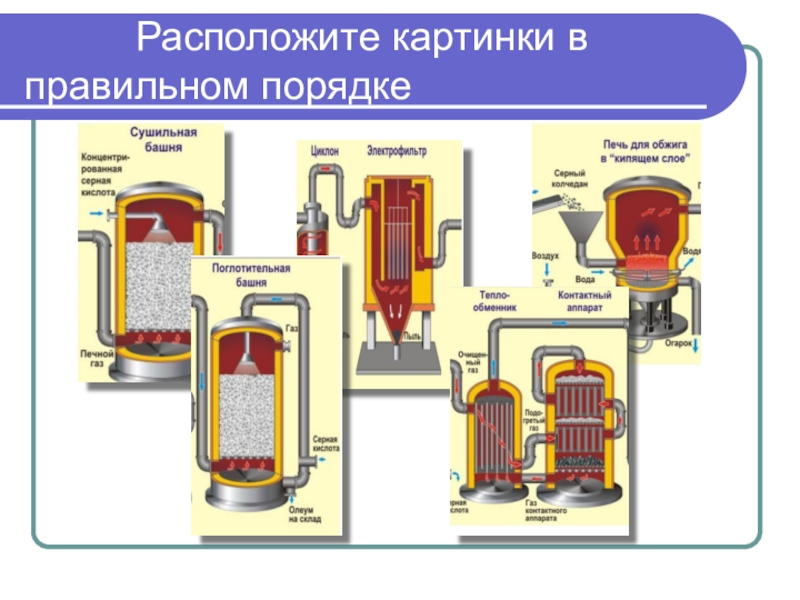
- 17. Расположите картинки
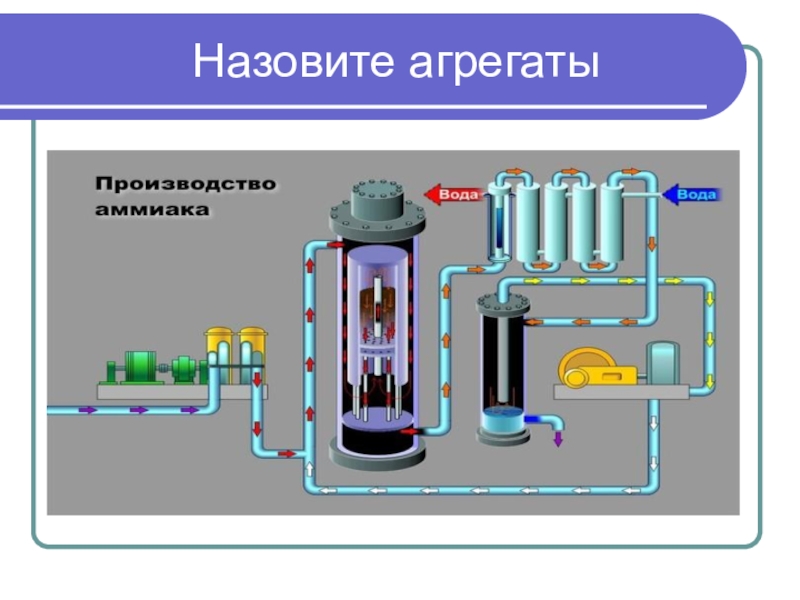
- 18. Назовите агрегаты
- 19. Индивидуальная работа Даны вещества: Na2SO4,
- 20. Условия реакций ионного обмена (РИО):1) Растворимость
- 21. Индивидуальная работа Даны:
- 22. Индивидуальная работа Для выполнения задания
- 23. Индивидуальная работа Через 10%-ный
- 24. Индивидуальная работаДана схема превращений:Напишите молекулярные
- 25. Спасибо за внимание
Слайд 3Закрепить понимание зависимости свойств от типа кристаллической решётки, вида химической связи,
2. Совершенствовать навыки составления уравнений реакций в молекулярном и ионном виде, электронного баланса ОВР, проведения и наблюдения химического эксперимента.
3. Добиваться четких и лаконичных ответов, аккуратного выполнения заданий. Продолжить формирование умений анализировать, делать выводы, работать самостоятельно.
Задачи
Слайд 4 План
Техника безопасности при изучении темы «Неметаллы»
Работа в группах по планам
Индивидуальная работа
Слайд 5 Техника безопасности
Верны ли следующие суждения о правилах безопасной
А. При попадании раствора кислоты на кожу, её следует промыть водой и обработать раствором питьевой соды
Б. Легковоспламеняющиеся жидкости, например ацетон, разрешается хранить только в холодильнике.
Слайд 6 Техника безопасности
Верны ли следующие суждения о способах собирания
А. Углекислый газ можно собрать в сосуд способом вытеснения воздуха.
Б. Кислород можно собрать в сосуд и способом вытеснения воздуха, и способом вытеснения воды.
Слайд 7 Техника безопасности
Верны ли суждения об обращении с газами
А. Прежде, чем поджечь водород, его необходимо проверить на чистоту.
Б. Получаемый из бертолетовой соли хлор нельзя определять по запаху.
Слайд 8 Техника безопасности
Верны ли следующие утверждения об озоне?
А. Озон
Б. Озон – совершенно безвредный газ, поэтому его предпочтительно использовать вместо хлора для очистки воды.
Слайд 9 Техника безопасности
Верны ли следующие суждения о способах
А. Углекислый газ в лаборатории получают разложением карбоната кальция при нагревании.
Б. Для лабораторных опытов углекислый газ получают при нагревании карбоната аммония.
Слайд 10 Техника безопасности
Какой из газов, попадающих в
1 метан
2 углекислый газ
3 оксид азота (4)
4 аммиак
Слайд 11 Техника безопасности
Верны ли следующие суждения
А. Метан образует взрывчатые смеси с воздухом.
Б. Растворять серную кислоту следует, добавляя к ней воду.
Слайд 12 Работа в группах
Лабораторная работа
Решив исследовать, в какие реакции может вступать мрамор, ученик прилил к нему соляную кислоту. Он увидел, что бурно выделяется газ. Когда он собрал этот газ и пропустил его через известковую воду, то увидел, что вода стала мутной. Ученик продолжил пропускание газа и некоторое время наблюдал помутнение, но оно вдруг исчезло. Тогда он решил разобраться какие реакции прошли при этом исследовании. Помогите записать данные уравнения реакций
Слайд 13 Работа в группах
Лабораторная работа
В двух пробирках карбонат натрия и силикат натрия. Как распознать эти вещества с помощью одного реактива?
В четырех пробирках находятся прозрачные растворы фторида, хлорида, бромида и иодида натрия. Как распознать эти вещества с помощью одного реактива? Запишите уравнения реакций
Слайд 14 Работа в группах
1-ая и 2-ая
Производственные процессы. Производство серной кислоты.
3-я и 4-ая группы
Аллотропия углерода. Заполнить таблицу
Производственные процессы. Производство аммиака.
Слайд 19 Индивидуальная работа
Даны вещества: Na2SO4, ВаС12, растворы НС1, H2SO4 и
Выдана соль тяжёлого металла, оксид которого используется в производстве хрусталя. При термическом разложении этой соли образуется оксид этого металла и два газа: один— газ бурого цвета, а другой— важнейший компонент воздуха. При приливании к раствору выданной соли раствора иодида калия выпадает осадок ярко-жёлтого цвета.
Составьте два молекулярных уравнения реакций
Слайд 20 Условия реакций ионного обмена (РИО):
1) Растворимость реагирующих веществ:
Кислота + Основание.
Кислота + Соль. Обязательно растворима должна быть кислота
Основание + Соль. Растворимы оба реагента
Соль + Соль. Должны быть обе растворимы
2) В ходе реакции должны образоваться осадок, газ или вода.
Индивидуальная работа
Слайд 21 Индивидуальная работа
Даны: фосфин, нитрат серебра (I), оксид
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Даны:
перманганат калия, гидрокарбонат калия, сульфит натрия, сульфат бария, гидроксид калия.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Слайд 22 Индивидуальная работа
Для выполнения задания используйте следующий перечень веществ:
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.