- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Неметаллы
Содержание
- 1. Презентация по химии на тему Неметаллы
- 2. Положение элементов неметаллов в Периодической системе химических
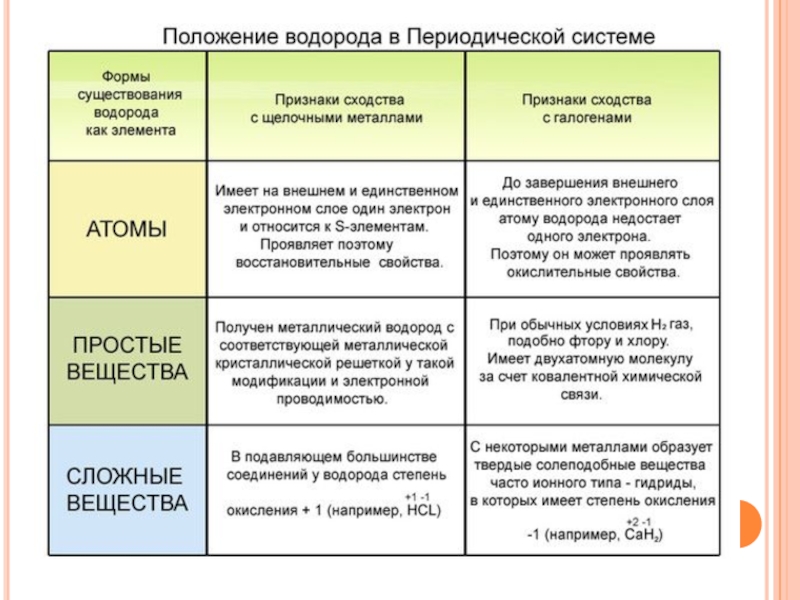
- 3. Водород в П.С. имеет двойственное положение, находится в первой и седьмой группах главных подгруппах.
- 4. Слайд 4
- 5. Особенности строения атомов неметалловНеметаллы – это химические
- 6. Из определения неметаллов следует, что для их
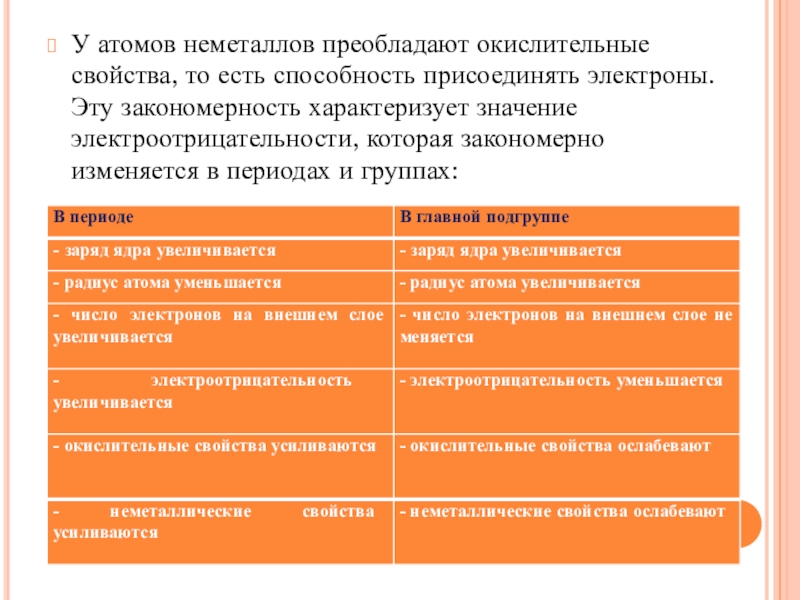
- 7. У атомов неметаллов преобладают окислительные свойства, то
- 8. Фтор – самый сильный окислитель, он не проявляет восстановительный свойства.
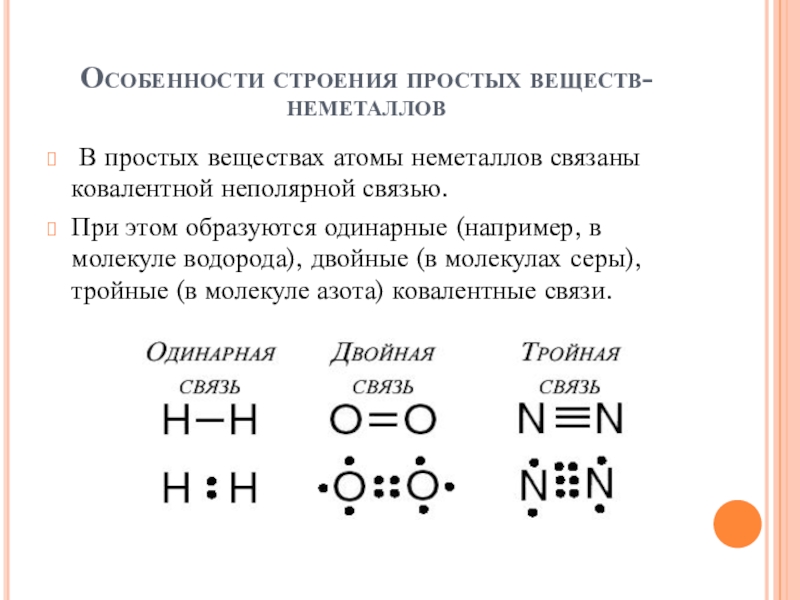
- 9. Особенности строения простых веществ-неметаллов В простых веществах
- 10. Простые вещества неметаллы могут иметь:Молекулярное строениеПри
- 11. Атомное строениеЭти вещества образованы длинными цепями атомов
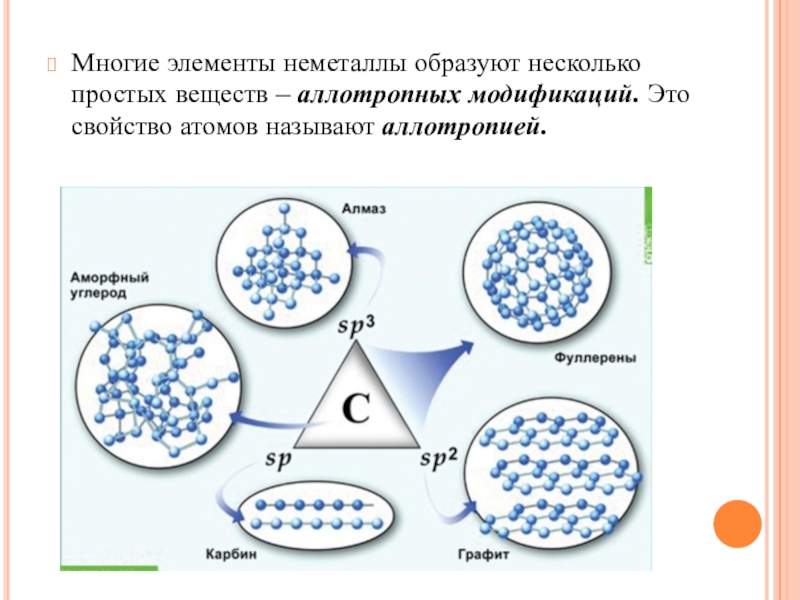
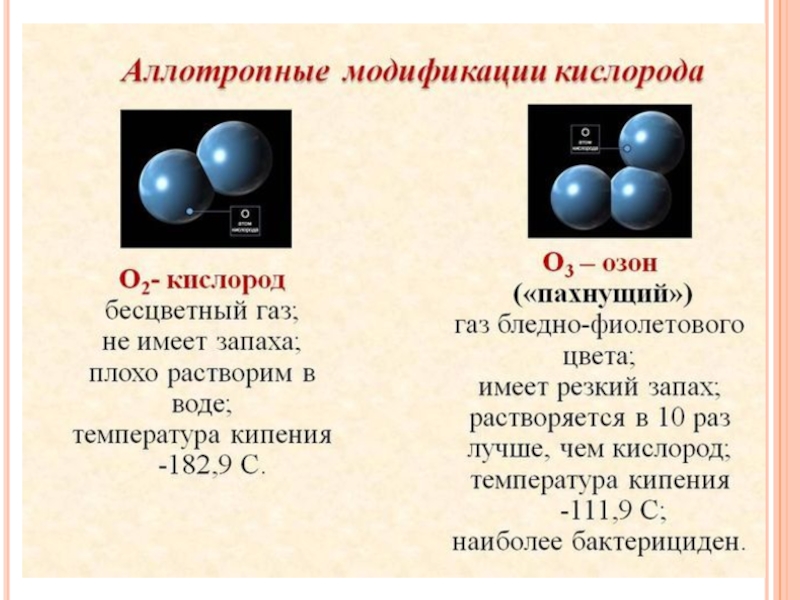
- 12. Многие элементы неметаллы образуют несколько простых веществ – аллотропных модификаций. Это свойство атомов называют аллотропией.
- 13. Слайд 13
- 14. Простые вещества – неметаллы имеют разнообразную окраску.серафосфоркремний
- 15. Физические свойства неметаллических простых веществВсе газообразные вещества,
- 16. Химические свойства неметалловОкислительные свойства простых веществ-неметаллов1. Окислительные
- 17. 2. Большинство неметаллов проявляют окислительные свойства при
- 18. 3. Любой неметалл выступает в роли окислителя
- 19. S + 3F2 = SF6H2 + F2
- 20. 4. Окислительные свойства неметаллы проявляют и в
- 21. Восстановительные свойства простых веществ-неметаллов1. По отношению к
- 22. 3. Многие неметаллы могут выступать в роли
- 23. Слайд 23
- 24. Слайд 24
- 25. Слайд 25
- 26. Слайд 26
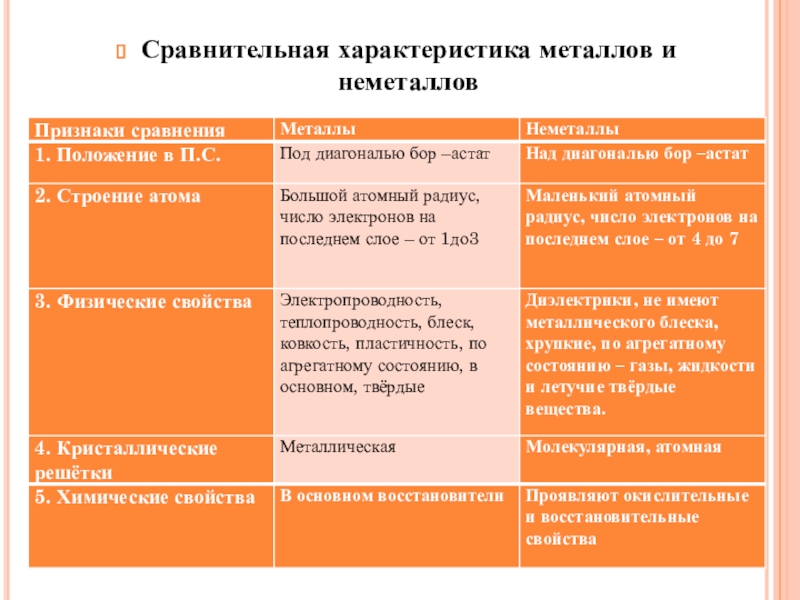
- 27. Сравнительная характеристика металлов и неметаллов
- 28. Вопросы по теме «Неметаллы» 1) Какой из
- 29. Использованные информационные источники1. Бабков, А.В. Химия [Текст]:
Положение элементов неметаллов в Периодической системе химических элементовВсе элементы неметаллы (кроме водорода) занимают в П.С. верхний правый угол, образуя треугольник, вершиной которого является фтор, а основанием диагональ бор-астат.
Слайд 2Положение элементов неметаллов в Периодической системе химических элементов
Все элементы неметаллы (кроме
водорода) занимают в П.С. верхний правый угол, образуя треугольник, вершиной которого является фтор, а основанием диагональ бор-астат.
Слайд 3Водород в П.С. имеет двойственное положение, находится в первой и седьмой
группах главных подгруппах.
Слайд 5Особенности строения атомов неметаллов
Неметаллы – это химические элементы, для атомов которых
характерна способность принимать электроны до завершения внешнего слоя благодаря наличию, как правило на внешнем слое четырёх и более электронов и малому радиусу атомов по сравнению с атомами металлов.
Слайд 6Из определения неметаллов следует, что для их атомов характерны высокие значения
электроотрицательности. Она изменяется в пределах от 2 до 4.
Неметаллы – это элементы главных подгрупп, преимущественно р- элементы, исключение составляет водород – s-элемент.
Неметаллы – это элементы главных подгрупп, преимущественно р- элементы, исключение составляет водород – s-элемент.
Слайд 7У атомов неметаллов преобладают окислительные свойства, то есть способность присоединять электроны.
Эту закономерность характеризует значение электроотрицательности, которая закономерно изменяется в периодах и группах:
Слайд 9Особенности строения простых веществ-неметаллов
В простых веществах атомы неметаллов связаны ковалентной
неполярной связью.
При этом образуются одинарные (например, в молекуле водорода), двойные (в молекулах серы), тройные (в молекуле азота) ковалентные связи.
При этом образуются одинарные (например, в молекуле водорода), двойные (в молекулах серы), тройные (в молекуле азота) ковалентные связи.
Слайд 10 Простые вещества неметаллы могут иметь:
Молекулярное строение
При обычных условиях большинство таких
веществ представляют собой газы (H2, N2, O2, F2, Cl2, O3) или твёрдые вещества (I2, P4, S8) и лишь единственный бром (Br2) является жидкостью.
Все эти вещества молекулярного строения, поэтому летучи, в твёрдом состоянии они легкоплавки из-за слабого межмолекулярного взаимодействия, удерживающего их молекулы в кристалле, и способны к возгонке.
Все эти вещества молекулярного строения, поэтому летучи, в твёрдом состоянии они легкоплавки из-за слабого межмолекулярного взаимодействия, удерживающего их молекулы в кристалле, и способны к возгонке.
Слайд 11Атомное строение
Эти вещества образованы длинными цепями атомов (Cn, Bn, Sin, Sen,
Ten). Из-за большой прочности ковалентных связей они, как правило, имеют высокую твёрдость.
Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их мала.
Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их мала.
Слайд 12Многие элементы неметаллы образуют несколько простых веществ – аллотропных модификаций. Это
свойство атомов называют аллотропией.
Слайд 15Физические свойства неметаллических простых веществ
Все газообразные вещества, жидкий бром, а также
типичные ковалентные кристаллы – диэлектрики, так как все внешние электроны их атомов использованы для образования химических связей
Кристаллы неметаллов непластичны, и любая деформация вызывает разрушение ковалентных связей.
Большинство неметаллов не имеет металлического блеска.
Кристаллы неметаллов непластичны, и любая деформация вызывает разрушение ковалентных связей.
Большинство неметаллов не имеет металлического блеска.
Слайд 16Химические свойства неметаллов
Окислительные свойства простых веществ-неметаллов
1. Окислительные свойства неметаллов проявляются при
их взаимодействии с металлами:
2Na + S = Na2S
3 Mg + N2 = Mg3N2
Fe + S = FeS
2Fe + 3Cl2 = 2FeCl3
2Na + S = Na2S
3 Mg + N2 = Mg3N2
Fe + S = FeS
2Fe + 3Cl2 = 2FeCl3
Слайд 172. Большинство неметаллов проявляют окислительные свойства при взаимодействии с водородом. В
результате образуются летучие водородные соединения:
H2 + S = H2S
H2 + Cl2 = 2HCl
3H2 + N2 ↔ 2NH3
H2 + S = H2S
H2 + Cl2 = 2HCl
3H2 + N2 ↔ 2NH3
Слайд 183. Любой неметалл выступает в роли окислителя в реакциях с теми
неметаллами, которые имеют более низкое значение электроотрицательности:
2P + 5S = P2S5
Электроотрицательность серы больше, чем у фосфора, поэтому она здесь проявляет окислительные свойства
2P + 5S = P2S5
Электроотрицательность серы больше, чем у фосфора, поэтому она здесь проявляет окислительные свойства
Слайд 19S + 3F2 = SF6
H2 + F2 = 2HF
Si + 2F2
= SiF4
Электроотрицательность фтора больше, чем у всех остальных химических элементов, поэтому он проявляет свойства окислителя.
Фтор – самый сильный окислитель из неметаллов, проявляет в реакциях только окислительные свойства.
Электроотрицательность фтора больше, чем у всех остальных химических элементов, поэтому он проявляет свойства окислителя.
Фтор – самый сильный окислитель из неметаллов, проявляет в реакциях только окислительные свойства.
Слайд 204. Окислительные свойства неметаллы проявляют и в реакциях с некоторыми сложными
веществами:
CH4 +2O2 → CO2 +2H2O
(кислород – окислитель)
Не только кислород, но и другие неметаллы также могут быть окислителями в реакциях со сложными веществами – неорганическими и органическими:
2FeCl2 + Cl2 = 2FeCl3
CH4 +2O2 → CO2 +2H2O
(кислород – окислитель)
Не только кислород, но и другие неметаллы также могут быть окислителями в реакциях со сложными веществами – неорганическими и органическими:
2FeCl2 + Cl2 = 2FeCl3
Слайд 21Восстановительные свойства простых веществ-неметаллов
1. По отношению к фтору все неметаллы проявляют
восстановительные свойства.
2. Неметаллы, кроме фтора, служат восстановителями при взаимодействии с кислородом:
S + O2 → SO2
N2 + O2 ↔ 2NO
4P + 5O2 → 2P2O5
C +O2 → CO2
В результате реакций образуются оксиды неметаллов.
2. Неметаллы, кроме фтора, служат восстановителями при взаимодействии с кислородом:
S + O2 → SO2
N2 + O2 ↔ 2NO
4P + 5O2 → 2P2O5
C +O2 → CO2
В результате реакций образуются оксиды неметаллов.
Слайд 223. Многие неметаллы могут выступать в роли восстановителя в реакциях со
сложными веществами – окислителями:
H2 + CuO → Cu + H2O
6P + 5KClO3 → 5KCl + 3P2O5
(фосфор – восстановитель)
C + 4HNO3 → CO2 + 4NO2 + 2H2O
(кислота – окислитель)
H2 + CuO → Cu + H2O
6P + 5KClO3 → 5KCl + 3P2O5
(фосфор – восстановитель)
C + 4HNO3 → CO2 + 4NO2 + 2H2O
(кислота – окислитель)
Слайд 28Вопросы по теме «Неметаллы»
1) Какой из неметаллов имеет самый маленький радиус
атома?
2) У кого из атомов неметаллов валентные электроны прочнее всего связаны с ядром?
3) Как изменяется характер химических свойств простых веществ-неметаллов в группе?
4) Какое из простых веществ проявляет свойства только окислителя?
5) К каким электронным семействам относят элементы-неметаллы?
6) Какие элементы неметаллы являются биогенными?
2) У кого из атомов неметаллов валентные электроны прочнее всего связаны с ядром?
3) Как изменяется характер химических свойств простых веществ-неметаллов в группе?
4) Какое из простых веществ проявляет свойства только окислителя?
5) К каким электронным семействам относят элементы-неметаллы?
6) Какие элементы неметаллы являются биогенными?
Слайд 29Использованные информационные источники
1. Бабков, А.В. Химия [Текст]: учебник для студентов сред.
мед. учеб. заведений / А.В. Бабков, Т.И. Баранова, В.А. Попков; под ред. А.Н. Творогова. – М.: Издательский центр «Академия», 2003. – 272 с.
2. Габриелян, О.С. Химия 11 класс. Базовый уровень [Текст]: учеб. для общеобразоват. учреждений / О.С. Габриелян; под ред. А.В.Ящукова. – 3-е изд., перераб. – М.: Дрофа, 2008. – 223 с.
3. Ерохин, Ю.М. Химия [Текст]: учеб. для сред. проф. учеб. заведений / Ю.М. Ерохин; под ред. В.Н.Николаева. – 8-е изд., стер. – М.: Издательский центр «Академия», 2007. – 384 с.
4. Яндекс картинки https://yandex.ru/images/search?textD0%B8%D0%B7%D0%BD%D0%B8&stype=image&lr=65&noreask=1&parent-reqid=1475903999184409-13365433093687541860103608-sfront6-016&source=wiz
2. Габриелян, О.С. Химия 11 класс. Базовый уровень [Текст]: учеб. для общеобразоват. учреждений / О.С. Габриелян; под ред. А.В.Ящукова. – 3-е изд., перераб. – М.: Дрофа, 2008. – 223 с.
3. Ерохин, Ю.М. Химия [Текст]: учеб. для сред. проф. учеб. заведений / Ю.М. Ерохин; под ред. В.Н.Николаева. – 8-е изд., стер. – М.: Издательский центр «Академия», 2007. – 384 с.
4. Яндекс картинки https://yandex.ru/images/search?textD0%B8%D0%B7%D0%BD%D0%B8&stype=image&lr=65&noreask=1&parent-reqid=1475903999184409-13365433093687541860103608-sfront6-016&source=wiz





















![Презентация по химии на тему Неметаллы Использованные информационные источники1. Бабков, А.В. Химия [Текст]: учебник для студентов сред. Использованные информационные источники1. Бабков, А.В. Химия [Текст]: учебник для студентов сред. мед. учеб. заведений / А.В. Бабков,](/img/thumbs/09278a7921006aa05ae9477cebdb1ace-800x.jpg)





