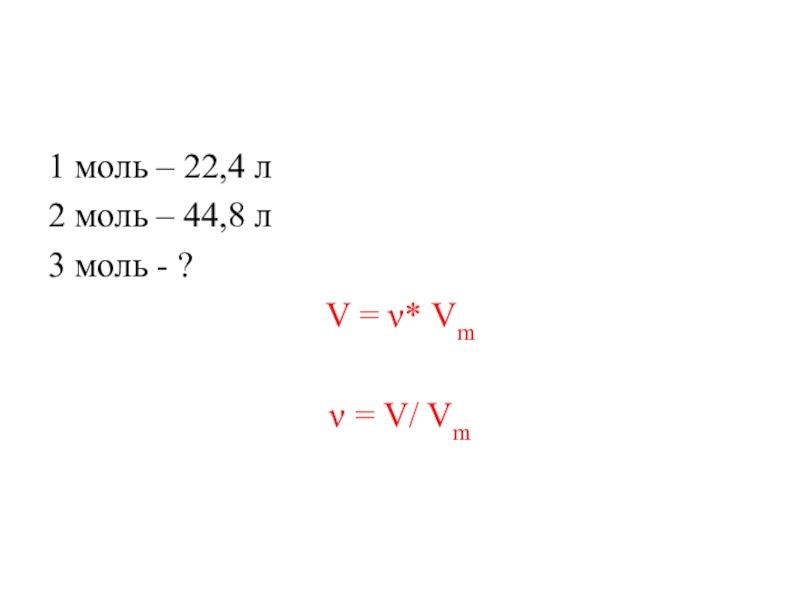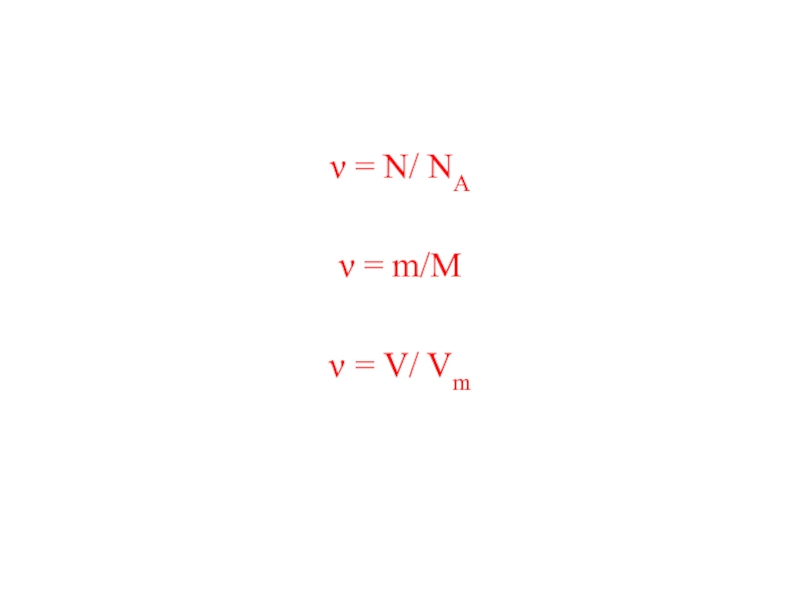- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Молярный объем газа. Закон Авогадро (8 класс)
Содержание
- 1. Презентация по химии на тему Молярный объем газа. Закон Авогадро (8 класс)
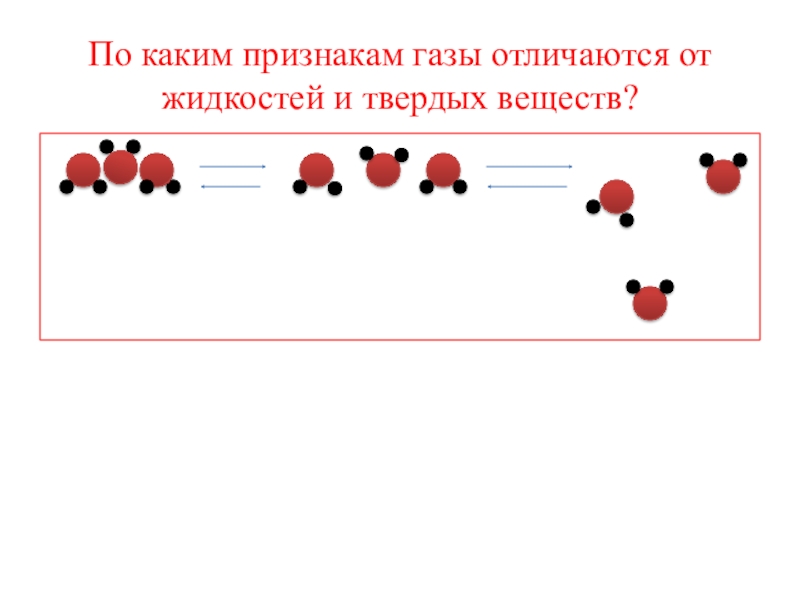
- 2. По каким признакам газы отличаются от жидкостей и твердых веществ?
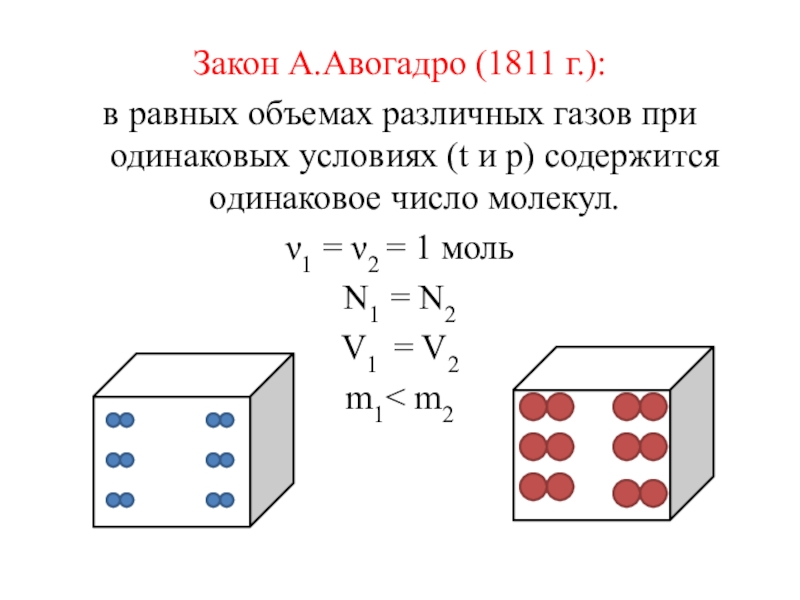
- 3. Закон А.Авогадро (1811 г.):в равных объемах различных
- 4. 1 моль любого газа при н.у.(t =
- 5. 1 моль – 22,4 л2 моль –
- 6. ν = N/ NAν = m/Мν = V/ Vm
- 7. Решить задачи:1 Какое количество вещества составляет 11,2
- 8. Алгоритм решения задач по уравнению химической реакции:Записать
- 9. 4 Сгорело 120 г каменного угля.
- 10. I способ ν = m
- 11. 4 Сгорело 120 г каменного угля.
- 12. 5 Сгорело 8 г серы. Вычислите: а)
- 13. 6 Вычислите, достаточно ли
Слайд 3Закон А.Авогадро (1811 г.):
в равных объемах различных газов при одинаковых условиях
ν1 = ν2 = 1 моль
N1 = N2
V1 = V2
m1< m2
Слайд 41 моль любого газа при н.у.
(t = 0 C и р
Vm = 22,4 л/моль
Слайд 7Решить задачи:
1 Какое количество вещества составляет
11,2 л кислорода при н.у.?
2
3 Сколько молекул водорода содержится в 44,8 л этого газа при н.у.?
4 Сгорело 120 г каменного угля. Вычислите массу и объем образующегося углекислого газа при н.у.
Слайд 8Алгоритм решения задач по уравнению химической реакции:
Записать условие задачи.
Составить уравнение реакции.
Подчеркнуть
Найти по уравнению реакции количество вещества (ν), молярную массу (М), массу (m) для тех веществ, которые указаны в условии задачи.
Составить пропорцию и вычислить массу неизвестного вещества.
Записать ответ.
Слайд 9 4 Сгорело 120 г каменного угля. Вычислите массу и объем образующегося
Дано:
m (С) = 120 г
Найти:
m (СО2) - ?
V (СО2) - ?
Решение:
120 г х
С + О2 = СО 2
ν 1 моль 1 моль
М 12 г/моль 44г/моль
m 12 г 44 г
120 г = х х = 120 г * 44 г = 440г
12 г 44 г 12 г
Слайд 10I способ
ν = m m
М М Vm
ν = V
Vm V= m* Vm
М
V= 440 г*22,4 л/моль = 224 л
44 г/моль
Ответ: 440 г, 224 л
Слайд 11 4 Сгорело 120 г каменного угля. Вычислите массу и объем образующегося
Дано:
m (С) = 120 г
Найти:
m (СО2) - ?
V (СО2) - ?
Решение: II способ
120 г y
С + О2 = СО2
ν 1 моль ν 1 моль
М 12 г/моль Vm 22,4 л/моль
m 12 г V 22,4 л
120 г = y у =120 г*22,4 л= 224л
12 г 22,4 л 12 г
Ответ: 224 л
Слайд 125 Сгорело 8 г серы. Вычислите:
а) объем вступившего в реакцию
б) объем образующегося оксида серы (IV) (н.у.).
6 Вычислите, достаточно ли кислорода (н.у.) объемом 15 л для сжигания фосфора массой 62 г.
Слайд 13 6 Вычислите, достаточно ли кислорода (н.у.) объемом 15 л для сжигания
Дано:
V (О2) = 15 л
m (Р) = 62 г
Найти:
V (О2) - ?
Решение:
62 г х
4Р + 5О2 = 2Р2О5
ν 4 моль ν 5 моль
М 31 г/мольVm 22,4 л/моль
m 124г V 112 л
62 г = х х = 62 г*112л= 56л
124 г 112 л 124 г
Ответ: ?