№10 с УИОП
Раменский район Московской области
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Молярный объём газов. Относительная плотность газов (9 класс)
Содержание
- 1. Презентация по химии на тему Молярный объём газов. Относительная плотность газов (9 класс)
- 2. Цели урокаУзнать о нормальных условиях, молярном объёме
- 3. Количество веществаКоличество вещества – ν – это
- 4. Число Авогадро 1моль – это такое количество
- 5. Расчёт числа частиц веществаЧисло атомов или молекул,
- 6. Молярная масса Молярная масса – это
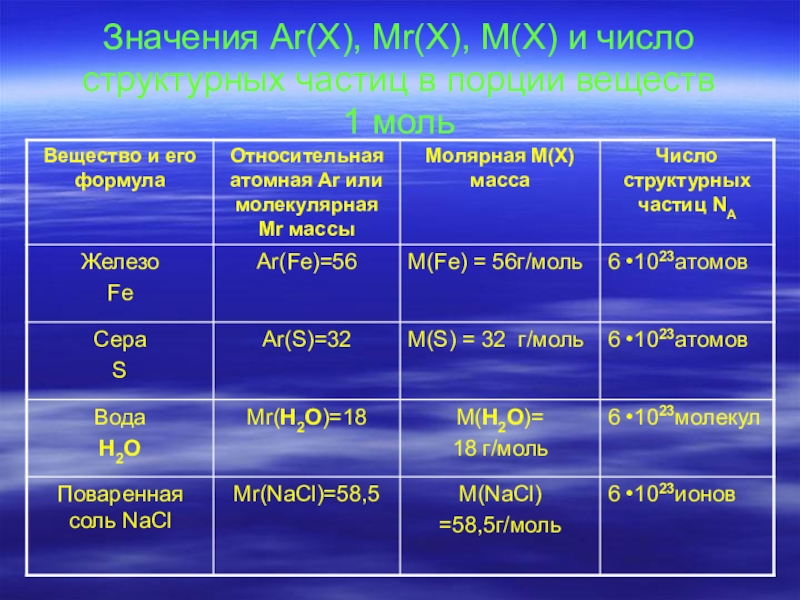
- 7. Значения Ar(X), Mr(X), M(X) и число структурных частиц в порции веществ 1 моль
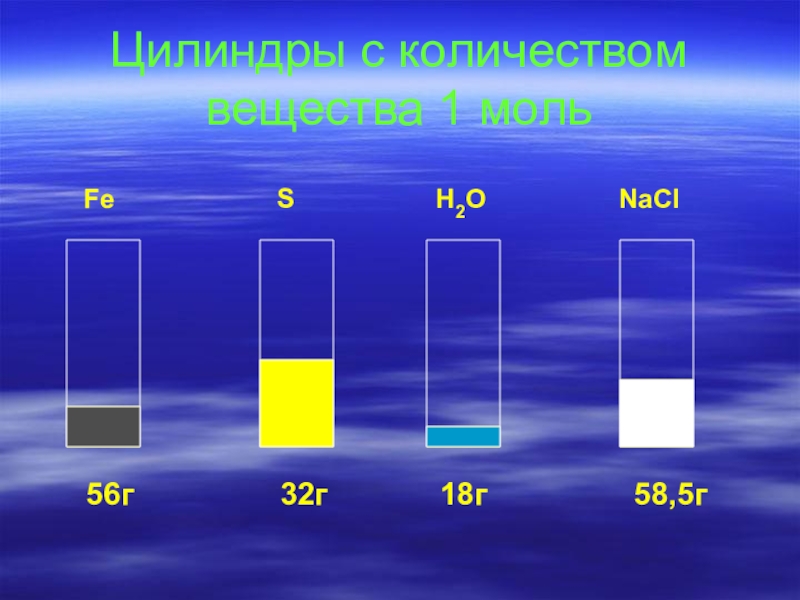
- 8. Цилиндры с количеством вещества 1 моль
- 9. Плотность веществаИзвестно, что твёрдые и жидкие вещества
- 10. Объём жидкостей
- 11. Объём твёрдых веществ
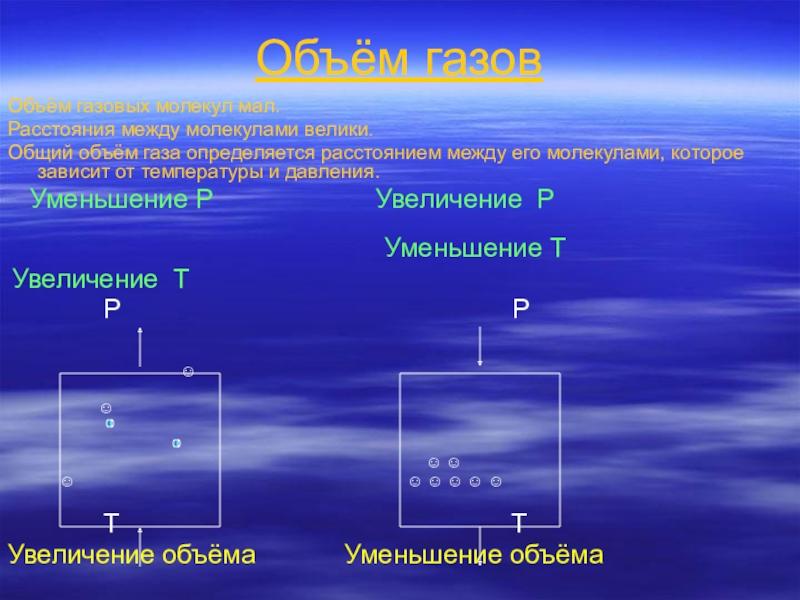
- 12. Объём газовОбъём газовых молекул мал.Расстояния между молекулами
- 13. Нормальные условияСравнивать объёмы газов можно только при
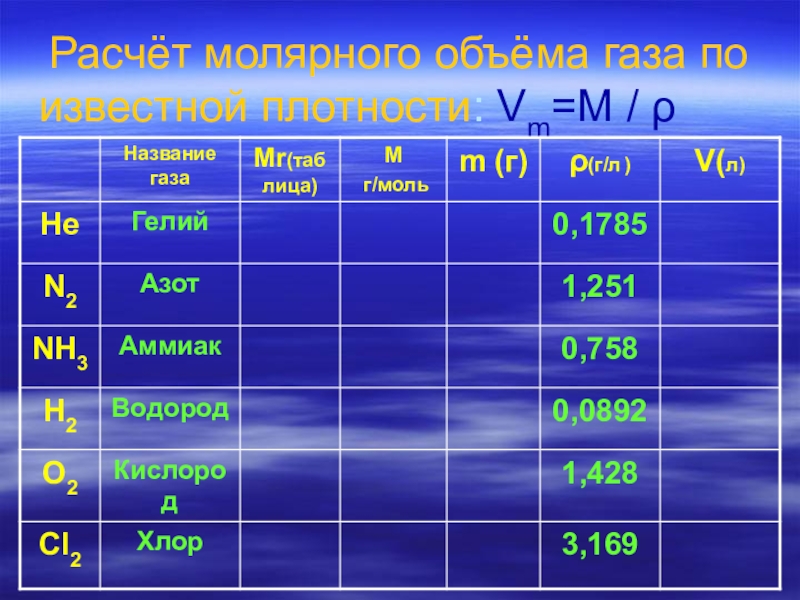
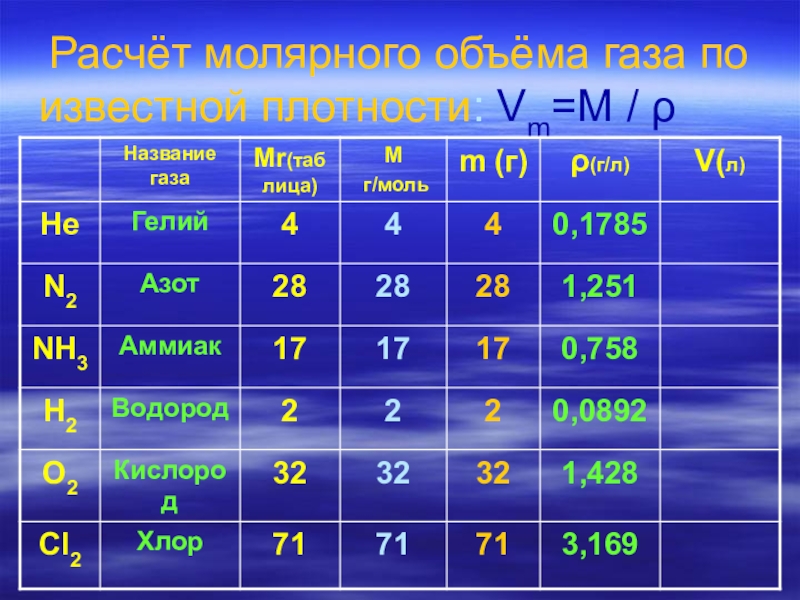
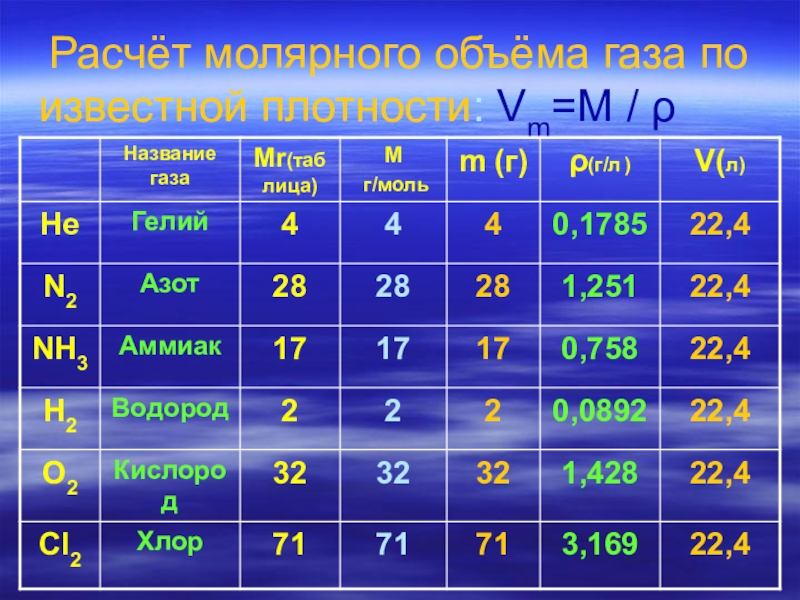
- 14. Расчёт молярного объёма газа по известной плотности:
- 15. Расчёт молярного объёма газа по известной плотности:
- 16. Расчёт молярного объёма газа по известной плотности:
- 17. Молярный объём газов Любой газ, взятый
- 18. Закон Авогадро Известно, что 1 моль
- 19. Расчёт объёма газа Количество вещества (ν)
- 20. Относительная плотность газа - DСравним плотности газов:
- 21. Объём 1моль любого газа
- 22. Домашнее задание§ 10№ 1,3,4,5,6(в)По учебнику Н.С. Новошинской,
Цели урокаУзнать о нормальных условиях, молярном объёме газа,относительной плотности газов.Научиться рассчитывать объём газа при н.у., молярную массу газа по его плотности при н.у. , молярную массу газа по его относительной плотности по другому газу.
Слайд 1 Молярный объём газов Относительная плотность газов 9 класс Учитель химии: Шишкова Любовь Викторовна Ново-Харитоновская СОШ
Слайд 2Цели урока
Узнать о нормальных условиях, молярном объёме газа,относительной плотности газов.
Научиться рассчитывать
объём газа при н.у., молярную массу газа по его плотности при н.у. , молярную массу газа по его относительной плотности по другому газу.
Слайд 3Количество вещества
Количество вещества – ν – это физическая величина, которая определяет
число структурных единиц(атомов, молекул, ионов) в порции вещества.
Единица количества вещества – моль (от французского – males – множество)
Единица количества вещества – моль (от французского – males – множество)
Слайд 4Число Авогадро
1моль – это такое количество вещества, которое содержит 6,02⋅10
23 атомов, молекул или других структурных частиц.
NA – Постоянная Авогадро (в честь итальянского учёного 19 века)
NA= 6,02⋅10 23 моль -1
NA – Постоянная Авогадро (в честь итальянского учёного 19 века)
NA= 6,02⋅10 23 моль -1
Слайд 5Расчёт числа частиц вещества
Число атомов или молекул, содержащихся в определённой порции
вещества, можно вычислить по формуле:
N= NA⋅ν
Пример: Пусть порция воды взята количеством вещества ν=0,5 моль, тогда
N(H2O)=NA⋅ν(H2O)
N(H2O)= 6,02⋅10 23 моль -1⋅ 0,5 моль=
= 3,01⋅10 23 молекул
N= NA⋅ν
Пример: Пусть порция воды взята количеством вещества ν=0,5 моль, тогда
N(H2O)=NA⋅ν(H2O)
N(H2O)= 6,02⋅10 23 моль -1⋅ 0,5 моль=
= 3,01⋅10 23 молекул
Слайд 6Молярная масса
Молярная масса – это физическая величина, равная отношению
массы(m) вещества к количеству вещества(ν). Это масса 1моль вещества.
M = m / ν (г/моль) ; M(x)=Mr(x)
Пример:
Ar(Cu)=64; M(Cu)=64г/моль;
Mr(H2SO4)=98; M (H2SO4)=98 г/моль.
m = M ⋅ν ν = m / М
M = m / ν (г/моль) ; M(x)=Mr(x)
Пример:
Ar(Cu)=64; M(Cu)=64г/моль;
Mr(H2SO4)=98; M (H2SO4)=98 г/моль.
m = M ⋅ν ν = m / М
Слайд 9Плотность вещества
Известно, что твёрдые и жидкие вещества занимают разный объём, если
взяты количеством вещества 1моль.
V=m / ρ Vm=M / ρ ρ=M / Vm
ρ- плотность-это масса единичного объёма вещества ( жидкого, твёрдого, газообразного ).
(ρ - найти в физическом справочнике)
V=m / ρ Vm=M / ρ ρ=M / Vm
ρ- плотность-это масса единичного объёма вещества ( жидкого, твёрдого, газообразного ).
(ρ - найти в физическом справочнике)
Слайд 10Объём жидкостей
Vm(H2O)=M / ρ=18г/моль =18см3
1г/см3
ρ(H2O)=1г/см3
Vm(H2SO4)=M / ρ=98г/моль =53,5см3
1,83г/см3
ρ(H2SO4)=1,83г/см3
Слайд 11Объём твёрдых веществ
Vm(Fe)=M / ρ=56г/моль =7,1см3
7,8г/см3
ρ(Fe)=7,8г/см3
Vm(Al)=M / ρ=27г/моль =10см3
2,7г/см3
ρ(Al)=2,7г/см3
Слайд 12Объём газов
Объём газовых молекул мал.
Расстояния между молекулами велики.
Общий объём газа определяется
расстоянием между его молекулами, которое зависит от температуры и давления.
Уменьшение Р Увеличение Р
Уменьшение Т
Увеличение Т
Р Р
☺
☺
☺ ☺
☺ ☺ ☺ ☺ ☺ ☺
Т Т
Увеличение объёма Уменьшение объёма
Уменьшение Р Увеличение Р
Уменьшение Т
Увеличение Т
Р Р
☺
☺
☺ ☺
☺ ☺ ☺ ☺ ☺ ☺
Т Т
Увеличение объёма Уменьшение объёма
Слайд 13Нормальные условия
Сравнивать объёмы газов можно только при одинаковых условиях (нормальных условиях
– н. у.)
Т=0ºС
Р=760 мм. рт. ст.=1 атм.=101,325 КПа
Т=0ºС
Р=760 мм. рт. ст.=1 атм.=101,325 КПа
Слайд 17Молярный объём газов
Любой газ, взятый количеством вещества 1 моль,
занимает один и тот же объём, который называется молярным объёмом, обозначается Vm, выражается в л/моль.
Vm=22,4 л/моль
Vm=22,4 л/моль
Слайд 18Закон Авогадро
Известно, что 1 моль любого вещества(твёрдого,жидкого, газа
)содержит одинаковое число молекул –
NA= 6,02⋅10 23 моль -1
Притом, 1 моль любого газа занимает ещё и одинаковый объём –
Vm=22,4 л/моль
1811год. Закон Авогадро
В равных объёмах различных газов при одинаковых условиях содержится одинаковое число молекул
NA= 6,02⋅10 23 моль -1
Притом, 1 моль любого газа занимает ещё и одинаковый объём –
Vm=22,4 л/моль
1811год. Закон Авогадро
В равных объёмах различных газов при одинаковых условиях содержится одинаковое число молекул
Слайд 19Расчёт объёма газа
Количество вещества (ν) связывает массу(m), объём(V) и
число частиц(N):
ν=m / M
m V N
ν=V / Vm Приравняем : = =
M Vm NA
ν=N / NA
m⋅ Vm
Известна масса, найдём объём: V = M
ν=m / M
m V N
ν=V / Vm Приравняем : = =
M Vm NA
ν=N / NA
m⋅ Vm
Известна масса, найдём объём: V = M
Слайд 20Относительная плотность газа - D
Сравним плотности газов: D=ρ1 / ρ2
ρ=m / V ρ=M / Vm
ρ1 M 1 / Vm M 1 ⋅ Vm M 1
= = =
ρ2 M 2 / Vm M 2⋅ Vm M 2
Относительная плотность одного газа по другому – безразмерная величина, равная отношению их молярных масс(М) или (Mr)
D=M 1 / M 2 ; M 1 = D ⋅ M 2 ; Мвоздуха=29 г/моль
ρ1 M 1 / Vm M 1 ⋅ Vm M 1
= = =
ρ2 M 2 / Vm M 2⋅ Vm M 2
Относительная плотность одного газа по другому – безразмерная величина, равная отношению их молярных масс(М) или (Mr)
D=M 1 / M 2 ; M 1 = D ⋅ M 2 ; Мвоздуха=29 г/моль