- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Металлы (9 класс)
Содержание
- 1. Презентация по химии на тему Металлы (9 класс)
- 2. Цели: изучить и проанализировать свойства
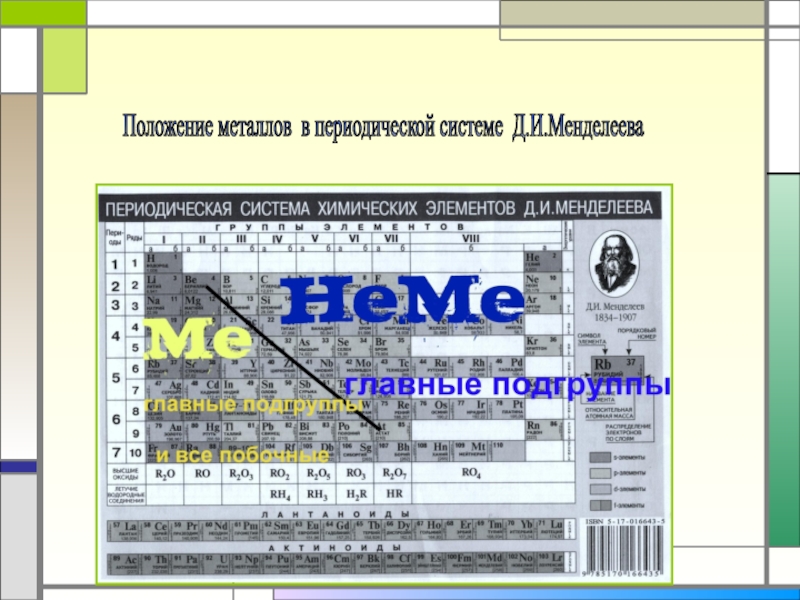
- 3. Положение металлов в периодической системе Д.И.Менделеева
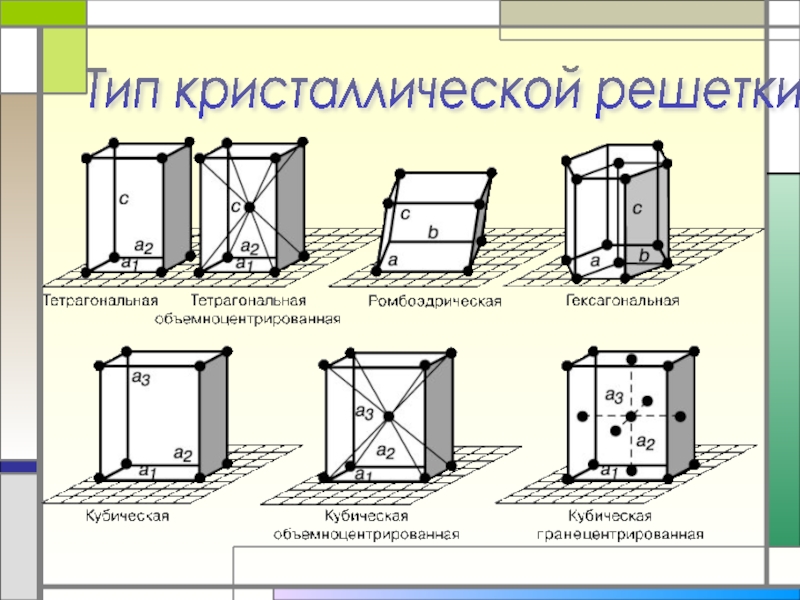
- 4. Тип кристаллической решетки
- 5. Физические свойства теплопроводность электропроводность металлический блеск пластичность ковкость
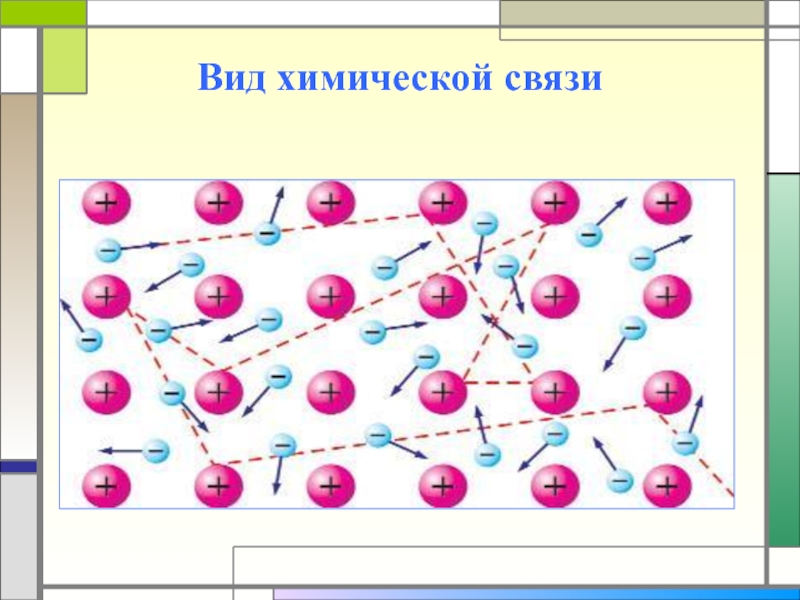
- 6. Вид химической связи
- 7. Химические свойства металлов Электрохимический ряд активности металловСлева направо химическая активность атомов ослабевает
- 8. Примеры взаимодействия металлов: С простыми веществами
- 9. – с серой S
- 10. Со сложными веществами – Водой Me +
- 11. Натрий в воде 0
- 12. Магний в воде 0
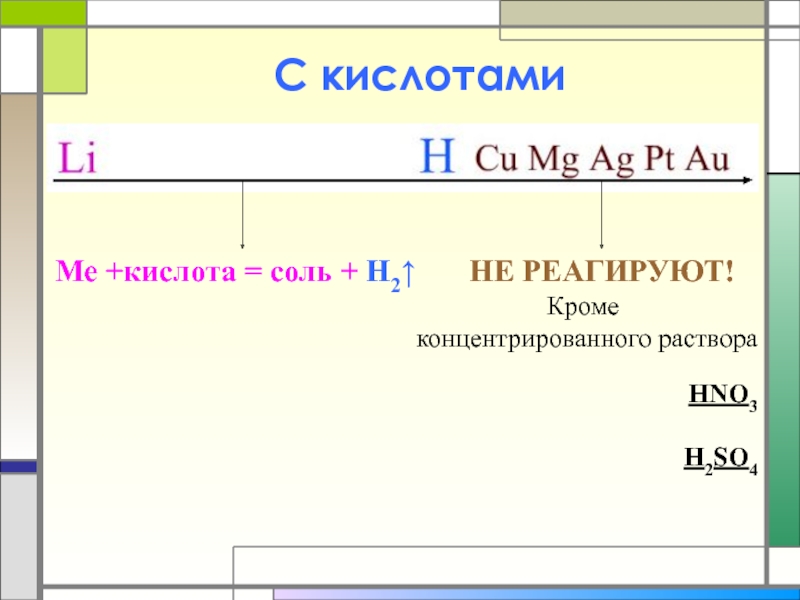
- 13. С кислотами Me +кислота = соль +
- 14. Mg+H2SO4 = MgSO4 +H2↑
- 15. Zn+2HCl = ZnCl2 + H2↑
- 16. Слайд 16
- 17. С солями «Предыдущий активнее, чем последующий»
- 18. Слайд 18
- 19. Щелочные металлыLi Na
- 20. Щелочноземельные металлыЛетучие соединения щёлочноземельных металлов придают пламени
- 21. Алюминий как представитель III группы главной подгруппы периодической системы
- 22. +13 Al ) ) ) 1S22S22P63S23P1+3
- 23. Al2O3Al(OH)3 HAlO2
- 24. ….но и с основанием (щелочью): Al(OH)3 + NaOH → NaAlO2 + 2H2OПолучение растворимого NaAlO2 (алюмината натрия)
- 25. Происхождение и физические свойстваВ природе алюминий встречается
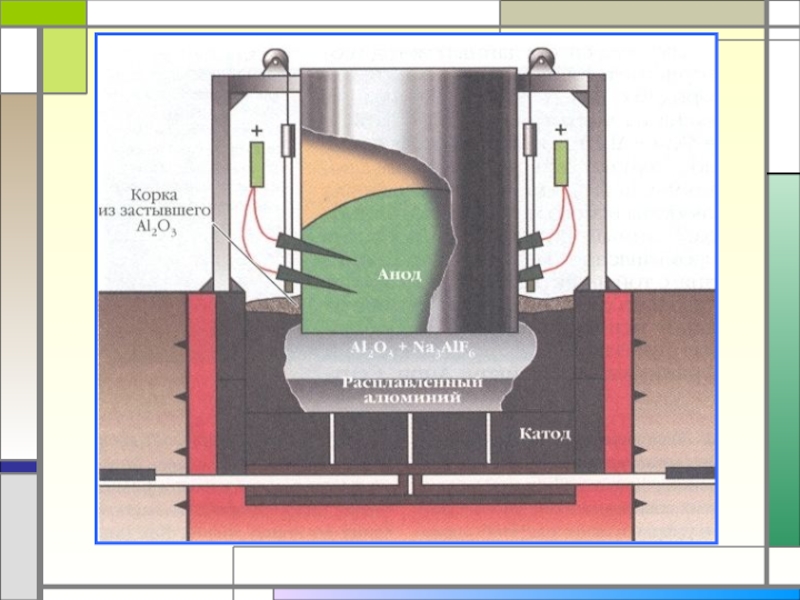
- 26. Получение алюминия
- 27. Алюмотермия
- 28. Применение алюминия и его сплавов.Алюминиевые провода: Фольга: Различные лекарства,применяемые при болезнях желудка:
- 29. Металлы в природе и их получение Химически
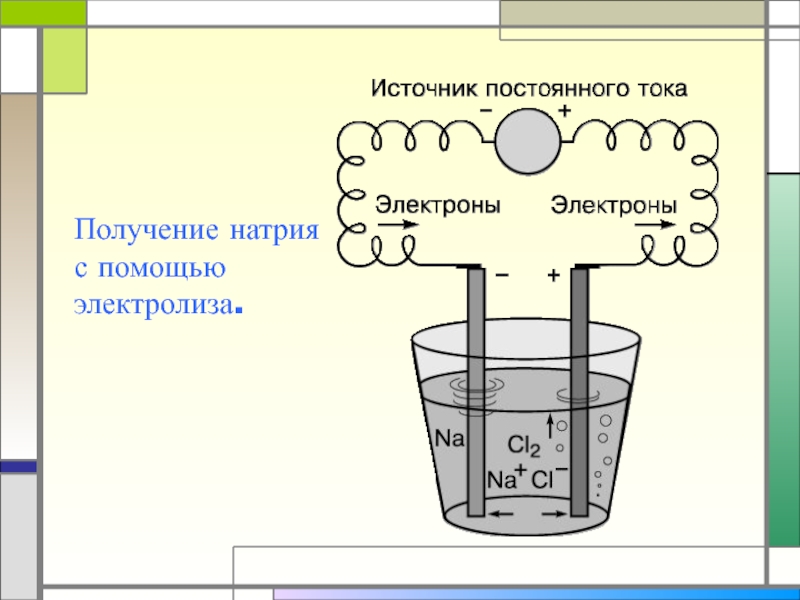
- 30. Получение натрия с помощью электролиза.
- 31. Металлы средней активности. Железо.+26Fe ) ) ) ) 2 8 14 2s
- 32. Дамасская сталь
- 33. Извлечение железа из руд.2C + O2 →
- 34. Как горит железо?
- 35. Применение.Железо — основной компонент сталей и чугунов
- 36. Благородные металлы. Серебро.+47Ag ) ) ) )
- 37. Применение серебраОбеззараживание водыПроизводство ювелирных изделий.
- 38. Металлов в природе значительно больше, чем неметаллов.На
Слайд 2 Цели:
изучить и проанализировать свойства металлов
Задачи:
индивидуально изучить
провести опытно-исследовательскую работу по изучению свойств металлов
Цели и задачи проектной работы
Слайд 5Физические свойства
теплопроводность
электропроводность
металлический блеск
пластичность
Слайд 7Химические свойства металлов
Электрохимический ряд активности металлов
Слева направо химическая активность атомов
Слайд 8Примеры взаимодействия металлов:
С простыми веществами (неметаллами) – кислородом O2
0 0 +2 -2
2Mg +O2 = 2MgO
0 +2 0 4 2 Mg -2ê → Mg, Mg –
восстановитель
0 -2 0
2 1 O2 + 4ê → 2O, O2 -
окислитель
Слайд 9 – с серой S
0
Fe + S = FeS
0 +2
2 1 Fe - 2ê → Fe –
восстановитель
0 -2
2 1 S + 2ê → S –
окислитель
Слайд 11Натрий в воде
0
2Na + 2H2O(+ фенолфталеин)=2NaOH + H2
0 +1 0
2 Na - 1ê → Na, Na - восстановитель
+1 0 +1
1 2H + 2ê → H2, H -окислитель
Слайд 12Магний в воде
0
Mg + H2O = MgO + H2 ↑
0 +2 0
2 1 Mg – 2ê → Mg, Mg-
восстановитель
+1 0 +1
2 1 2H + 2ê → H2 , H –
окислитель
Слайд 13С кислотами
Me +кислота = соль + H2↑
Кроме
концентрированного раствора
HNO3
H2SO4
Слайд 14
Mg+H2SO4 = MgSO4 +H2↑
2+
ПИФ Mg +2H+ SO4→Mg+ SO4+2H
2Al+3H2SO4=Al2(SO4)3 +3H2↑
3+ + 2- 3+ 2- +
ПИФ 2Al+6H+3SO4→2Al+3SO4+6H
Zn+H2SO4 = ZnSO4 + H2↑
2+ + 2- 2+ 2- +
ПИФ Zn+2H+SO4 →Zn+SO4 +2H
Cu+H2SO4 ≠
Слайд 15Zn+2HCl = ZnCl2 + H2↑
раствор
восстановитель
+1 0 +1 2 1 2H + 2ê → H2, H –
окислитель
Слайд 16 0 +1
Слайд 18 0 +2 -2
Слайд 19Щелочные металлы
Li Na
С электронным строением атомов щелочных металлов связана способность этих металлов и их соединений окрашивать пламя в различный цвет. По цвету пламени можно различить соли этих металлов
Слайд 20Щелочноземельные металлы
Летучие соединения щёлочноземельных металлов придают пламени характерный цвет: соединения кальция
Ca Sr Ba
Слайд 23
Al2O3
Al(OH)3 HAlO2
характерным
Al(OH)3 + 3HCl→ AlCl3 +3H2O
Слайд 24….но и с основанием (щелочью):
Al(OH)3 + NaOH → NaAlO2 +
Получение растворимого NaAlO2
(алюмината натрия)
Слайд 25Происхождение и физические свойства
В природе алюминий встречается только в соединениях (минералах):
Бокситы –
Al2O3 • H2O (с примесями SiO2, Fe2O3, CaCO3)
Нефелины -
KNa3[AlSiO4]4
Алунит –
KAl(SO4)2 • 2Al(OH)3
глинозём: смеси каолинов с песком SiO2, известняком CaCO3, магнезитом MgCO3
Корунд -Al2O3
Полевой шпат (ортоклаз) -
K2O·Al2O3·6SiO2
Слайд 28Применение алюминия и его сплавов.
Алюминиевые провода:
Фольга:
Различные лекарства,применяемые при болезнях
Слайд 33Извлечение железа из руд.
2C + O2 → 2CO↑
3CO + Fe2O3 →
CaCO3 → CaO + CO2↑
CaO + SiO2 → CaSiO3
Слайд 35Применение.
Железо — основной компонент сталей и чугунов — важнейших конструкционных материалов.
Магнитная окись железа — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Уникальные магнитные свойства ряда сплавов на основе железа способствовали тому, что эти сплавы названы ферро-магнитными. Они широко применяются в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Слайд 38Металлов в природе значительно больше, чем неметаллов.
На внешнем электронном слое у
Изученные металлы I-III групп и железо являются активными и в электрохимическом ряду напряжений находятся левее водорода. Следовательно, они могут вытеснять водород из воды или раствора кислот.
Металлы – основной конструкционный материал техники. Железный век продолжается!
Выводы