- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Менделеевтің жасаған периодтық кестесі
Содержание
- 1. Презентация по химии на тему Менделеевтің жасаған периодтық кестесі
- 2. “Химиялық элементтердің қасиеттері, сондай-ақ элементтер қосылыстарының қасиеттері
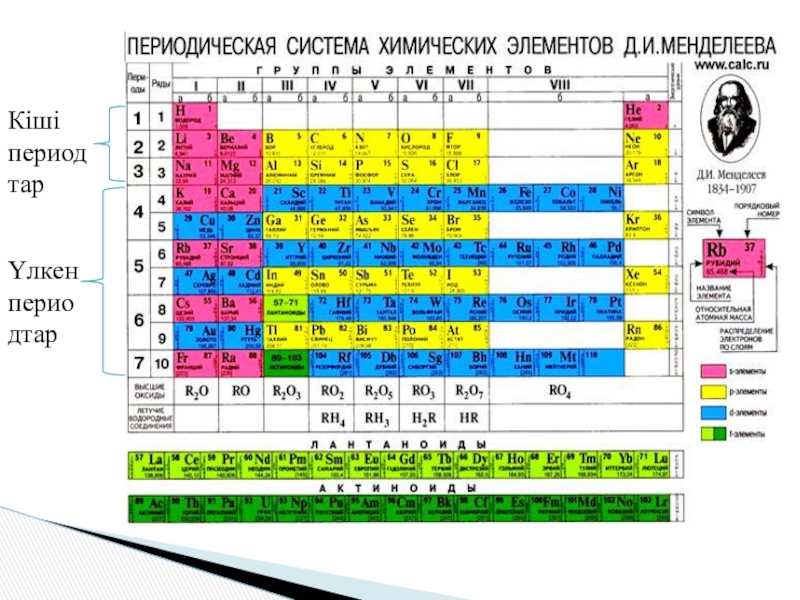
- 3. Кіші периодтарҮлкен периодтар
- 4. Электртерістілік- бұл қосылыстағы атомның өзіне электрондарды
- 5. Тотықтырғыш қасиеті топ бойынша артып, период бойынша
- 6. Атом радиусы период бойынша солдан оңға қарай
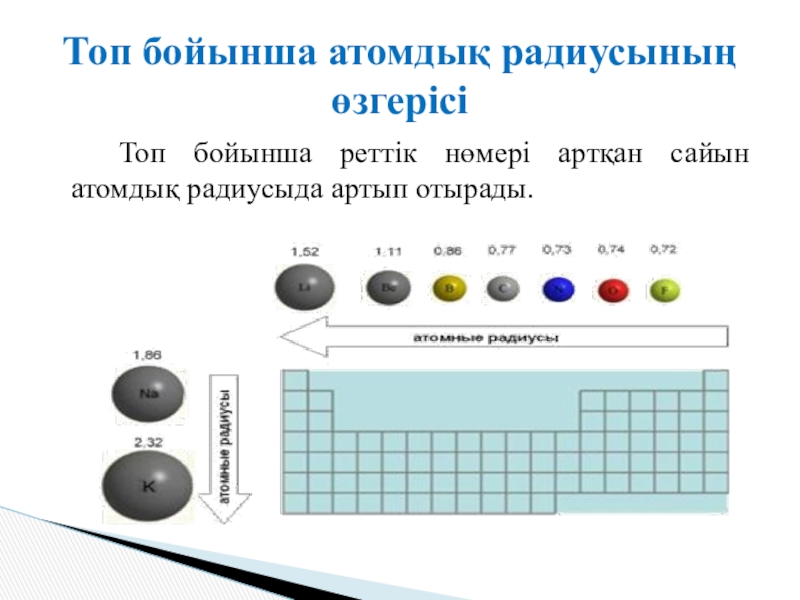
- 7. Топ бойынша реттік нөмері артқан сайын атомдық радиусыда артып отырады.Топ бойынша атомдық радиусының өзгерісі
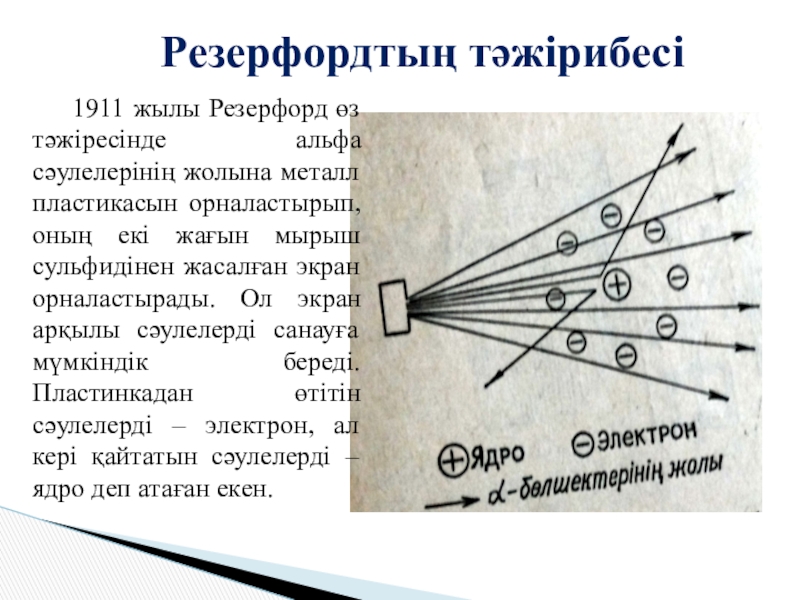
- 8. Резерфордтың тәжірибесі 1911 жылы Резерфорд өз тәжіресінде альфа
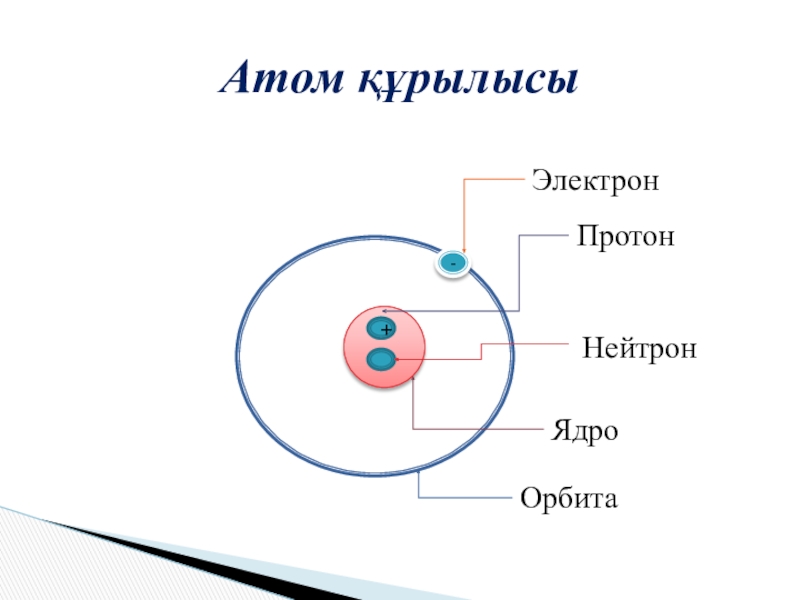
- 9. Атом құрылысы+-ЭлектронПротонНейтронЯдроОрбита
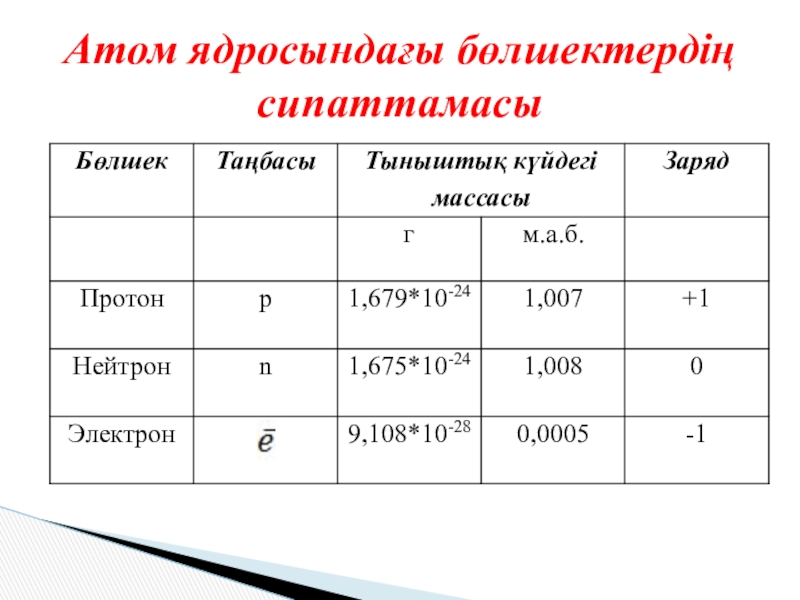
- 10. Атом ядросындағы бөлшектердің сипаттамасы
- 11. 1. Бас квант саны- энергетикалық деңлердің нөмерін
- 12. Слайд 12
- 13. Слайд 13
- 14. Слайд 14
- 15. Слайд 15
“Химиялық элементтердің қасиеттері, сондай-ақ элементтер қосылыстарының қасиеттері мен пішіндері олардың атомдарының ярдо зарядына перодты түрде тәуелді”.Д.И.Менделеевтің периодтық заңының тұжырымдамасы:
Слайд 2 “Химиялық элементтердің қасиеттері, сондай-ақ элементтер қосылыстарының қасиеттері мен пішіндері олардың атомдарының
ярдо зарядына перодты түрде тәуелді”.
Д.И.Менделеевтің периодтық заңының тұжырымдамасы:
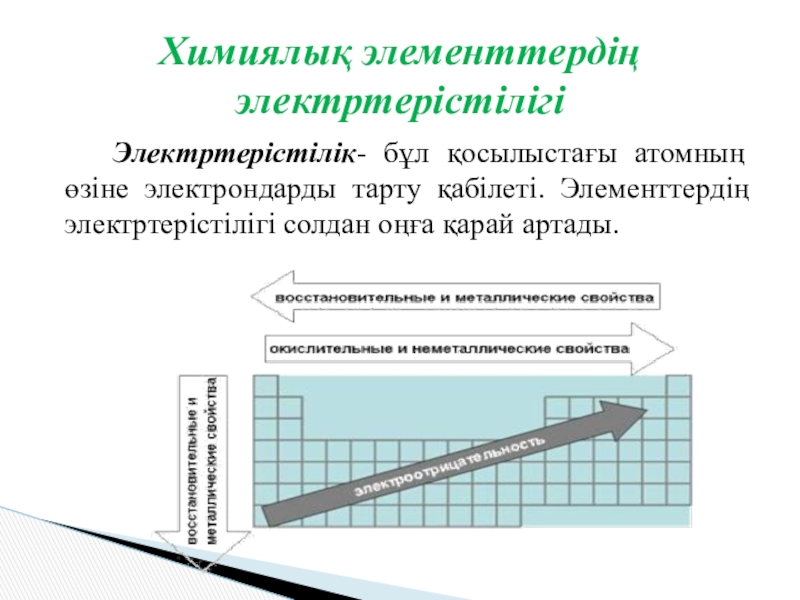
Слайд 4 Электртерістілік- бұл қосылыстағы атомның өзіне электрондарды тарту қабілеті. Элементтердің электртерістілігі
солдан оңға қарай артады.
Химиялық элементтердің электртерістілігі
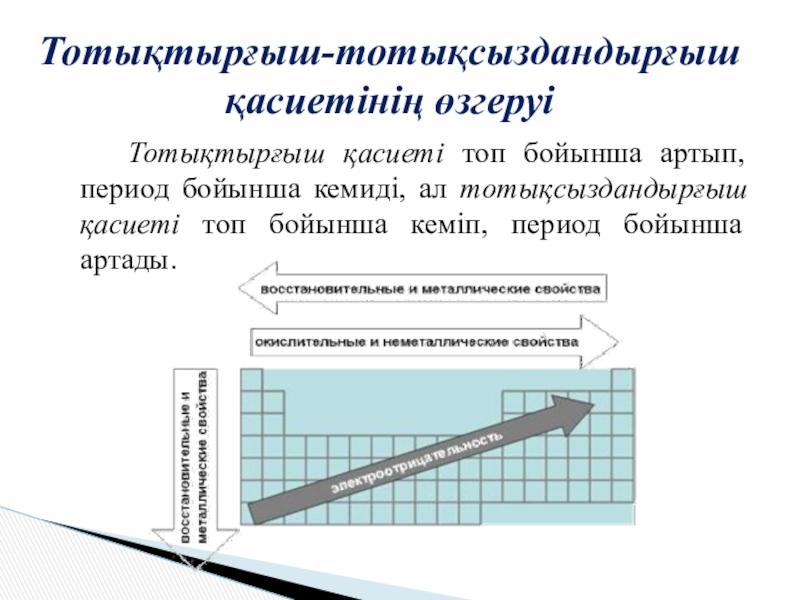
Слайд 5 Тотықтырғыш қасиеті топ бойынша артып, период бойынша кемиді, ал тотықсыздандырғыш қасиеті
топ бойынша кеміп, период бойынша артады.
Тотықтырғыш-тотықсыздандырғыш қасиетінің өзгеруі
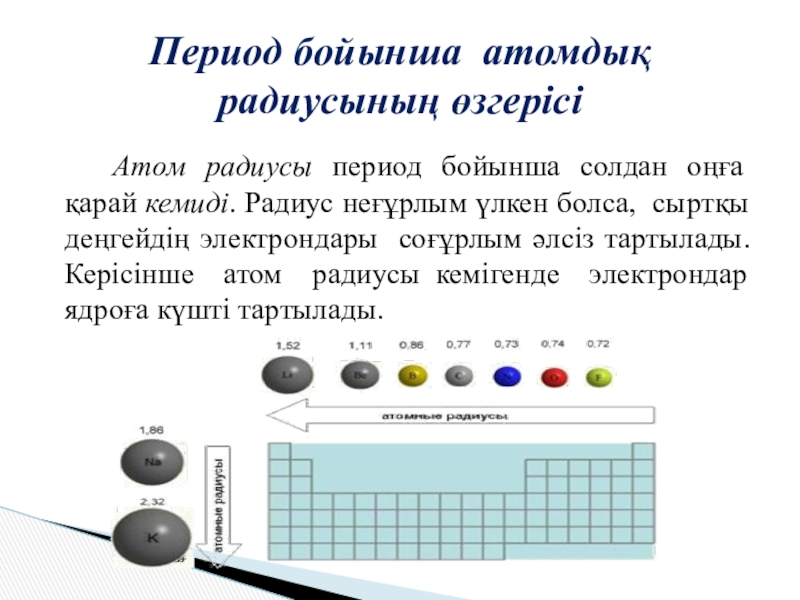
Слайд 6 Атом радиусы период бойынша солдан оңға қарай кемиді. Радиус неғұрлым үлкен
болса, сыртқы деңгейдің электрондары соғұрлым әлсіз тартылады. Керісінше атом радиусы кемігенде электрондар ядроға күшті тартылады.
Период бойынша атомдық радиусының өзгерісі
Слайд 7 Топ бойынша реттік нөмері артқан сайын атомдық радиусыда артып отырады.
Топ бойынша
атомдық радиусының өзгерісі
Слайд 8Резерфордтың тәжірибесі
1911 жылы Резерфорд өз тәжіресінде альфа сәулелерінің жолына металл пластикасын
орналастырып, оның екі жағын мырыш сульфидінен жасалған экран орналастырады. Ол экран арқылы сәулелерді санауға мүмкіндік береді. Пластинкадан өтітін сәулелерді – электрон, ал кері қайтатын сәулелерді – ядро деп атаған екен.
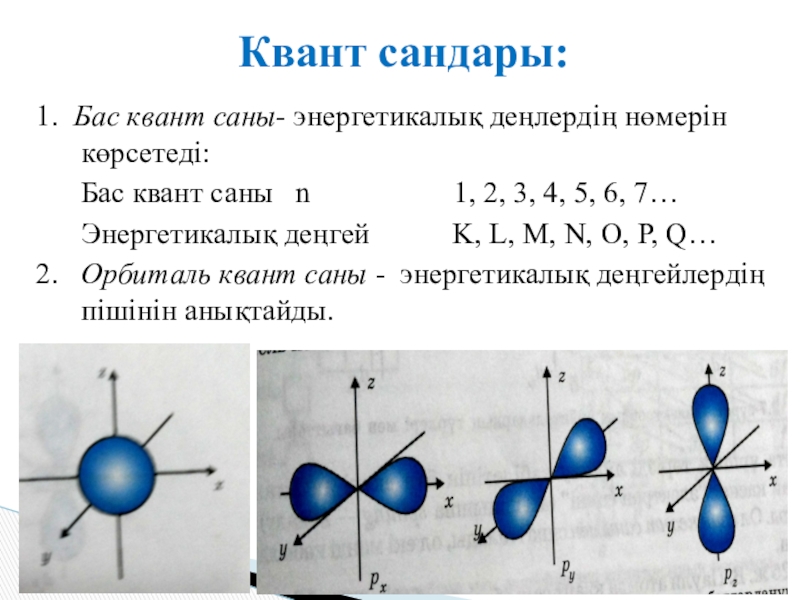
Слайд 111. Бас квант саны- энергетикалық деңлердің нөмерін көрсетеді:
Бас
квант саны n 1, 2, 3, 4, 5, 6, 7…
Энергетикалық деңгей K, L, M, N, O, P, Q…
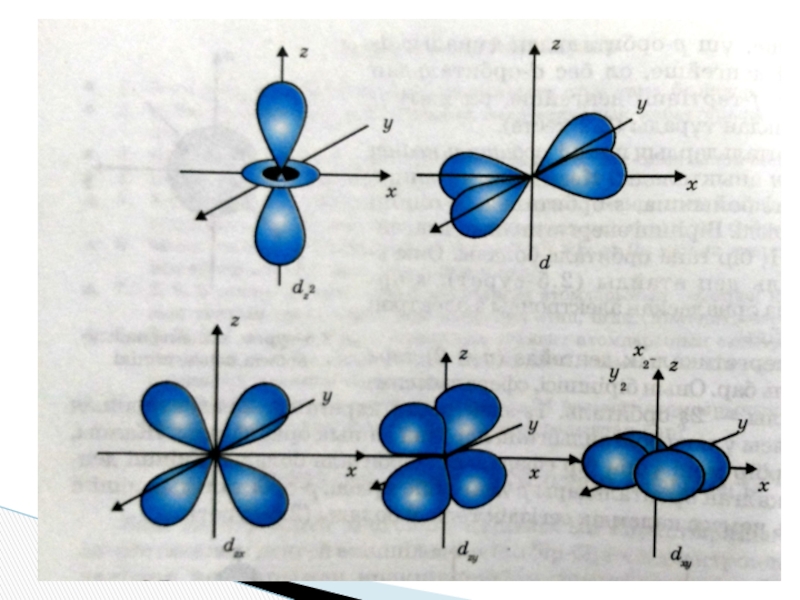
2. Орбиталь квант саны - энергетикалық деңгейлердің пішінін анықтайды.
Энергетикалық деңгей K, L, M, N, O, P, Q…
2. Орбиталь квант саны - энергетикалық деңгейлердің пішінін анықтайды.
Квант сандары: