- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Ковалентная химическая связь
Содержание
- 1. Презентация по химии на тему Ковалентная химическая связь
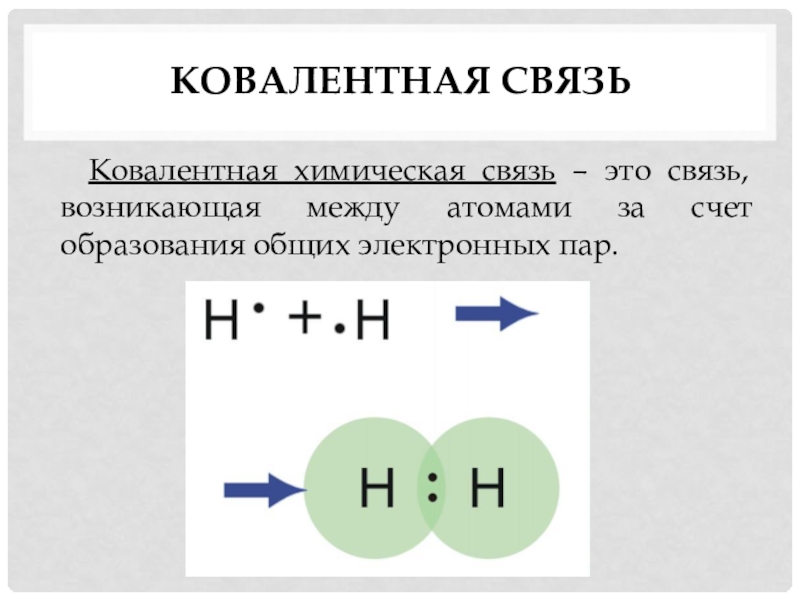
- 2. ковалентная связь Ковалентная химическая связь – это связь, возникающая между атомами за счет образования общих электронных пар.
- 3. Типы ковалентной связиКовалентная химическая связьПолярная – связь,
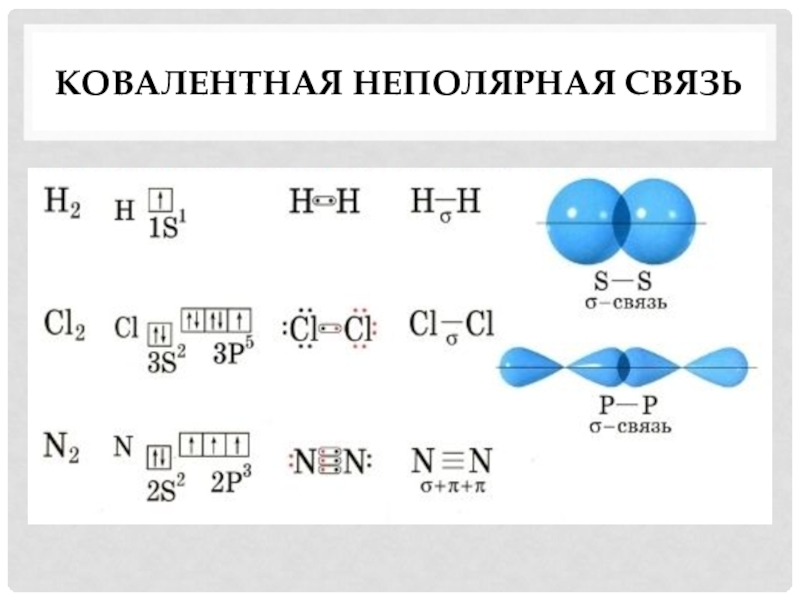
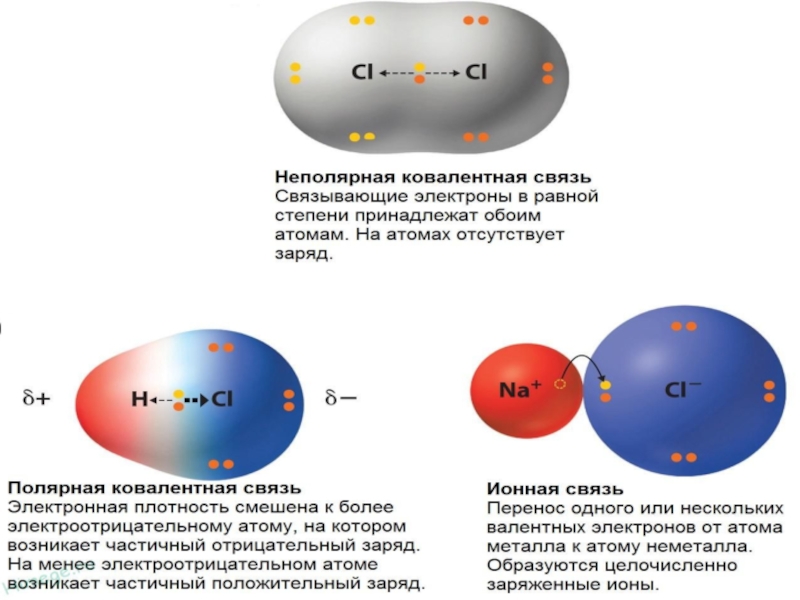
- 4. Ковалентная неполярная связь
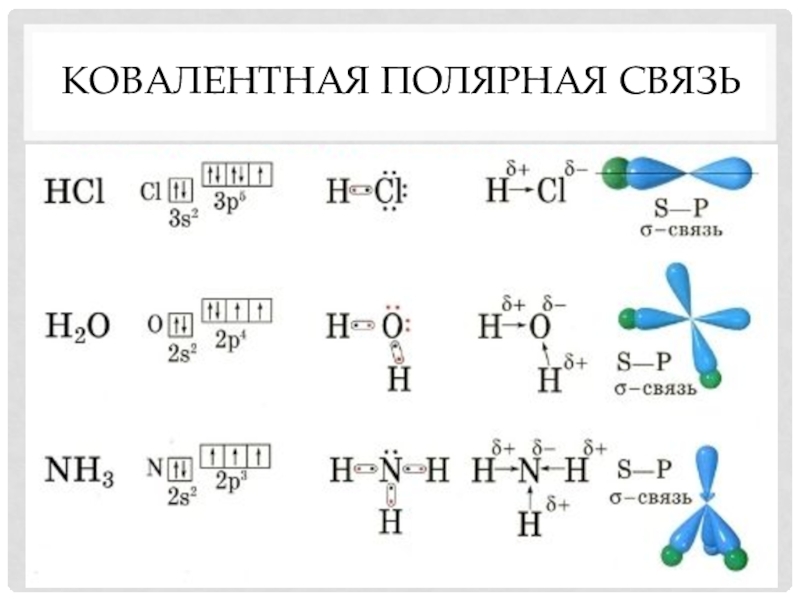
- 5. Ковалентная полярная связь
- 6. ЭлектроотрицательностьЭлектроотрицательность – это способность атомов химических элементов оттягивать к себе общие электронные пары.Ряд электроотрицательности:
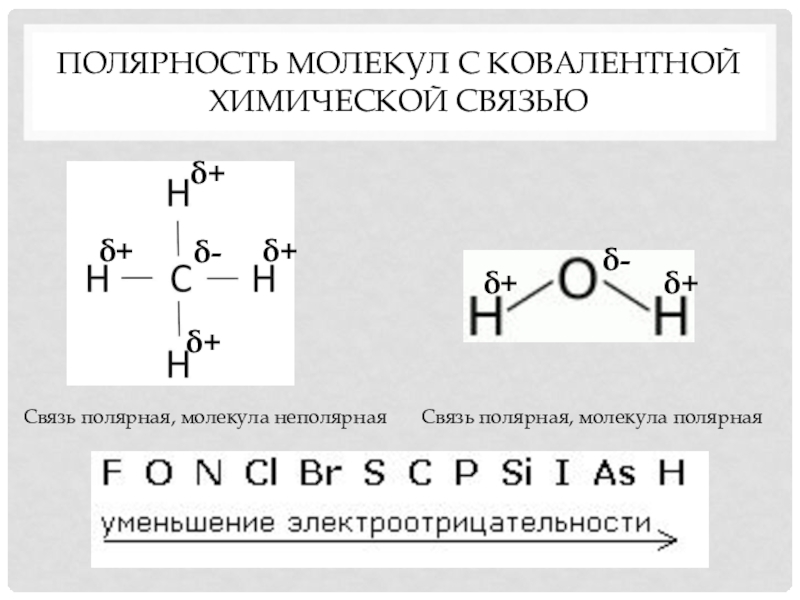
- 7. Полярность молекул с ковалентной химической связьюСвязь полярная, молекула неполярнаяδ-δ+δ+δ+δ+Связь полярная, молекула полярнаяδ-δ+δ+
- 8. Задания1. Какая молекула более полярная?HF – HCl
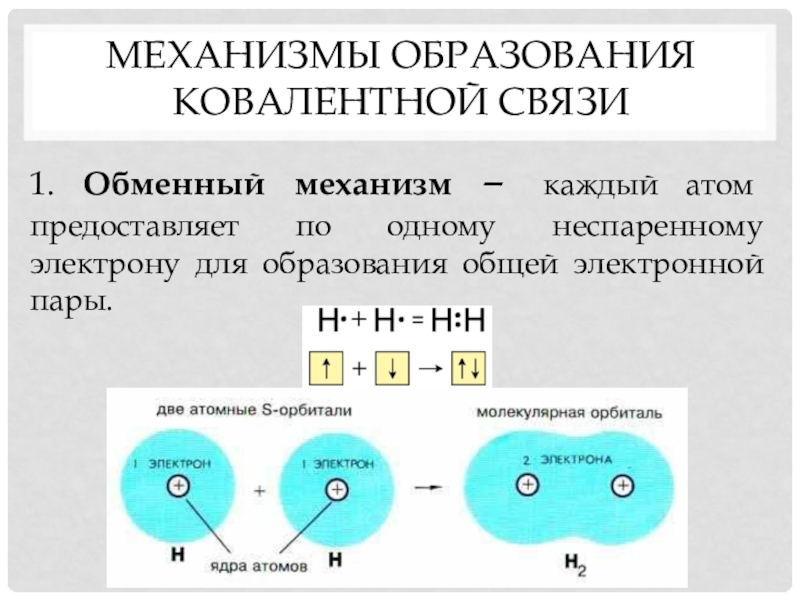
- 9. Механизмы образования ковалентной связи1. Обменный механизм –
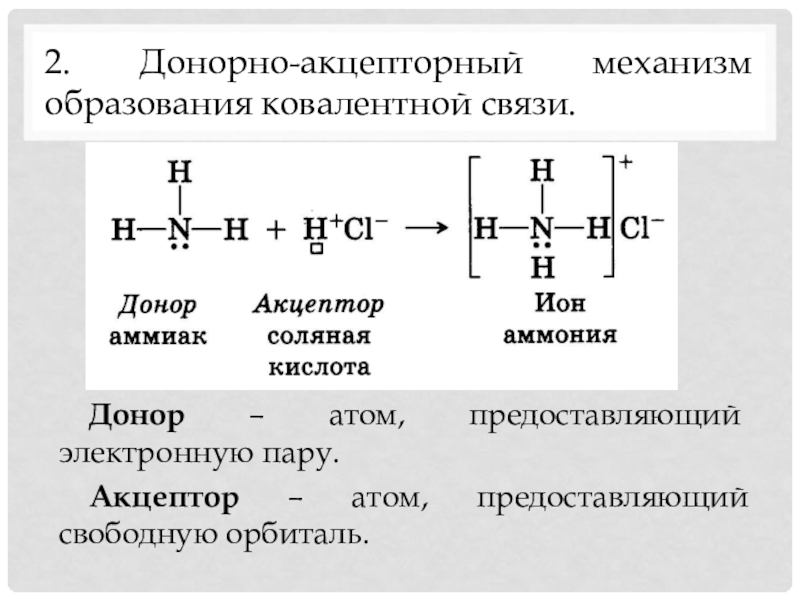
- 10. 2. Донорно-акцепторный механизм образования ковалентной связи. Донор – атом, предоставляющий электронную пару. Акцептор – атом, предоставляющий свободную орбиталь.
- 11. Слайд 11
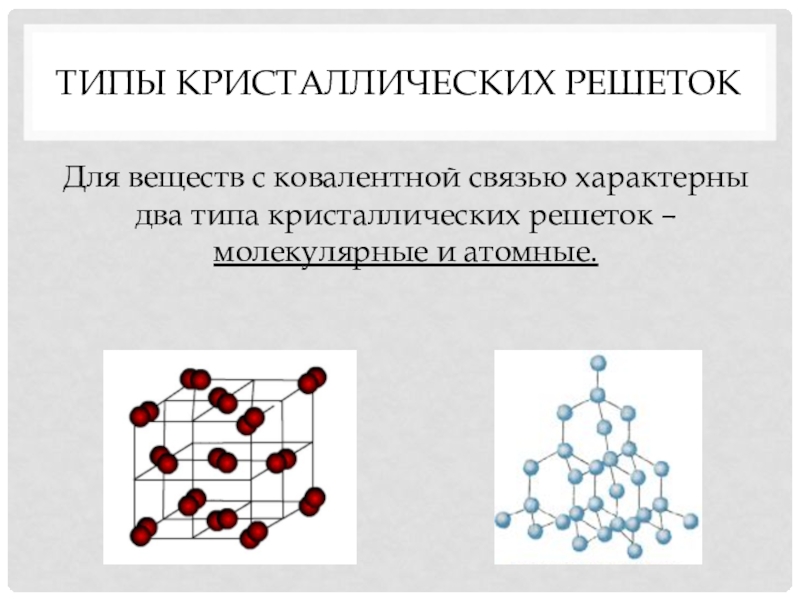
- 12. Типы Кристаллических решетокДля веществ с ковалентной связью характерны два типа кристаллических решеток – молекулярные и атомные.
- 13. Слайд 13
- 14. Слайд 14
- 15. Проверочная работа
- 16. ПроверкаЗадание 1. Вставьте пропущенные слова.Ковалентная химическая связь
- 17. Задание 2. Какие механизмы образования ковалентной связи представлены на рисунках?ПроверкаОбменныйДонорно-акцепторный
- 18. Задание 3. Вставьте пропущенные слова.При образовании ковалентной
- 19. ПроверкаЗадание 5. Сопоставьте свойства кристаллических решеток с их типами.
- 20. Критерии оценивания5 заданий выполнено верно – «5»4 задания – «4»3 задания - «3»
- 21. Вопросы для самоконтроляОтветьте на вопросы:Какую химическую связь
- 22. 1) Выучить основные определения.2) Определить тип связи
- 23. Рефераты Работы И.В. Деберейнера как предшественника Д.
ковалентная связь Ковалентная химическая связь – это связь, возникающая между атомами за счет образования общих электронных пар.
Слайд 2ковалентная связь
Ковалентная химическая связь – это связь, возникающая между атомами за
счет образования общих электронных пар.
Слайд 3Типы ковалентной связи
Ковалентная химическая связь
Полярная –
связь, образованная атомами разных химических
элементов.
HCl
HCl
Неполярная –
связь, образованная атомами одного химического элемента.
H2
Слайд 6Электроотрицательность
Электроотрицательность – это способность атомов химических элементов оттягивать к себе общие
электронные пары.
Ряд электроотрицательности:
Ряд электроотрицательности:
Слайд 7Полярность молекул с ковалентной химической связью
Связь полярная, молекула неполярная
δ-
δ+
δ+
δ+
δ+
Связь полярная, молекула
полярная
δ-
δ+
δ+
Слайд 8Задания
1. Какая молекула более полярная?
HF – HCl – HBr – HI
2. Определить тип ковалентной связи:
H2S NH3 H2 SO3 O2
Слайд 9Механизмы образования ковалентной связи
1. Обменный механизм – каждый атом предоставляет по
одному неспаренному электрону для образования общей электронной пары.
Слайд 102. Донорно-акцепторный механизм образования ковалентной связи.
Донор – атом, предоставляющий электронную пару.
Акцептор
– атом, предоставляющий свободную орбиталь.
Слайд 12Типы Кристаллических решеток
Для веществ с ковалентной связью характерны два типа кристаллических
решеток – молекулярные и атомные.
Слайд 16Проверка
Задание 1. Вставьте пропущенные слова.
Ковалентная химическая связь – это связь, возникающая
между атомами за счет образования общих электронных пар.
Ковалентная полярная связь – связь, образованная атомами разных химических элементов.
Ковалентная неполярная связь – связь, образованная атомами одного химического элемента.
Ковалентная полярная связь – связь, образованная атомами разных химических элементов.
Ковалентная неполярная связь – связь, образованная атомами одного химического элемента.
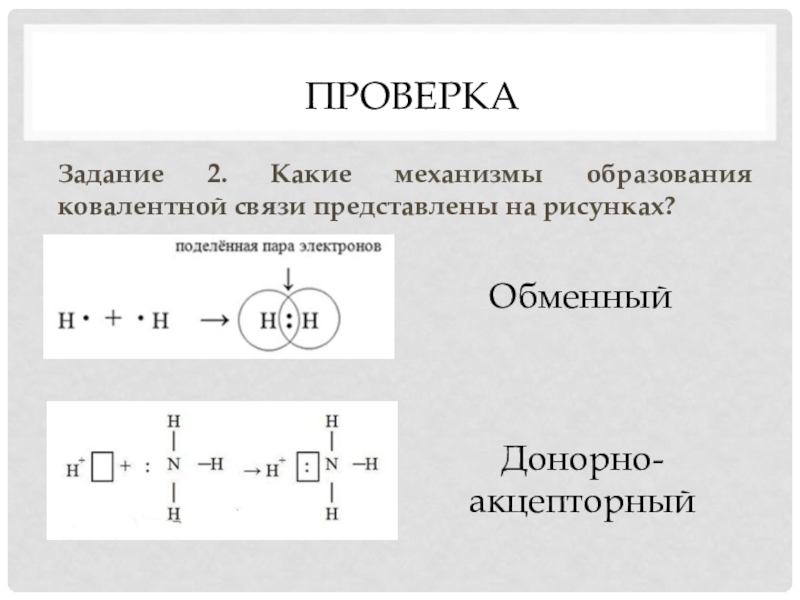
Слайд 17Задание 2. Какие механизмы образования ковалентной связи представлены на рисунках?
Проверка
Обменный
Донорно-
акцепторный
Слайд 18Задание 3. Вставьте пропущенные слова.
При образовании ковалентной связи по донорно-акцепторному механизму,
донор предоставляет электронную пару, а акцептор свободную орбиталь.
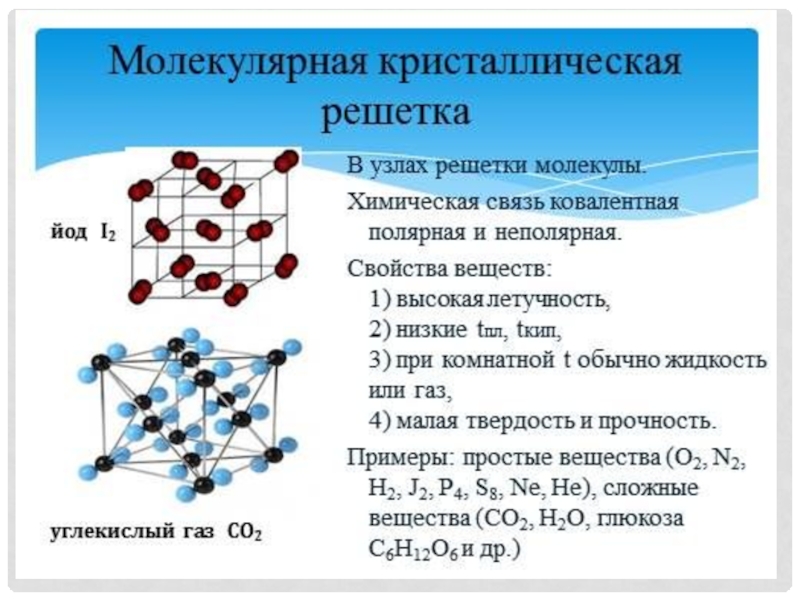
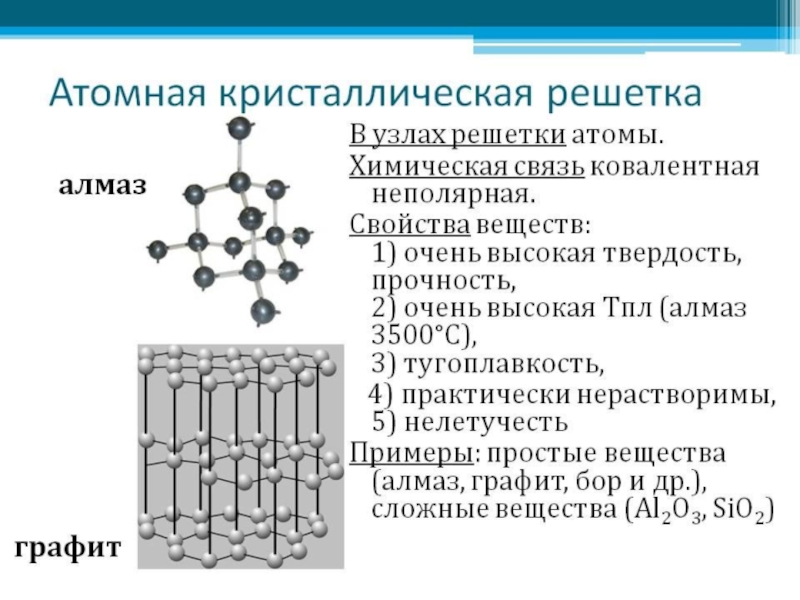
Задание 4. Какие типы кристаллических решеток, характерные для ковалентной связи, представлены на рисунках?
Задание 4. Какие типы кристаллических решеток, характерные для ковалентной связи, представлены на рисунках?
Проверка
Молекулярная
Атомная
Слайд 21Вопросы для самоконтроля
Ответьте на вопросы:
Какую химическую связь называют ковалентной?
Дайте определение понятия
«электроотрицательность».
Может ли молекула быть неполярной, если связи в ней полярные?
Каковы механизмы образования ковалентной связи?
Дайте определение «молекулярной кристаллической решетки». Чем она отличается от ионной?
Дайте определение «молекулярной кристаллической решетки». Чем она отличается от ионной и атомной кристаллических решеток?
Может ли молекула быть неполярной, если связи в ней полярные?
Каковы механизмы образования ковалентной связи?
Дайте определение «молекулярной кристаллической решетки». Чем она отличается от ионной?
Дайте определение «молекулярной кристаллической решетки». Чем она отличается от ионной и атомной кристаллических решеток?
Слайд 221) Выучить основные определения.
2) Определить тип связи для следующих веществ:
ZnF2, KCl,
Cl2, N2, CO, NaF, Al2O3, Na2O2
Слайд 23Рефераты
Работы И.В. Деберейнера как предшественника Д. И. Менделеева
Работы А.Э.
Шанкуртуа как предшественника Д. И. Менделеева
Работы Ньюлендса как предшественника Д. И. Менделеева
Работы Л.Ю. Мейера как предшественника Д. И. Менделеева
Съезд химиков в Карлсруэ
Работы Ньюлендса как предшественника Д. И. Менделеева
Работы Л.Ю. Мейера как предшественника Д. И. Менделеева
Съезд химиков в Карлсруэ