- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Коррозия металлов ( 11 класс)
Содержание
- 1. Презентация по химии на тему Коррозия металлов ( 11 класс)
- 2. Слайд 2
- 3. Вставь пропуски Радиус атомов металлов _____ радиуса
- 4. Коррозия металлов
- 5. Знать – значить победить
- 6. 1. Коррозия – это процесс самопроизвольного разрушения
- 7. Ущерб, наносимый коррозиейМировая потеря 20 млн. тонн металла в годЕще более значимы косвенные потери
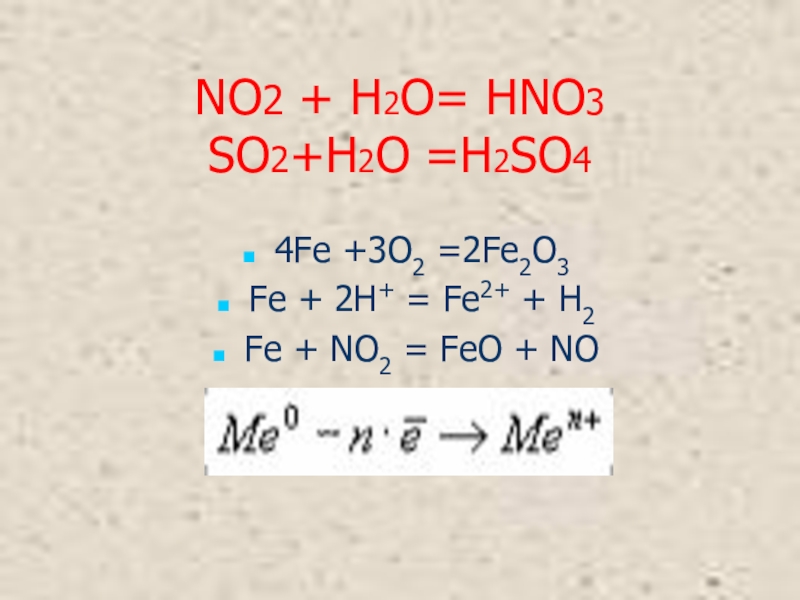
- 8. NO2 + H2O= HNO3 SO2+H2O =H2SO44Fe +3O2 =2Fe2O3Fe + 2H+ = Fe2+ + H2Fe + NO2 = FeO + NO
- 9. Виды коррозии
- 10. По виду коррозионной среды
- 11. Газовая Атмосферная Жидкостная Почвенная Блуждающими токами
- 12. По характеру разрушений
- 13. Сплошная коррозияРавномерная Неравномерная
- 14. Местная коррозияЯзвенная Точечная Пятнами
- 15. Причины возникновения местной коррозииСоль на дорогахМорская водаМежкристаллитная коррозия
- 16. По процессам
- 17. 1 группа. выясняют причину химической коррозии (
- 18. Химическая коррозияХимическая коррозия – самопроизвольное разрушение металлов
- 19. Электрохимическая коррозияЭлектрохимическая коррозия металлов – самопроизвольный процесс
- 20. Защита металлов от коррозии
- 21. Применение …….Ингибиторы - это вещества, способные ………….протекание химических процессов или останавливать их. Известно более 5 тысяч
- 22. Нанесение
- 23. Покрытие
- 24. Покрытие антикоррозионным металлом
- 25. Задача 1Сантехника попросили поставить водопроводный кран, на
- 26. Задача 2Человек поставил на зуб золотую коронку,
- 27. Мое настроение на уроке1) раздражение;2) злость;3) радость;4) безразличие;5) удовлетворение;6) вдохновение;7) скука;8) тревога;9) тоска:10) спокойствие;11) уверенность;12) неуверенность.
Слайд 3Вставь пропуски
Радиус атомов металлов _____ радиуса атомов неметаллов.
Во всех
Атомы металлов связаны между собой с помощью химической _____________________ связи.
При комнатной температуре металлы находятся ______ агрегатном состоянии, за исключением ____. Металлы хорошо проводят _____ и _____.
Самый тяжёлый металл – _____, самый легкий – _____, самый тугоплавкий – _______, самый легкоплавкий – _____.
Слайд 61. Коррозия – это процесс самопроизвольного разрушения металла под действием окружающей
2. Коррозия– это процесс перехода металла в то природное, естественное состояние, в котором
мы встречаем его в земной коре.
Слайд 7Ущерб, наносимый коррозией
Мировая потеря 20 млн. тонн металла в год
Еще более
Слайд 171 группа.
выясняют причину химической коррозии ( с.86 и дополнительный материал)
2
Выясняют причину электрохимической коррозии (с.87 и . приложение).
3 группа.
Выясняют, как пройдёт коррозия, если между собой будут соприкасаться металлы разной активности.(с. 86. приложение)
Домашнее задание
Изучить способы борьбы с коррозией.(сделать презентацию)
Слайд 18Химическая коррозия
Химическая коррозия – самопроизвольное разрушение металлов
в среде окислительного газа
повышенных температурах или в жидких не электролитах.
2Fe + 3Cl2 = 2FeCl3
4Fe + 3О2 = 2Fe2 О3
Газовая
В жидких
не электролитах
В нефти
В сере
В органических веществах
Cu + S = CuS
2 Ag + S = Ag2S
2Al + 6ССl4 = 3C2Cl6 + 3AlCl3
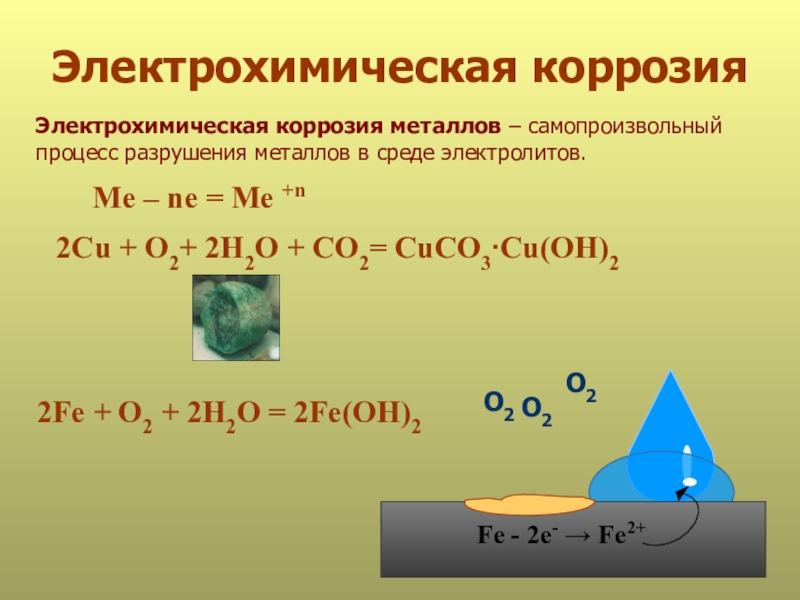
Слайд 19Электрохимическая коррозия
Электрохимическая коррозия металлов – самопроизвольный
процесс разрушения металлов в среде
2Fe + O2 + 2H2O = 2Fe(OH)2
Me – ne = Me +n
Fe - 2е- → Fe2+
О2
О2
2Сu + O2+ 2H2O + CO2= CuCO3∙Cu(OH)2
О2
Слайд 21Применение …….
Ингибиторы - это вещества,
способные ………….протекание
химических процессов или
останавливать
Известно более 5 тысяч
Слайд 25Задача 1
Сантехника попросили поставить водопроводный кран,
на стальную трубу. В наличии
Слайд 26Задача 2
Человек поставил на зуб золотую коронку, по истечении
некоторого времени
коронке, но средств на коронку у него нет.
Возможен ли вариант, чтобы поставить на зуб
стальную коронку?
Что Вы можете предложить в решении данной проблемы?
Слайд 27Мое настроение на уроке
1) раздражение;
2) злость;
3) радость;
4) безразличие;
5) удовлетворение;
6) вдохновение;
7) скука;
8)
9) тоска:
10) спокойствие;
11) уверенность;
12) неуверенность.