- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Коррозия
Содержание
- 1. Презентация по химии на тему Коррозия
- 2. КОРРОЗИЯ МЕТАЛЛОВ – физико-химическое или
- 3. Слово коррозия происходит от латинского «corrodo» –
- 4. Химическая коррозия
- 5. Многие металлы (например, алюминий) при коррозии покрываются
- 6. Электрохимическая коррозияКоррозия происходит в токопроводящей среде (в
- 7. Рассмотрим разрушение железного образца в присутствии примеси
- 8. 2. В щелочной или нейтральной среде:Fe 0
- 9. В результате коррозии железо ржавеет. Этот процесс
- 10. Гидроксид железа(III) очень неустойчив, быстро теряет воду
- 11. Катионы водорода и растворенный кислород- важнейшие окислители, вызывающие электрохимическую коррозию
- 12. Скорость коррозии тем больше, чем сильнее отличаются металлы по своей активности
- 13. Значительно усиливает коррозию повышение температуры
- 14. Зимой для удаления снега и льда с
- 15. Слайд 15
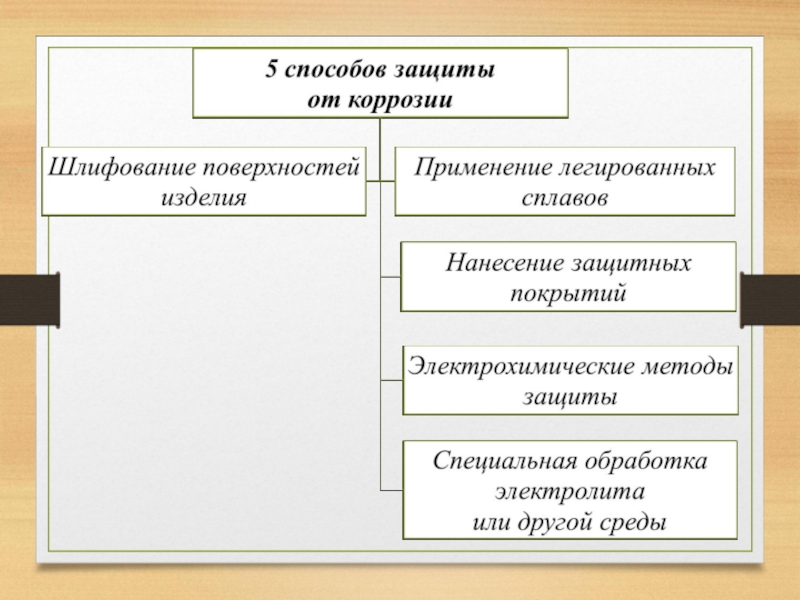
- 16. Способы защиты от коррозии
- 17. Слайд 17
- 18. 1. Шлифование поверхностей изделия, чтобы на них
- 19. 3.Нанесение защитных покрытий
- 20. Металлические – это покрытие другими металлами, на
- 21. 4. Электрохимические методы защиты *Протекторная (анодная)
- 22. 5. Специальная обработка электролита или другой среды,
- 23. Источники информацииХимия 11 класс: Учеб. для общеобразоват.
- 24. Источники информацииhttp://smolchess.ru/otdelka-i-materialy/osnovnye-sposoby-borby-s-korroziej-metallov.htmlhttp://vasi.net/community/all/2012/08/28/kak_zashhitit_instrument_ot_rzhavchiny.htmlhttp://lori.ru/344835http://lori.ru/64545http://nnm.ru/blogs/Fortunato1991/o_tom_kak_rzhavye_gvozdi_prevratilis_v_biznes_so_100-milliardnym_oborotom/http://chemistry.ru/course/content/chapter7/section/paragraph5/theory.htmlhttp://transtim.narod.ru/zaschita_kuzova_avtomobilya_ot_korrozii_/ustroistvo_elektrohimicheskoi_zaschiti_ot_korrozii_kuzova_avtomobilya_/fotografii_ustanovlenoi_zaschiti_na_avtomobile/
Слайд 2 КОРРОЗИЯ МЕТАЛЛОВ – физико-химическое или химическое взаимодействие между металлом
Химический энциклопедический словарь
Слайд 3Слово коррозия происходит от латинского «corrodo» – «грызу»
Коррозия вызывается химической реакцией металла с веществами окружающей среды, протекающей на границе металла и среды. Чаще всего это окисление металла, например, кислородом воздуха или кислотами, содержащимися в растворах, с которыми контактирует металл. Особенно подвержены этому металлы, расположенные в ряду напряжений (ряду активности) левее водорода, в том числе железо.
Слайд 4Химическая коррозия
2 Fe+ 3 SO2 + 3 O2 ? Fe2(SO4)3
0 0 t +3 -1
2 Fe + 3 Cl2 ? 2 FeCl3
0 0 t +2 -2
2 Zn + O2 ? 2 ZnO
Коррозия происходит в непроводящей ток среде.
Например, взаимодействие металла с сухими газами или жидкостями - неэлектролитами (бензином, керосином и т.д.)
Слайд 5Многие металлы (например, алюминий) при коррозии покрываются плотной, оксидной пленкой, которая
Слайд 6Электрохимическая коррозия
Коррозия происходит в токопроводящей среде (в электролите) с возникновением внутри
Металлы не однородны и содержат различные примеси. При контакте их с электролитами одни участки поверхности выполняют роль- анодов, другие- катодов.
Слайд 7
Рассмотрим разрушение железного образца в присутствии примеси олова.
1. В кислой среде:
На железе, как более активном металле, при соприкосновении с электролитом происходят процессы окисления (растворения) металла и перехода его катионов в электролит:
Fe0 – 2 e = Fe 2+ (анод)
На катоде (олово) происходит восстановление катионов водорода:
2H+ + 2e ? H20
Ржавчина не образуется, т.к. ионы железа (Fe 2+) переходят в раствор
Слайд 82. В щелочной или нейтральной среде:
Fe 0 – 2e ? Fe
O20 + 2H2O + 4e ? 4OH – (на катоде)
________________________________________________________
Fe 2+ + 2 OH - ? Fe(OH)2
4 Fe (OH)2 + O2 + 2H2O = 4 Fe (OH)3 ( Ржавчина)
Слайд 9В результате коррозии железо ржавеет. Этот процесс очень сложен и включает
4Fe + 6H2O (влага) + 3O2 (воздух) = 4Fe(OH)3
Слайд 10Гидроксид железа(III) очень неустойчив, быстро теряет воду и превращается в оксид
Слайд 11
Катионы водорода и растворенный кислород- важнейшие окислители, вызывающие электрохимическую коррозию
Слайд 14Зимой для удаления снега и льда с тротуаров используют техническую соль.
Слайд 181. Шлифование поверхностей изделия, чтобы на них не задерживалась влага. 2. Применение
Слайд 19
3.Нанесение защитных покрытий
Неметаллические – неокисляющиеся масла, специальные лаки, краски, эмали.
Химические – искусственно создаваемые поверхностные плёнки: оксидные, нитридные, силицидные, полимерные и др. Например, все стрелковое оружие и детали многих точных приборов подвергают воронению – это процесс получения тончайшей плёнки оксидов железа на поверхности стального изделия.
Слайд 20Металлические – это покрытие другими металлами, на поверхности которых под действием
Слайд 214. Электрохимические методы защиты *Протекторная (анодная) – к защищаемой металлической конструкции присоединяют
*Катодная – металлоконструкцию подсоединяют к катоду внешнего источника тока , что исключает возможность её анодного разрушения.
Слайд 225. Специальная обработка электролита или другой среды, в которой находится защитная
Введение веществ - ингибиторов, замедляющих коррозию. Примеры использования современных ингибиторов: соляная кислота при перевозке и хранении прекрасно «укрощается» производными бутиламина, а серная кислота –азотной кислотой; летучий диэтиламин впрыскивают в различные ёмкости. Ингибиторы действуют только на металл, делая его пассивным по отношению к среде. Науке известно более 5 тыс. ингибиторов коррозии.
Удаление растворённого в воде кислорода (деаэрация). Этот процесс используют при подготовке воды, поступающей в котельные установки.
Слайд 23Источники информации
Химия 11 класс: Учеб. для общеобразоват. учреждений / О.С.Габриелян, Г.Г.Лысова.
Картинки для презентации:
http://www.korobov.ru/articles/6227/
http://www.stroim-s-umom.ru/zh/rzhavchina-nash-obshhij-vrag/
http://auto60.ru/ArticleDetail.aspx?id=47
http://www.everest-expo.ru/page31.html
http://volpcar.ru/stati/zashchita-kuzova-ot-korrozii.html
http://dic.academic.ru/dic.nsf/ruwiki/19752
http://900igr.net/fotografii/khimija/Korrozija-metallov/019-Korrozija-metallov.html
http://lozhki-vilki.ru/posuda-iz-nerzhavejushhej-stali/kak-vybrat-posudu-iz-nerzhavejushhej-stali